10.6: Příhradové Konstrukce v Krystalických Pevných látek
Jednotkové Buňky z Kovů
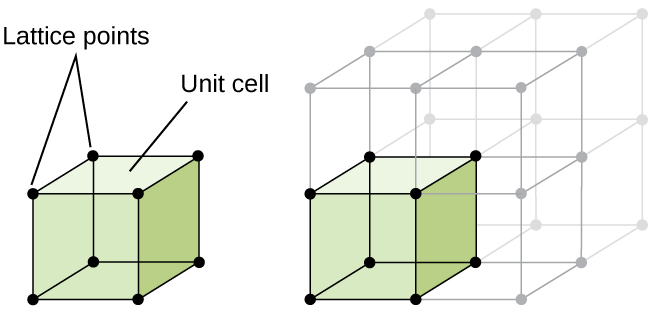
struktura krystalická látka, zda kov nebo ne, je nejlépe popsat tím, že zvažuje své nejjednodušší opakující se jednotky, který je označován jako jeho jednotkové buňky. Jednotková buňka se skládá z mřížkových bodů, které představují umístění atomů nebo iontů. Celá struktura se pak skládá z této jednotky buňky opakující se ve třech rozměrech, jak je znázorněno na obrázku \(\PageIndex{1}\).,
začněme naše zkoumání struktury krystalové mřížky a jednotkových buněk s nejjednodušší strukturou a nejzákladnější jednotkovou buňkou. Vizualizovat to, představte si, že přijetí velkého počtu totožných oblastech, jako jsou tenisové míčky, a uspořádání je rovnoměrně do nádoby., Nejjednodušší způsob, jak to udělat by bylo, aby se vrstvy, v nichž se koule v jedné vrstvě přímo nad ty ve vrstvě níže, jak je znázorněno na Obrázku \(\PageIndex{2}\). Toto uspořádání se nazývá jednoduchá kubická struktura a jednotková buňka se nazývá jednoduchá krychlová jednotka nebo primitivní krychlová jednotka.
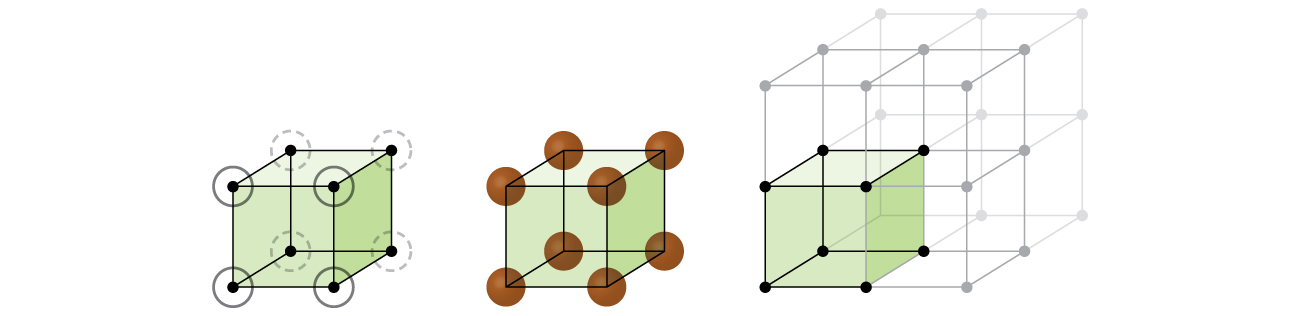
V jednoduché kubické struktury, koule nejsou zabalené tak těsně, jak by mohly být, a oni jen „vyplnit“ o 52% objemu kontejneru. Jedná se o relativně neefektivní uspořádání a pouze jeden kov (polonium, po) krystalizuje v jednoduché kubické struktuře. Jak je znázorněno na Obrázku \(\PageIndex{3}\), pevné s tento typ uspořádání se skládá z letadla (nebo vrstev), ve které každý atom kontakty pouze čtyři nejbližší sousedy v jeho vrstva; jeden atom přímo nad ním ve vrstvě nad, a jeden atom přímo pod ní ve vrstvě níže., Počet dalších částic, které každá částice v krystalické pevné kontakty je známý jako jeho koordinační číslo. Pro atom Polonia v jednoduchém krychlovém poli je koordinační číslo tedy šest.

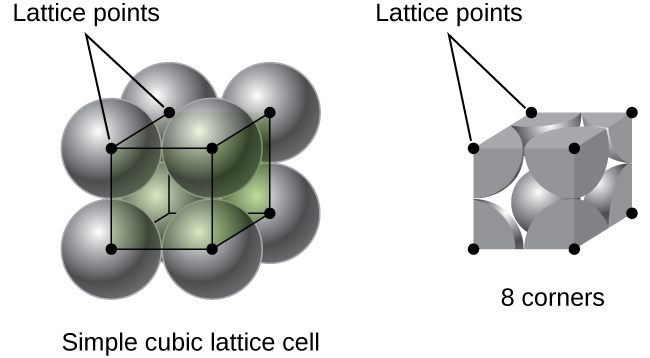
V jednoduché kubické mřížky jednotková buňka, která se opakuje ve všech směrech je krychle definované středy z osmi atomů, jak je znázorněno na Obrázku \(\PageIndex{4}\). Atomy v sousedních rozích této jednotky buňky se navzájem kontaktují, takže délka okraje této buňky se rovná dvěma atomovým poloměrům nebo jednomu atomovému průměru. Krychlová jednotka obsahuje pouze části těchto atomů, které jsou v ní. Vzhledem k tomu, že atom v rohu jednoduché krychlové jednotky je obsažen celkem osmi jednotkovými buňkami, pouze jedna osmina tohoto atomu je v určité jednotce buňky., A protože každá jednoduchá krychlová jednotka má jeden atom v každém z osmi „rohů“, existuje \(8× \ dfrac{1}{8}=1\) atom v jedné jednoduché krychlové jednotce buňky.
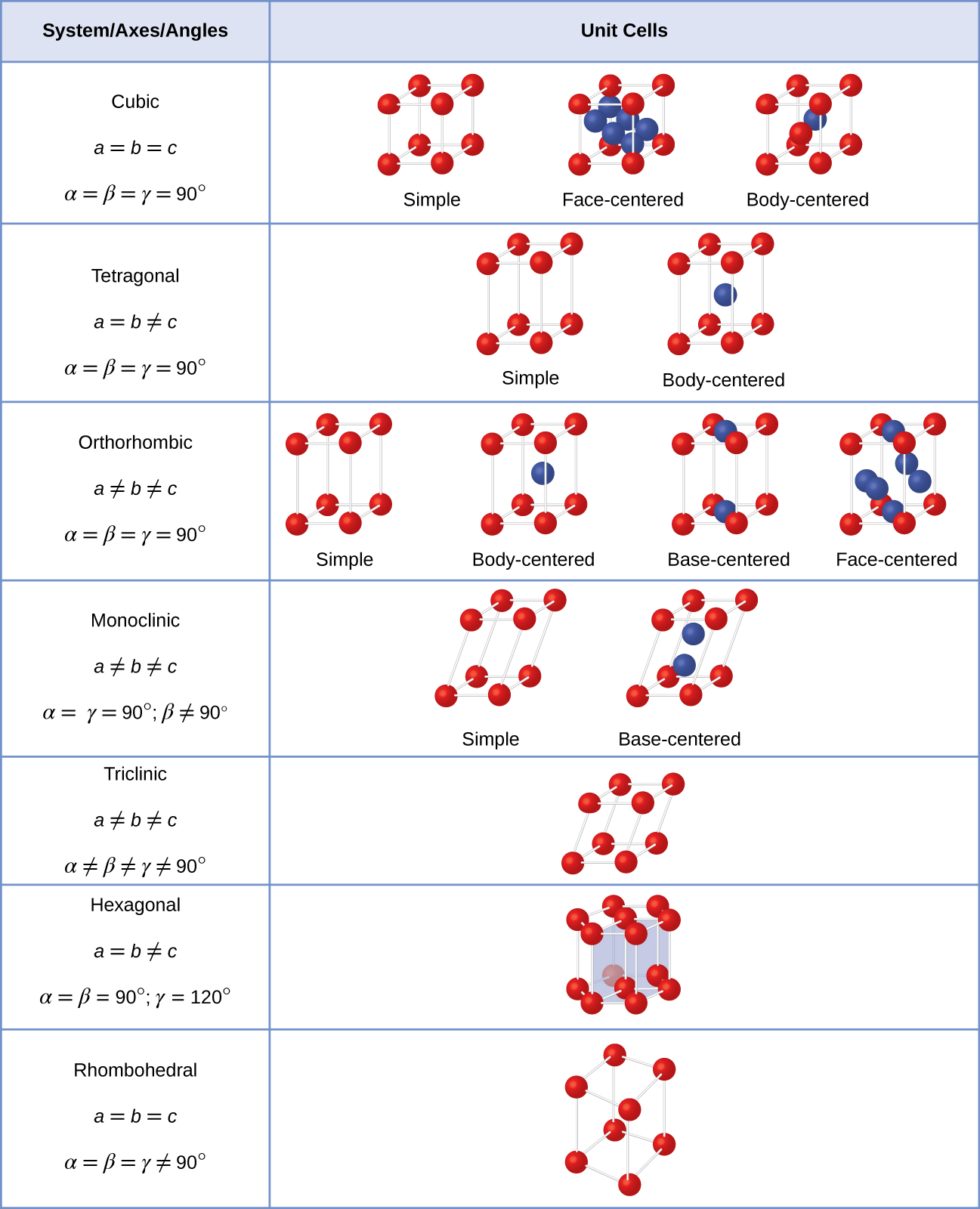
většina kovových krystalů je jedním ze čtyř hlavních typů jednotkových buněk., Teď se budeme soustředit na tři kubické jednotky buňky: jednoduchý krychlový (což jsme již viděli), body-centered cubic jednotkové buňky, a centrované kubické elementární buňky—z nichž všechny jsou znázorněny na Obrázku \(\PageIndex{5}\). (Všimněte si, že ve skutečnosti existuje sedm různých mřížkových systémů, z nichž některé mají více než jeden typ mřížky, celkem 14 různých typů jednotkových buněk. Složitější geometrie ponecháváme později v tomto modulu.,)
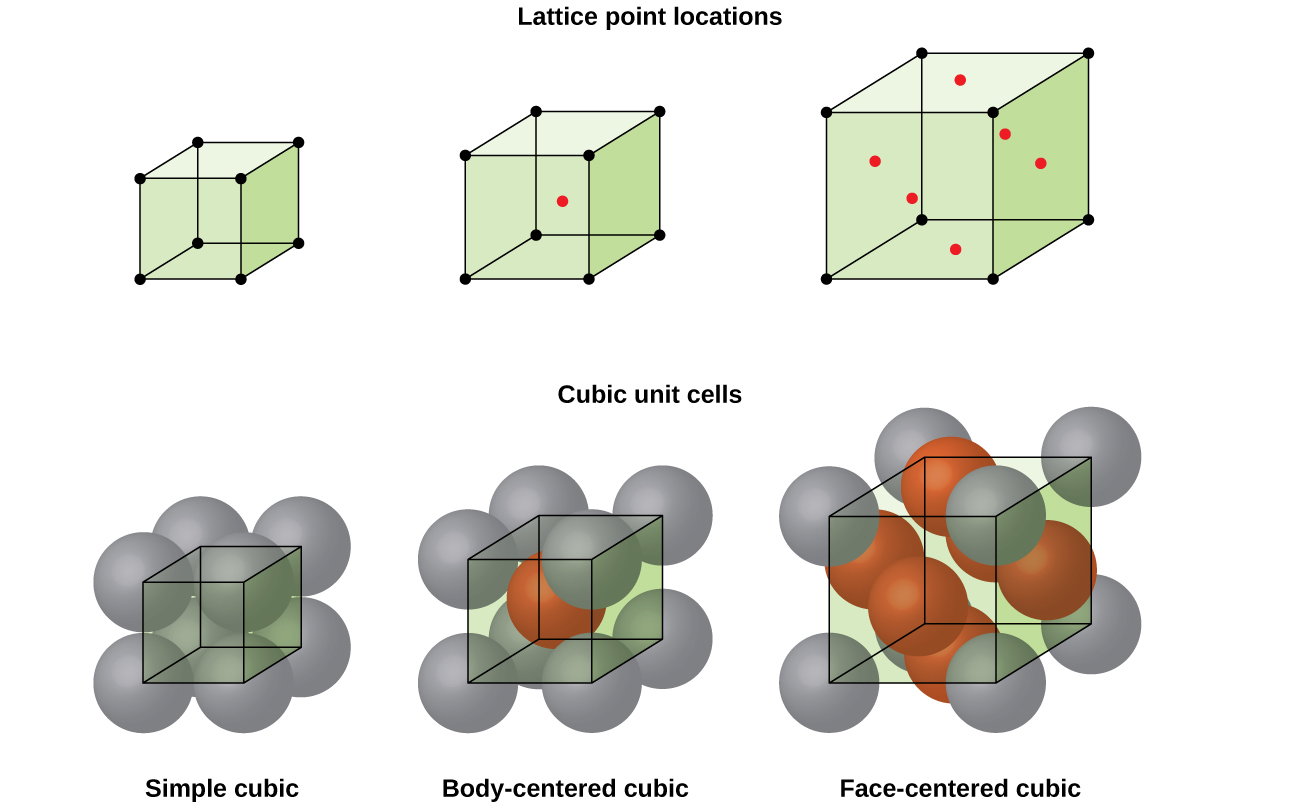
Některé kovy krystalizuje v takovém uspořádání, že má kubickou jednotku buněk s atomy na všechny rohy a atom ve středu, jak je znázorněno na Obrázku \(\PageIndex{6}\). Tomu se říká krychlová (BCC) pevná látka zaměřená na tělo., Atomy v rozích buňky jednotky BCC se navzájem nekontaktují, ale kontaktují atom ve středu. Jednotka BCC buňka obsahuje dva atomy: jedna osmina atomu v každém z osmi rohů (\(8× \ dfrac{1}{8}=1\) atom z rohů) plus jeden atom ze středu. Každý atom v této struktuře se dotýká čtyř atomů ve vrstvě nad ním a čtyř atomů ve vrstvě pod ním. Atom ve struktuře BCC má tedy koordinační číslo osm.,
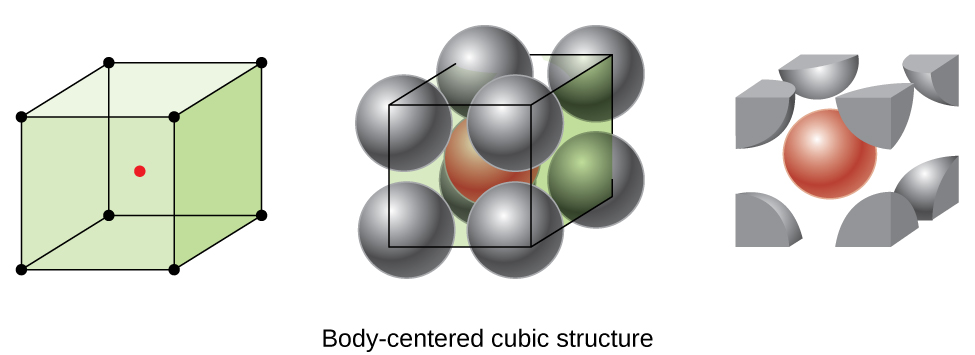
atomy v uspořádání BCC jsou mnohem efektivněji zabaleny než v jednoduché kubické struktuře, zabírající asi 68% celkového objemu. Izomorfní kovy se strukturou BCC zahrnují k, Ba, Cr, Mo, W A Fe při pokojové teplotě., (Prvky nebo sloučeniny, které krystalizují se stejnou strukturou, jsou považovány za izomorfní.)
Mnoho jiných kovů, jako je hliník, měď a olovo, krystalizovat v takovém uspořádání, že má kubickou jednotku buňce s atomů na všech rozích a ve středu každé tváře, jak je znázorněno na Obrázku \(\PageIndex{7}\). Toto uspořádání se nazývá krychlová (FCC) pevná látka zaměřená na obličej., Na jednotku FCC buňka obsahuje čtyři atomy: jednu osminu atom v každém z osmi rohů (\(8×\dfrac{1}{8}=1\) atom z rohů) a jeden-polovina atomu na každé z šesti ploch (\(6×\dfrac{1}{2}=3\) atomy z tváře). Atomy v rozích se dotýkají atomů ve středu sousedních ploch podél úhlopříček obličeje krychle. Protože atomy jsou na stejných mřížkových bodech, mají stejné prostředí.
atomy v uspořádání FCC jsou baleny co nejblíže k sobě, přičemž atomy zabírají 74% objemu., Tato struktura se také nazývá kubické nejbližší balení (CCP). V CCP existují tři opakující se vrstvy šestihranně uspořádaných atomů. Každý atom kontaktuje šest atomů ve své vlastní vrstvě, tři ve vrstvě výše a tři ve vrstvě níže. V tomto uspořádání se každý atom dotýká 12 blízkých sousedů, a proto má koordinační číslo 12. Skutečnost, že uspořádání FCC a CCP jsou ekvivalentní, nemusí být okamžitě zřejmá, ale proč jsou ve skutečnosti stejná struktura, je znázorněna na obrázku \(\PageIndex{8}\).,
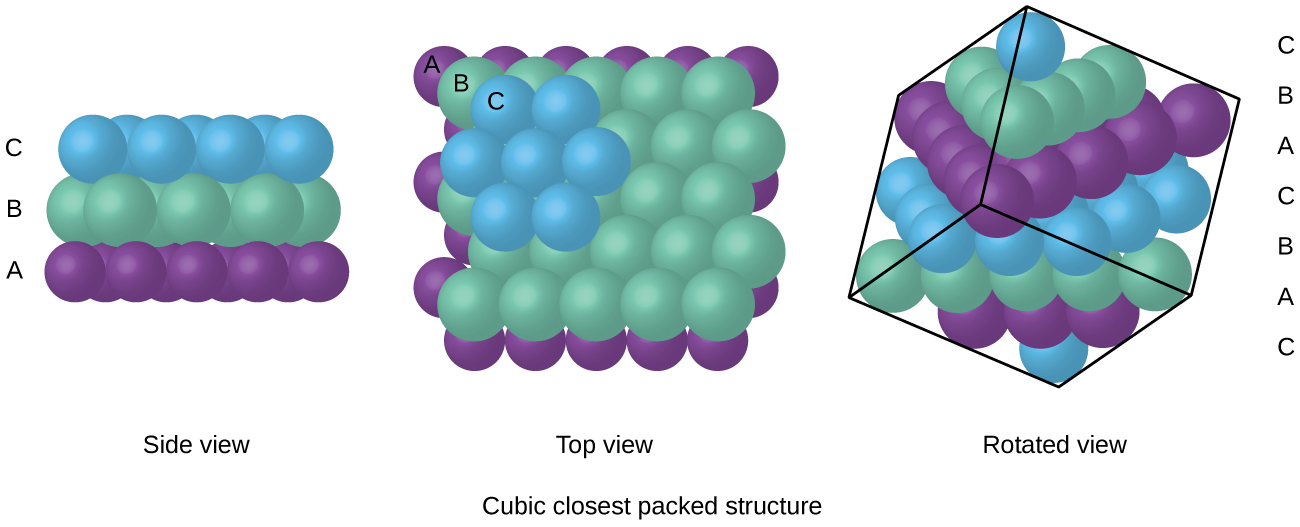
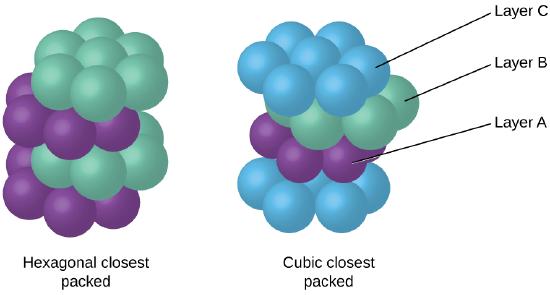
Protože blíže balení maximalizuje celkový zajímavostí, mezi atomy a minimalizuje celkové mezimolekulární energie, atomy ve většině kovů pack tímto způsobem., V jednoduchých kovových krystalických strukturách najdeme dva typy nejbližšího balení: CCP, se kterými jsme se již setkali, a hexagonální nejbližší balení (HCP) znázorněné na obrázku \(\PageIndex{9}\). Oba se skládají z opakujících se vrstev šestihranně uspořádaných atomů. U obou typů je na první vrstvu (a) umístěna druhá vrstva (B), takže každý atom ve druhé vrstvě je v kontaktu se třemi atomy v první vrstvě. Třetí vrstva je umístěna jedním ze dvou způsobů. V HCP jsou atomy ve třetí vrstvě přímo nad atomy v první vrstvě (tj., třetí vrstva je také typ A) a stohování se skládá ze střídavých vrstev typu A a typu B (tj. V OSŘ, atomy v třetí vrstva není nad atomy v jedné z prvních dvou vrstev (tj. třetí vrstva je typu C) a vrstvení se skládá ze střídajících typ A, typ B a typ C close-packed vrstev (tj. ABCABCABC⋯). Asi dvě třetiny všech kovů krystalizují v nejbližších polích s koordinačními čísly 12., Kovy, které krystalizuje v HCP struktuře patří Cd, Co, Li, Mg, Na, Zn, a kovy, které krystalizuje v CCP struktura zahrnují Ag, Al, Ca, Cu, Ni, Pb, Pt.
Cvičení \(\PageIndex{2}\)
Stříbrné krystalizují v FCC struktuře. Délka okraje jeho jednotky je 409 pm.
- jaký je atomový poloměr Ag v této struktuře?
- Vypočítejte hustotu Ag.
Odpovědět
144 pm
Odpověď b
10,5 g/cm3,
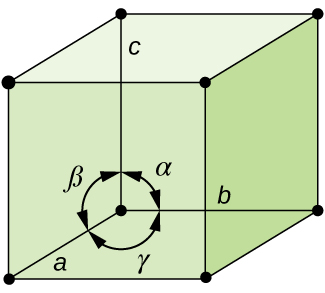
obecně platí, že jednotka buňka je definována délky tři osy (a, b, a, c) a úhly (α, β, a γ) mezi nimi, jak je znázorněno na Obrázku \(\PageIndex{10}\)., Osy jsou definovány jako délky mezi body v mřížce prostoru. V důsledku toho osy jednotek spojují body se stejnými prostředími.
k Dispozici je sedm různých mřížkových systémů, z nichž některé mají více než jeden typ mřížky, pro celkem čtrnáct různých jednotek buněk, které mají tvary zobrazené na Obrázku \(\PageIndex{11}\).