V kombinaci terapie v neonatální hypoxicko-ischemické encefalopatie | Anales de Pediatría (anglické Vydání)
Úvod
S incidencí 1-3 případy na 1000 full-termín narození,1 hypoxicko-ischemická encefalopatie (HIE) je jedním z nejčastějších příčin poškození mozku u novorozenců. Vzhledem k rostoucímu počtu vysoce rizikových porodů v důsledku rostoucích trendů v mateřském věku a četnosti vícečetných těhotenství je HIE i nadále relevantním problémem v nemocničním prostředí, pro které dosud neexistuje definitivní řešení.,
výzkum patofyziologie perinatální asfyxie nám umožnil pochopit složitý proces, který probíhá na úrovni buněk a tkání, protože poškození mozku se vyvíjí kvůli nedostatku kyslíku. Mnoho zúčastněných mechanismů zranění je seskupeno na základě načasování, které uplynulo od jejich vývoje, a byly popsány 4 hlavní fáze (obr. 1): primární fáze nebo akutní epizoda hypoxické ischémie (HI), latentní fáze, sekundární fáze a terciární fáze., V primární fázi poškození pramení ze snížení dodávky kyslíku do buněk a tkání, což vede k selhání primární energie. Následuje zjevné zotavení hladin vysokoenergetických fosforylovaných sloučenin, známých jako latentní fáze., Nicméně, toto zlepšení je jen dočasné a dává cestu k sekundární fázi, kdy se mnoho patofyziologických mechanismů podílejících se na rozvoji poškození mozku u novorozenců přijít do hry, z nichž hlavní jsou excitotoxicity, masivní příliv vápenatých iontů do buněk, oxidační stres, zánět a ve většině případů smrt buněk v důsledku nekrózy nebo apoptózy. Nakonec je terciární fáze charakterizována přetrváváním poškození mozku týdny, měsíce nebo dokonce roky po počáteční hypoxicko-ischemické urážce.,
pochopení hlubších patofyziologie HIE umožnila identifikovat potenciální terapeutické cíle, které by mohly pomoci snížit poškození mozku způsobené dušení a rozvoj mnoha strategií léčby. Některé z těchto způsobů léčby, v současné době v klinických studiích, jsou určeny do práce synergicky s terapeutickou hypotermii, pouze ošetření proti HIE, která byla obecně přijata v novorozenecké intenzivní péče.,
Hypotermie
Podchlazení začal být používán jako neuroprotektivní strategie u kojenců po objevení endogenního chladicí mechanismus, který se projevuje u kojenců, kteří utrpěli nějaké zranění během porodu.2 Jeho neuroprotektivní účinky jsou spojeny především s poklesem metabolické aktivity mozku, o 5% s každým 1°C pokles teploty,3, který reguluje některé škodlivé metabolické dráhy vyvolané asfyxií, které jsou shrnuty v Obr. 2.
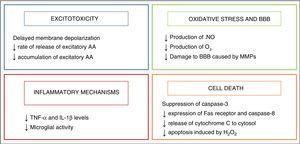
účinek hypotermie na mechanismy poškození mozku.
Kombinovaná terapie
Vzhledem k tomu, důkazy naznačují, že současné podchlazení protokoly jsou optimal4 ještě mají omezenou účinnost v klinické praxi,5 musíme rozšířit, jsou terapeutické armamentarium pro řízení HIE.,6 Nedávný výzkum se zaměřil na vývoj a implementace procedur, které mohou být použity v kombinaci s podchlazení, navržen tak, aby jednat na různých úrovních kaskády patofyziologických a podporovat synergie obou terapií (Obr. 3).

Možné terapeutické cíle a hlavní neuroprotektivní strategie v současné době předmětem studií pro řízení novorozenecké HIE.
Melatonin
Melatonin (N-acetyl-5-metoxitriptamina) je neurohormonální syntetizovaný epifýzou, jehož sekrece následuje den/noc cyklu a jejichž hlavní úloha je v regulaci cirkadiánního rytmu. Klíčové aspekty, které umožňují jeho použití v řízení HIE jsou jeho silné antioxidační a protizánětlivé activity7 a jeho schopnost procházet přes krev–bariéra mozku a dosažení centrální nervový systém.,8
před zkouškou u novorozenců bylo prokázáno, že melatonin zvyšuje úroveň ochrany poskytovanou hypotermie optimalizací metabolismu energie mozku u modelu asfyxie selat.9 v klinickém prostředí, studie publikovaná Aly et al.10 přiděleno polovina asfyxiovaných novorozenců na hypotermii a 5 dávek 10 mg/kg/den melatoninu dodaných orální cestou., Autoři zjistili snížení sérové hladiny superoxid dismutázy a oxidu dusnatého u pacientů léčených kombinovanou terapií v porovnání s těmi, kteří byli léčeni chlazení sám, což prokazuje příznivé účinky kombinace obou strategií proti oxidačnímu stresu.
nedávná studie provedená Balduini et al., vyhodnotit bezpečnost, farmakokinetika, dávkování a účinnost melatoninu používá v kombinaci s podchlazení zjištěno, že chlazení nemá vliv na farmakokinetiku melatonin11 a že je možné, aby se získat vysoké sérové hladiny hormonu podávání dávek, které byly nižší než ty, které se používají v experimentální zvířecí modely. V současné době klinická studie MELPRO (NCT03806816) přijímá pacienty, jejichž cílem je vzorek 100 novorozenců., Tyto a další podobné studie jsou nezbytné pro budoucí vývoj klinických studií fáze III a následné použití melatoninu v každodenní klinické praxi.
Allopurinol
důvodem pro použití alopurinolu v řízení HIE je jeho inhibiční účinek na xantin monoaminooxidázy, enzymu, který se účastní oxidativního stresu. Kromě toho tento lék působí jako chelátor volného železa a sekvestruje hydroxylové radikály.,12,13 A preklinické studie u mláďat potkanů, kde zvířata byla přidělena k 1 5 skupin (kontrolní skupina, HI skupiny, skupiny léčené podchlazení, skupině léčené alopurinolem a skupiny léčené kombinovanou terapií) zjistil, že 72 hodin po HI urážet, kombinace terapeutické skupiny vykazovaly nejnižší infarkt objem.,14
Když přijde na jeho farmakologické vlastnosti, alopurinol může rychle procházet placentou a dosažení terapeutické koncentrace u novorozenců, jak bylo prokázáno ve studii provedené u těhotných žen, které dostávaly 500 mg alopurinolu intravenózně, s důkazy o optimální hladiny allopurinolu 5min později v pupečníková krev vzorky.15 studie provedená van Bel et al., v roce 1998, která analyzovala jeho potenciální antioxidační účinek v udušen novorozenců s těžkou HIE zjistili, že intravenózní podání 40 mg/kg allopurinol dosaženo snížení tvorby volných radikálů.13 nicméně, studie provedená později Benders et al. v roce 2006 nebyly zjištěny rozdíly mezi skupinou léčenou allopurinolem a kontrolní skupinou.16 V závěrech, tito autoři identifikovali extrémní závažnosti HIE u novorozenců zahrnutých do vzorku jako možné vysvětlení pro nedostatek významné rozdíly., Předpokládali také, že období, které uplynulo od podání allopurinolu (3–4h po reperfuzi), mohlo být příliš dlouhé na to, aby bylo dosaženo příznivých výsledků. Ve vztahu k druhému bodu, Gunes et al. podávat stejnou dávku alopurinolu uvedeny v 2 předchozí studie, ale do 2h od narození, a zjistil, zlepšení neurologického výsledky v léčebné skupině.,17 Podél stejných linek, intravenózního podání alopurinolu, aby matky při porodu plodů s hypoxií nebo počínající hypoxie zvýšila účinnost léčby, snížení pupečníkové krve hladiny proteinu S-100β, což je marker poškození mozku.18 klinické studii pod názvem Účinek Alopurinolu pro Hypoxicko-ischemická poškození Mozku, na Neurokognitivní Výsledek (NCT03162653) je v současné době probíhá posouzení potenciální terapeutické účinky podávání tohoto enzymu inhibitor v prvních minutách po narození.,
Erytropoetin
Erytropoetin (EPO) je cytokin, měření 30.4 kDa syntetizovaný v játrech, v plodu života a po narození ledvinami a vývoj mozku, kde působí jako růstový faktor, a neuroprotektivní činidlo.19 použití obou EPO a rekombinantní lidský EPO (rhEPO) v HIE je na základě jeho činnosti, a to prostřednictvím zapojení EPO receptory, které jsou přítomny v neurony a gliemi,20 jako silný antiapoptotic agent (stimuluje transkripci antiapoptotic genů BCL-2 a BCL-XL), a jako protizánětlivé a antioxidační.,19,21 kromě neuroprotektivního účinku může EPO podporovat dlouhodobé opravné procesy, jako je angiogeneze, oligodendrogeneze a neurogeneze.22,23
preklinické studie, které vyhodnotily synergický účinek kombinace podávání EPO nebo rhEPO s hypotermií, přinesly protichůdné výsledky. U podobného krysího modelu hypoxicko-ischemické poškození mozku v den 7 po narození, Fang et al. nebyly zjištěny žádné významné neuroprotektivní účinky jejich kombinovaného použití.24 nicméně, v jiné studii provedené Fan et al.,, 25 autoři pozorovali mírný příznivý účinek na senzorimotorickou funkci u mláďat potkanů, i když se tento rozdíl neodrazil v histologických rysech vzorků mozkové tkáně.studie
u novorozenců s HIE ukázaly, že použití přípravku rhEPO je bezpečné v dávkách 300–2500iu/kg. U pacientů se středně závažným poškozením byly zjištěny nízké dávky přípravku rhEPO účinné a zdá se, že jsou spojeny se sníženým rizikem postižení nebo úmrtí.26 vyšších dávek (až 2500IU/kg) může snížit výskyt záchvatů a neurologických abnormalit po 6 měsících.,27.
Dnes, tři klinické studie fáze III probíhá s plánovaným náborem celkem 840 novorozenců k hodnocení bezpečnosti a účinnosti vysokých dávek EPO (1000IU/kg) v kombinaci s podchlazení (Erytropoetin pro Hypoxicko Ischemické Encefalopatie u Novorozenců, NCT03079167; Vysoké dávky Erytropoetinu pro Dušení a Encefalopatie, NCT02811263; Erytropoetin v Řízení Neonatální Hypoxicko Ischemická Encefalopatie, NCT03163589). Hlavním cílem prvních 2 je snížit 2letou úmrtnost nebo zdravotní postižení, zatímco třetí vyhodnotí tyto dva výsledky po 1 roce., Čekáme na výsledky těchto a dalších studií k určení, zda EPO nebo některý z jeho derivátů jsou účinná a jak by měly být použity v klinické praxi, posouzení faktorů, jako je například minimální účinnou dávku, cestu podání, délku léčby atd.
Kmenové buňky
použití kmenových buněk pro léčbu všech druhů onemocnění, včetně HIE, je oblast výzkumu, která stále roste., Tento terapeutický přístup může pomoci opravit a regenerovat poškozené mozkové tkáně po hypoxicko-ischemické urážet prostřednictvím interakce kmenových buněk s imunitní buňky v orgánech vzdálených od mozku, jako je například slezina, tím se mění imunitní/zánětlivé odpovědi. Podobně funkční zotavení dosaženo s jejich podávání může být částečně vysvětleno tím, že interakce transplantovaných buněk a mozkové tkáni, s následnou produkcí růstových faktorů, jejichž konečný efekt by se odrazilo ve zvýšené neurogeneze a buněčné proliferace.,
i když stále potřebujeme prohloubit naše znalosti, aby mohli používat kmenové buňky jako efektivní terapie, experimentální studie na zvířatech ukázaly, že různé typy kmenových buněk jsou schopny přežít v poškozeném mozku, diferencovat do neuronů nebo glií, integrovat do cílové tkáně a příznivě upravit chování výstupů (přezkoumána v Bennet et al.28)., Nedávné studie prokázaly, že podání mezenchymálních kmenových buněk v kombinaci s 24h chlazení u mláďat potkanů 7 dnů po narození dosáhla lepších výsledků ve srovnání se buď léčba v izolaci,29 a mají také zjištěno, že podchlazení rozšiřuje terapeutické časové okno pro podání mezenchymálních kmenových buněk až 2 dny po hypoxicko-ischemickou příhodu.,30 kromě toho, že kmenové buňky mohou regulovat imunitní reakci prostřednictvím jejich interakce s efektorové imunitní buňky se nacházejí v orgánech vzdálených od mozku, jako je například slezina, jejichž mobilizace je známo, mají potenciál ke zhoršení zánětlivé reakce a ischemické poškození nezralého mozku, čímž se zvýší jejich neuroprotektivní účinek.,31,32
terapie Kmenových buněk, a to samostatně nebo v kombinaci s terapeutickou hypotermii, je slibné oblasti výzkumu, které stále vyžaduje klinické studie k určení, mimo jiné aspekty, nejúčinnější typ kmenových buněk a optimální dávkování a trvání léčby, jak získat nejlepší možné výsledky léčby.,28 Jedním z projektů, který probíhá v náboru fáze (Studie hCT-MSC u Novorozenců Se Středně těžkou nebo Těžkou HIE, NCT03635450) bude obsahovat 6 dětí narozených v gestačním věku 36 a více týdnů s středně závažné až závažné HIE být zacházeno s podchlazení a 2 intravenózní dávky mezenchymální stromální buňky získané z pupečníkové tkáně (hCT-MSC). Hlavním cílem této studie fáze I je posoudit bezpečnost hCT-MSC a analyzovat výsledky přežití a neurodevelopmentu u účastníků po 6 a 16 měsících., Další studie fáze I (NCT00593242) získány slibné výsledky s autologní transplantací krevních buněk z pupeční šňůry, s 74% novorozenců, který obdržel kmenových buněk přežití se skóre 85 nebo vyšší v Bayley scales ve srovnání s 41% novorozenců léčených s chlazením sám.33
N-acetylcystein
N-acetylcysteinu (NAC) je prekurzorem cysteinu, že uklízí volné radikály a podílí glutathion údržba,34 tedy regulaci oxidačního stresu., Důkazy ze zvířecích modelech vykazovaly větší snížení cerebrální infarkt objem u zvířat léčených kombinací NAC a podchlazení ve srovnání se zvířaty zacházeno pouze s jedním z těchto zásahů. Kromě toho zvířata léčená kombinovanou terapií vykazovala podobné výsledky v reflexích a poškození bílé hmoty u zvířat nalezených v kontrolní skupině.35 protože jeho podávání během těhotenství nemá teratogenní účinky a může procházet placentou,36 NAC se považuje za jeden z nejslibnějších terapeutických činidel pro budoucí použití v jednotkách novorozenecké intenzivní péče., Nicméně, naše znalosti žádné klinické studie byly navrženy tak, aby datum posoudit jeho použití v řízení HIE, a dostupné důkazy jsou pouze studie týkající se intra-plodová zánět, chorioamnionitis, nebo syndrom respirační tísně.
vzácné plyny
vzácné plyny jako xenon a radon vykazovaly neuroprotektivní účinky u zvířecích modelů novorozeneckého HI. Četné studie analyzovaly možnost použití xenonu jako terapeutického činidla (pro přezkoumání důkazů viz článek Lobo et al.,37) vzhledem ke své schopnosti snižovat excitotoxicitu po HI-fi přes modulaci NMDA glutamátových receptorů.38,39
multicentrické klinické hodnocení Celkové Tělesné podchlazení plus Xenon (TOBY-Xe) používá xenon plynu v kombinaci s podchlazení ve vzorku 92 dětí narozených mezi 36 a 43.týdnu gestace., I když to nenašli významné rozdíly mezi skupinami,40 s cílem získat podrobnější informace o některé z proměnných, které mohou mít vliv na výsledky léčby tohoto vzácného plynu, jako jeho dávkování nebo trvání, fáze II klinické hodnocení probíhá (CoolXenon3 Studie, NCT02071394).,
Na druhé straně, tam byly žádné klinické studie argonu k dnešnímu dni, ale argon je prokázáno, že zvýšení výsledky chlazení z hlediska úrovně N-acetyl-aspartátu/laktát značku, která byla spojena s zvyšuje v průměru buněčné smrti hodnot a rozvoje neurologických následků v postižených novorozenců.41 Tyto slibné výsledky, spolu s jeho vyšší biologická dostupnost a nižší náklady v porovnání s xenon, aby argon molekula s vysokým potenciálem pro lavice noční překladu v léčbě HIE.,
závěry
dosažení účinné léčby HIE je jednou z velkých výzev, kterým čelí moderní medicína. Z tohoto důvodu, značné úsilí byly provedeny pro roky analyzovat mechanismy vedoucí k poškození mozkových buněk po perinatální asfyxie s cílem rozvíjet účinné léčby, aby je zablokovat. V současné době se pediatři a neurovědci pokoušejí vyvinout nové sloučeniny, které by mohly pracovat v synergii s hypotermií s cílem snížit na minimum neurologické následky HIE., Na druhou stranu, nedávné studie začaly patří sex mezi proměnnými vzít v úvahu v řízení HIE, jako sexuální dimorfní rozdíly byly nalezeny jak v mechanismech poranění (v experimentálních modelech, samice vykazovaly větší paměťové deficity, zatímco samci mají ukázala větší náchylnost k oxidativní stres), a v obvodech různých ošetření v úvahu., I přes slibný pokrok s použitím melatoninu nebo sloučeniny, jako je EPO, preklinických studií jsou stále zapotřebí další objasnění mechanismů působení těchto molekul, a klinické studie s většími vzorky jsou potřebné k určení optimální dávky a cesty podání tyto a další procedury.
financování
studie byla podpořena grantem poskytnutým UPV / EHU v rámci programu financování výzkumné skupiny univerzity (GIU 17/018).
Střet zájmů
autoři nemají žádné střety zájmu.