10.6: Gitter Krystallinske Strukturer i Faste stoffer
Enhed Celler af Metaller
opbygning af en krystallinsk fast stof, hvorvidt en metal eller ej, er bedst beskrevet ved at overveje sin enkleste at gentage enhed, som er nævnt som sin celle. Enhedscellen består af gitterpunkter, der repræsenterer placeringen af atomer eller ioner. Hele strukturen består derefter af denne enhedscelle, der gentages i tre dimensioner, som illustreret i figur \(\Pageinde. {1}\).,
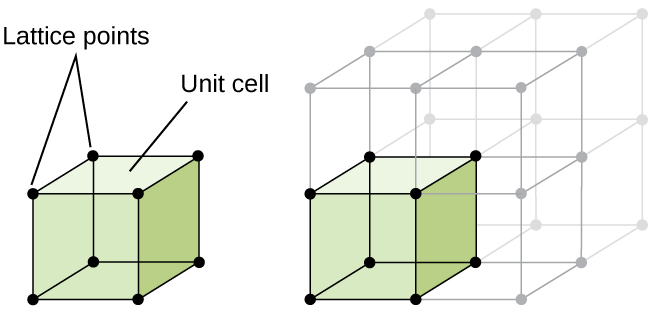
Lad os begynde vores undersøgelse af krystalgitter struktur og enhed celler med de mest enkle struktur og mest grundlæggende enhed celle. For at visualisere dette, forestil dig at tage et stort antal identiske kugler, såsom tennisbolde, og arrangere dem ensartet i en beholder., Den enkleste måde at gøre dette på ville være at lave lag, hvor kuglerne i et lag er direkte over dem i laget nedenfor, som illustreret i figur \(\Pageinde. {2}\). Dette arrangement kaldes simpel kubisk struktur, og enhedscellen kaldes den enkle kubiske enhedscelle eller primitive kubiske enhedscelle.
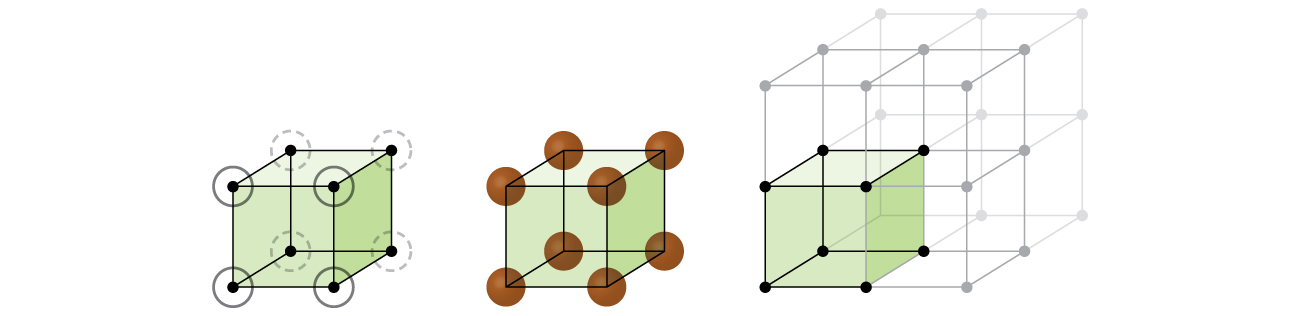
i en simpel kubisk struktur pakkes kuglerne ikke så tæt som de kunne være, og de “fylder” kun omkring 52% af beholderens volumen. Dette er et relativt ineffektivt arrangement, og kun et metal (polonium, Po) krystalliserer i en simpel kubisk struktur. Som vist i Figur \(\PageIndex{3}\), et solidt med denne type arrangement består af fly (eller lag), hvor hvert atom kontakter kun de fire nærmeste naboer i sit lag; et atom direkte over det i lag over; og en atom direkte under den i lag nedenfor., Antallet af andre partikler, som hver partikel i en krystallinsk fast kontakt er kendt som dens koordinationsnummer. For et poloniumatom i et simpelt kubisk array er koordinationsnummeret derfor seks.

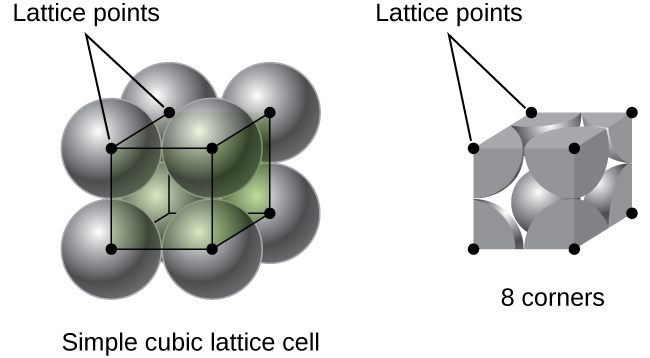
i et simpelt kubisk gitter er enhedscellen, der gentages i alle retninger, en terning defineret af centrene af otte atomer, som vist i figur \(\Pageinde. {4}\). Atomer i tilstødende hjørner af denne enhedscelle kontakter hinanden, så kanten af denne celle er lig med to atomradier eller en atomdiameter. En kubisk enhedscelle indeholder kun de dele af disse atomer, der er inde i den. Da et atom i et hjørne af en simpel kubisk enhedscelle er indeholdt af i alt otte enhedsceller, er kun en ottendedel af det atom inden for en bestemt enhedscelle., Og da hver simpel kubisk enhedscelle har et atom i hver af sine otte “hjørner”, er der \(8\ \ dfrac{1}{8}=1\) atom inden for en simpel kubisk enhed celle.
de fleste metalkrystaller er en af de fire hovedtyper af enhedsceller., For nu, vil vi fokusere på tre kubikmeter enhed celler: simpel kubisk (som vi allerede har set), krop-centreret cubic celle, og ansigt-centreret cubic celle—som alle er illustreret i Figur \(\PageIndex{5}\). (Bemærk, at der faktisk er syv forskellige gittersystemer, hvoraf nogle har mere end en type gitter, for i alt 14 forskellige typer enhedsceller. Vi forlader de mere komplicerede geometrier til senere i dette modul.,)
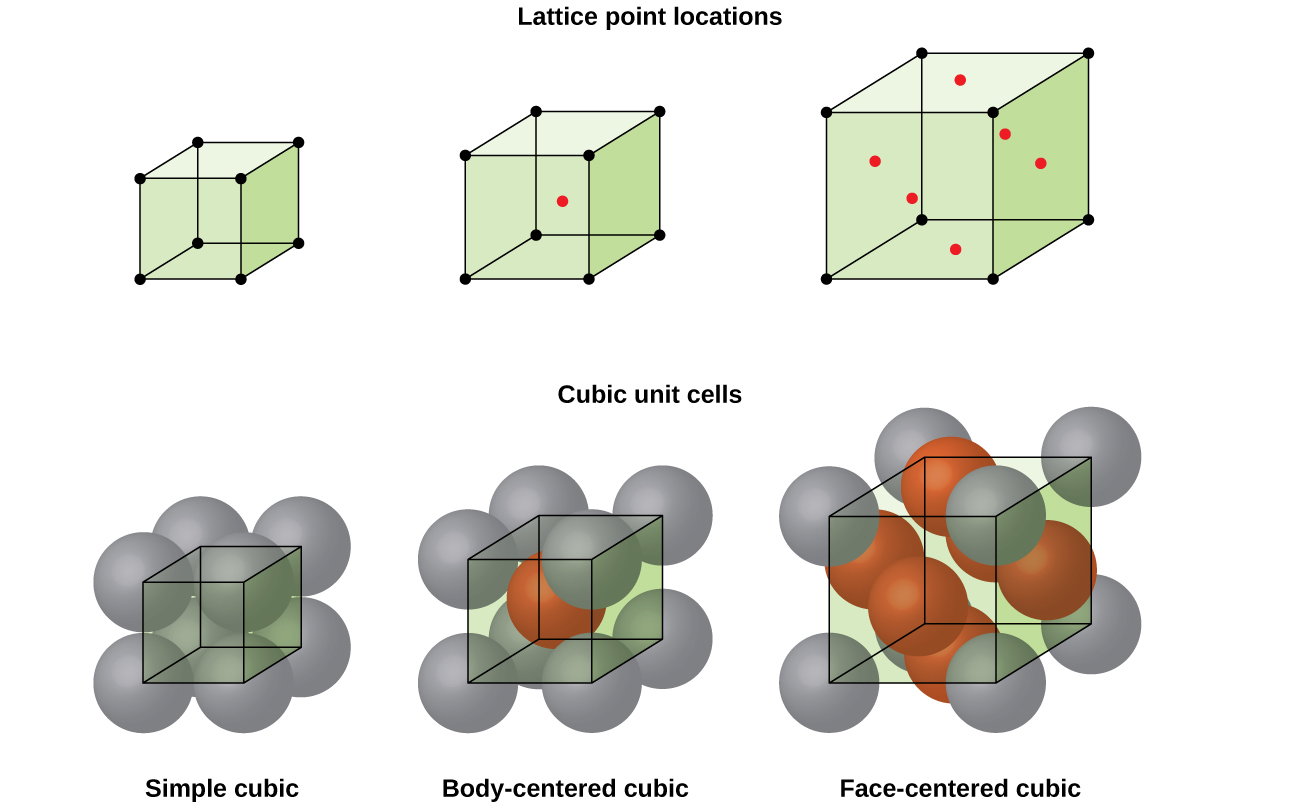
Nogle metaller krystallisere i en ordning, som har en kubiske celler med atomer i alle hjørner og et atom i midten, som vist i Figur \(\PageIndex{6}\). Dette kaldes et kropscentreret kubisk (BCC) fast stof., Atomer i hjørnerne af en BCC-enhedscelle kontakter ikke hinanden, men kontakter atomet i midten. En BCC celle indeholder to atomer: en ottendedel af et atom i hver af de otte hjørner (\(8×\dfrac{1}{8}=1\) atom fra hjørnerne) plus et atom fra centrum. Ethvert atom i denne struktur berører fire atomer i laget over det og fire atomer i laget under det. Således har et atom i en BCC-struktur et koordinationsnummer på otte.,
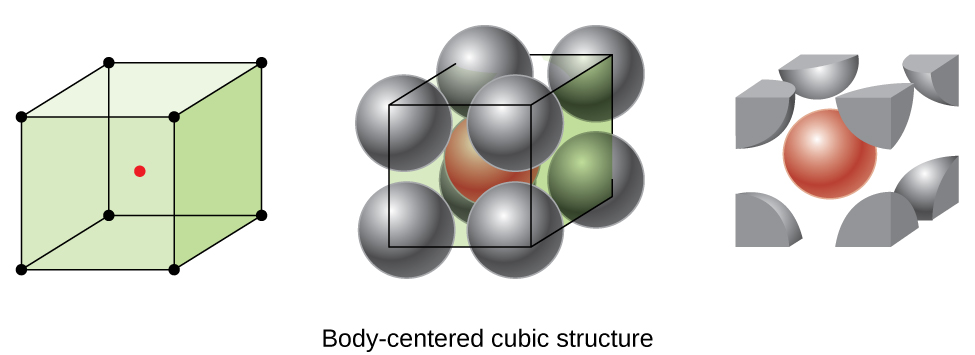
Atomer i BCC-arrangementer er meget mere effektivt pakket end i en simpel kubisk struktur, besætter omkring 68% af den samlede volumen. Isomorfe metaller med en BCC-struktur inkluderer k, Ba, Cr, Mo,, og Fe ved stuetemperatur., (Elementer eller forbindelser, der krystalliserer med den samme struktur, siges at være isomorfe.)
Mange andre metaller, såsom aluminium, kobber og bly, krystalliserer i en ordning, som har en kubiske celler med atomer i alle hjørner og på centrene af hvert ansigt, som illustreret i Figur \(\PageIndex{7}\). Dette arrangement kaldes et ansigt-centreret kubisk (FCC) faststof., En FCC-celle indeholder fire atomer: en ottendedel af et atom i hver af de otte hjørner (\(8×\dfrac{1}{8}=1\) atom fra hjørnerne), og den ene halvdel af et atom på hver af de seks ansigter (\(6×\dfrac{1}{2}=3\) atomer fra de ansigter). Atomerne i hjørnerne berører atomerne i centrene af de tilstødende ansigter langs kubens ansigtsdiagonaler. Fordi atomerne er på identiske gitterpunkter, har de identiske miljøer.
atomer i et FCC-arrangement pakkes så tæt sammen som muligt, med atomer, der optager 74% af volumenet., Denne struktur kaldes også kubisk nærmeste pakning (CCP). I CCP er der tre gentagne lag af sekskantet arrangerede atomer. Hvert atom kontakter seks atomer i sit eget lag, tre i laget ovenfor og tre i laget nedenfor. I dette arrangement berører hvert atom 12 nær naboer og har derfor et koordinationsnummer på 12. Det faktum, at FCC-og CCP-arrangementer er ækvivalente, er måske ikke umiddelbart indlysende, men hvorfor de faktisk er den samme struktur er illustreret i figur \(\Pageinde. {8}\).,
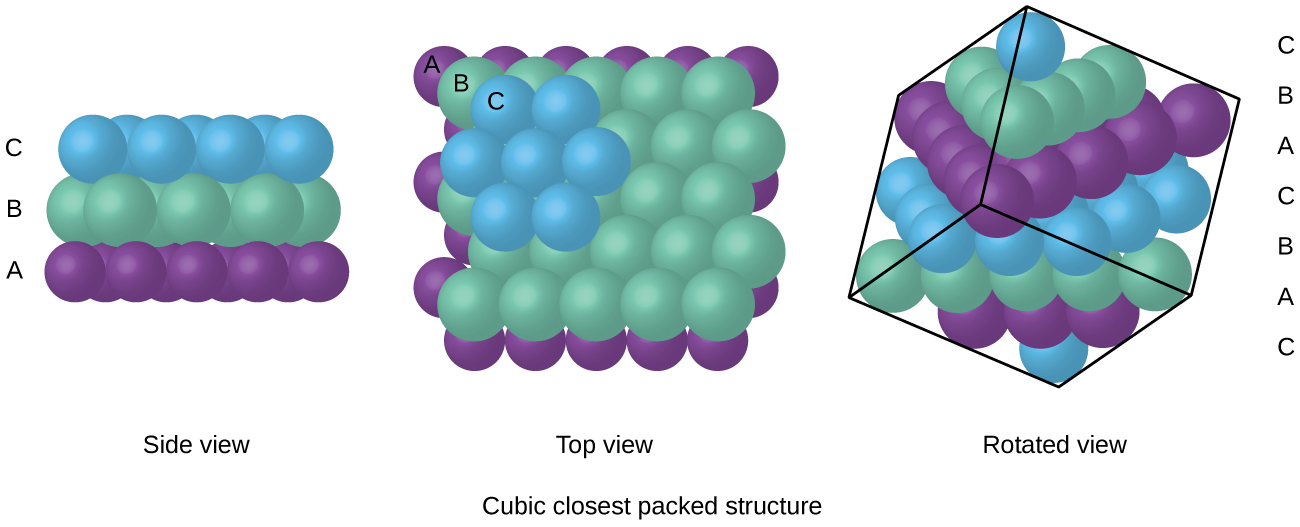
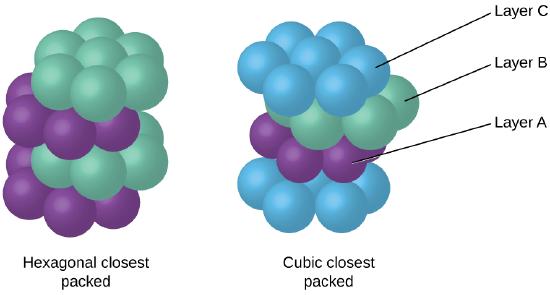
Fordi tættere pakning maksimerer den samlede attraktioner mellem atomer og minimerer den samlede intermolekylære energi, de atomer, der i de fleste metaller pack på denne måde., Vi finder to typer nærmeste pakning i enkle metalliske krystallinske strukturer: CCP, som vi allerede har stødt på, og sekskantet nærmeste pakning (HCP) vist i figur \(\Pageinde. {9}\). Begge består af gentagne lag af sekskantet arrangerede atomer. I begge typer placeres et andet lag (B) på det første lag (A), så hvert atom i det andet lag er i kontakt med tre atomer i det første lag. Det tredje lag er placeret på en af to måder. I HCP er atomer i det tredje lag direkte over atomer i det første lag (dvs .,, det tredje lag er også type A), og stablingen består af skiftevis type A og type B tætpakkede lag (dvs.ABABAB⋯). I CCP, atomer i det tredje lag er ikke over atomer i en af de to første lag (dvs, det tredje lag er af type C), og stabling består af skiftende type A, type B og type C tæt pakket lag (dvs, ABCABCABC⋯). Cirka to tredjedele af alle metaller krystalliserer i nærmeste pakkede arrays med koordinationstal på 12., Metaller, der krystalliserer i en HCP struktur omfatter Cd, Co, Li, Mg, Na, og Zn, og i metaller, der krystalliserer i en CCP struktur omfatter Ag, Al, Ca, Cu, Ni, Pb, og Pt.
øvelse \(\Pageinde. {2}\)
Sølv krystalliserer i en FCC-struktur. Kantlængden af dens enhedscelle er 409 pm.
- hvad er AG ‘ s atomradius i denne struktur?
- Beregn tætheden af Ag.
Besvar et
144 pm
Svar b
10,5 g/cm3
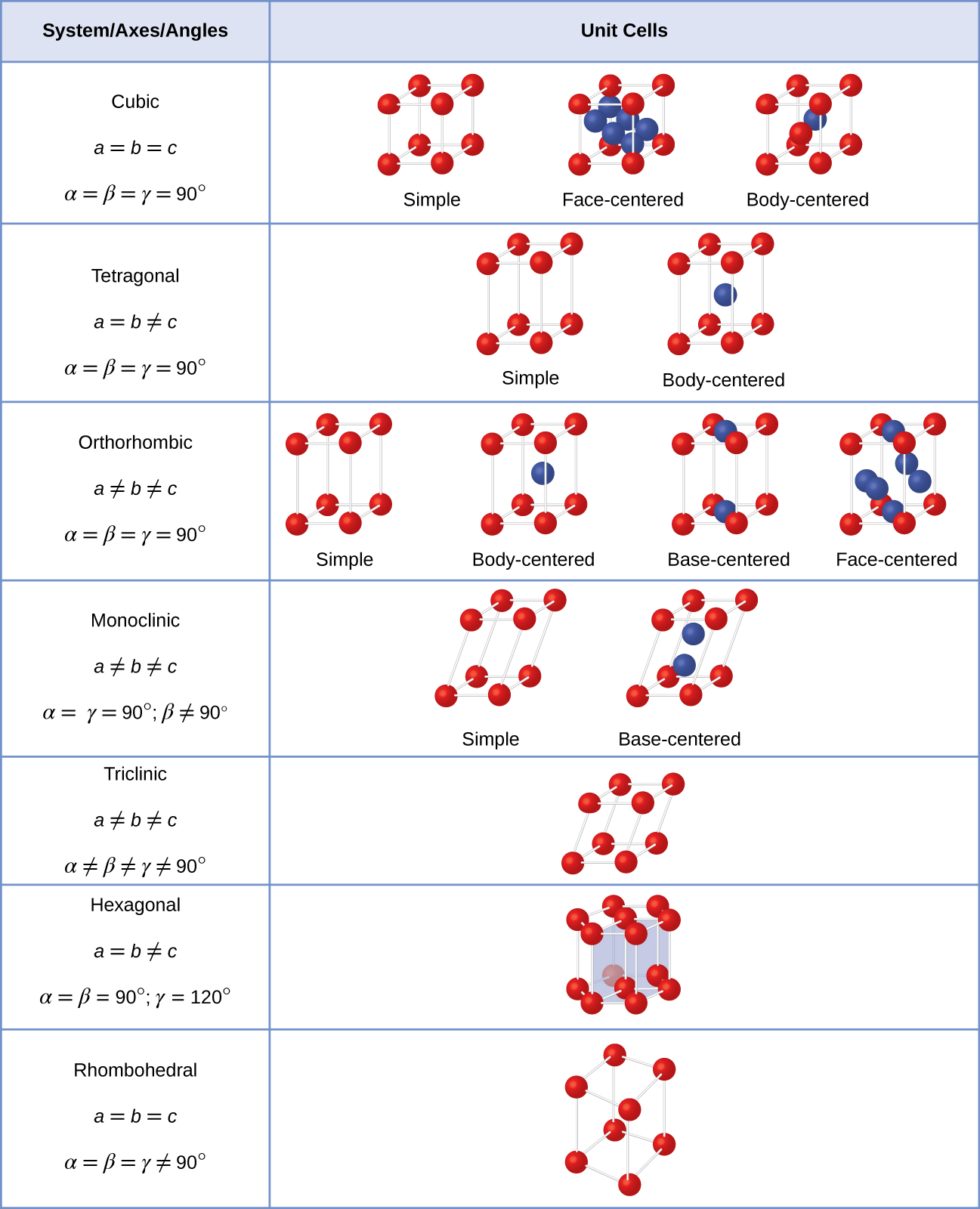
I almindelighed, en celle er defineret ved længden af tre akser (a, b, og c) og vinkler (α, β og γ) mellem dem, som illustreret i Figur \(\PageIndex{10}\)., Akserne er defineret som værende længderne mellem punkter i rummet gitter. Derfor forbinder enhedscelleakser punkter med identiske miljøer.
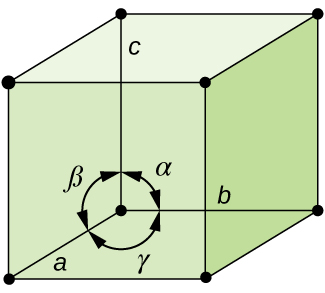
Der er syv forskellige lattice-systemer, hvoraf nogle har mere end én type gitter, for i alt fjorten forskellige enhed celler, som er de figurer, der er vist i Figur \(\PageIndex{11}\).