Kombineret behandling på neonatal hypoxisk-iskæmisk encefalopati | Anales de Pediatría (engelsk Udgave)
Indledning
Med en forekomst på 1-3 tilfælde per 1000 fuld-sigt fødsler,1 hypoxisk-iskæmisk encefalopati (HIE) er en af de hyppigste årsager til hjerneskader hos nyfødte. Under hensyntagen til den voksende række af høj-risiko-fødsler på grund af de stigende tendenser i moderens alder og hyppigheden af flerfoldsgraviditeter, blandt andre faktorer, HIE fortsætter med at være et relevant problem på det hospital, for hvilke der endnu ikke foreligger nogen endelig løsning.,
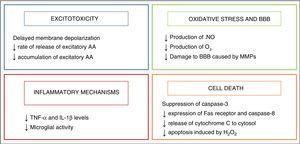
Forskning i patofysiologi af perinatal asfyksi har tilladt os at forstå den komplekse proces, der finder sted på det cellulære og væv niveauer som hjerne skader udvikler sig på grund af mangel på ilt. Mange af de involverede skademekanismer er grupperet ud fra timingen, der er gået til deres udvikling, og 4 hovedfaser er beskrevet (fig. 1): primær fase eller akut episode af hypoicisk iskæmi (HI), latent fase, sekundær fase og tertiær fase., I den primære fase skyldes skader en reduktion i tilførslen af ilt til celler og væv, hvilket resulterer i primær energifejl. Dette efterfølges af en tilsyneladende genopretning i niveauerne af højenergi-phosphorylerede forbindelser, kendt som den latente fase., Men denne forbedring er kun midlertidig, og giver plads til den sekundære fase, hvor mange af de patofysiologiske mekanismer, der er involveret i udviklingen af hjerne-skader i nyfødte kommer i spil, chef for der er excitotoxicity en massiv indstrømning af calcium-ioner i cellerne, oxidativt stress, inflammation og i de fleste tilfælde, celledød på grund af nekrose eller apoptose. Endelig er den tertiære fase karakteriseret ved vedvarende hjerneskade uger, måneder eller endda år efter den første hypo ischaemicisk iskæmiske fornærmelse.,forståelsen af den underliggende patofysiologi af HIE har muliggjort identifikation af potentielle terapeutiske mål, der kan hjælpe med at reducere hjerneskade forårsaget af asfyksi og udviklingen af adskillige behandlingsstrategier. Nogle af disse behandlinger, der i øjeblikket er i forsøg, er beregnet til at arbejde synergistisk med terapeutisk hypotermi, den eneste behandling mod HIE, der generelt er blevet vedtaget i neonatal intensivpleje.,
hypotermi
hypotermi begyndte at blive brugt som en neuroprotektiv strategi hos spædbørn efter opdagelsen af en endogen kølemekanisme, der manifesterede sig hos spædbørn, der havde lidt en form for skade under fødslen.2 Dens neuroprotektive virkninger er hovedsageligt relateret til faldet i hjernens metaboliske aktivitet på 5% med hvert 1 C C fald i temperatur, 3 som modulerer nogle af de skadelige metaboliske veje udløst af asfyxiai,som er opsummeret i fig. 2.
effekt af hypotermi på hjerneskademekanismer.
kombinationsbehandling
Da det tyder på, at nuværende hypotermi protokoller er optimal4 endnu er begrænset effektivitet i klinisk praksis,5 vi nødt til at udvide, er terapeutisk udrustning til håndtering af HIE.,6 Seneste forskning har fokuseret på udvikling og implementering af behandlinger, der kan anvendes i kombination med hypotermi, der er designet til at fungere på forskellige niveauer af pathophysiologic cascade og for at fremme synergi for begge behandlingsformer (Fig. 3).

mulige terapeutiske mål og vigtigste neuroprotektive strategier, der i øjeblikket er underlagt forsøg til håndtering af neonatal HIE.
Melatonin
Melatonin (N-acetyl-5-metoxitriptamina) er en neurohormone syntetiseret af pinealkirtlen, hvis sekretion følger en nat/dag cyklus, og hvis vigtigste rolle er at regulere døgnrytme. De vigtigste aspekter, der tillader dets anvendelse i forvaltningen af HIE, er dens kraftfulde antio .idant og antiinflammatorisk aktivitet7 og dens evne til at krydse blod-hjerne–barrieren og nå centralnervesystemet.,8
før det forsøges hos nyfødte, har melatonin vist sig at øge beskyttelsesniveauet ved hypotermi gennem optimering af hjernens energimetabolisme i en pigletmodel af asfyksi.9 i den kliniske indstilling, en undersøgelse udgivet af Aly et al.10 tildelte halvdelen af kvælede nyfødte til hypotermi og 5 doser på 10 mg/kg / dag melatonin leveret ved oral vej., Forfatterne fandt en reduktion i serumniveauerne af supero .iddismutase og nitrogeno .id hos de patienter, der blev behandlet med kombinationsbehandling sammenlignet med dem, der blev behandlet med køling alene, hvilket demonstrerer de gavnlige virkninger af kombinationen af begge strategier mod o .idativ stress.
en nylig undersøgelse foretaget af Balduini et al., for at evaluere sikkerheden, farmakokinetikken, doseringen og effektiviteten af melatonin anvendt i kombination med hypotermi viste, at afkøling ikke påvirkede melatonin11s farmakokinetik, og at det var muligt at opnå høje serumniveauer af hormonadministrationsdoser, der var lavere sammenlignet med dem, der blev anvendt i forsøgsdyremodeller. På nuværende tidspunkt rekrutterer det kliniske forsøg MELPRO (NCT03806816) patienter med henblik på en prøve på 100 nyfødte., Denne og andre lignende undersøgelser er uundværlige for den fremtidige udvikling af fase III kliniske forsøg og den efterfølgende anvendelse af melatonin i daglig klinisk praksis.
Allopurinol
begrundelsen for brugen af allopurinol til håndtering af HIE er dens hæmmende virkning på Allanthino .idase, et en .ym involveret i O .idativ stress. Desuden virker dette lægemiddel som en frijernschelator og sekvestrer hydro .ylradikaler.,12,13 en præklinisk undersøgelse med rotteunger, hvor dyrene blev allokeret til 1 af 5 grupper (kontrolgruppe, HI-gruppe, gruppe behandlet med hypotermi, gruppe behandlet med allopurinol og gruppe behandlet med kombinationsbehandling) fandt, at 72 timer efter HI-fornærmelsen udviste kombinationsterapigruppen det laveste infarktvolumen.,14
Når det kommer til dens farmakologiske egenskaber, allopurinol hurtigt kan krydse moderkagen og opnå terapeutiske koncentrationer i nyfødte, som påvist i en undersøgelse foretaget på gravide kvinder, der fik 500 mg allopurinol intravenøst, med dokumentation for optimale niveauer af allopurinol 5min senere i navlestrengsblod prøver.15 en undersøgelse udført af van Bel et al., i 1998 at få analyseret sit potentiale antioxidant virkning, kvalt nyfødte med svær HIE fandt, at intravenøs administration af 40mg/kg allopurinol opnået en reduktion i dannelsen af frie radikaler.13 Dog en undersøgelse foretaget senere af benders et al. i 2006 fandt man ikke forskelle mellem gruppen behandlet med allopurinol og kontrolgruppen.16 i konklusionerne identificerede disse forfattere den ekstreme sværhedsgrad af HIE hos de nyfødte, der var inkluderet i prøven, som en mulig forklaring på manglen på væsentlige forskelle., De antog også, at perioden, der gik til indgivelse af allopurinol (3–4h efter reperfusion), kunne have været for lang til at opnå gunstige resultater. I forhold til sidstnævnte punkt, Gunes et al. administreret den samme dosis allopurinol givet i de 2 tidligere undersøgelser, men inden for 2 timer fra fødslen, og fandt forbedringer i neuroudviklingsresultater i behandlingsgruppen.,17 Langs de samme linjer, administration af intravenøs allopurinol at mødre under levering af fostre med hypoxi eller begyndende iltsvind øget effektivitet af behandling, reduktion af ledningen blod niveauer af protein S-100β, som er en markør for skader på hjernen.18 Et klinisk forsøg under navn af Effekten af Allopurinol for Hypoxisk-iskæmisk hjerneskade på Neurokognitive Resultatet (NCT03162653) er i øjeblikket i gang med at vurdere den potentielle terapeutiske virkninger af administrationen af dette enzym hæmmer i de første minutter post fødsel.,
Erythropoietin
Erythropoietin (EPO) er et cytokin måling 30.4 kDa syntetiseret i leveren i føtal livet og efter fødslen af nyre og udvikle hjernen, hvor det virker som en vækstfaktor og neuroprotektive agent.19 brug af både EPO og rekombinant humant EPO (rhEPO) i HIE er baseret på dens aktivitet, gennem inddragelse af EPO receptorer til stede i neuroner og glia,20 de er som en potent antiapoptotic agent (stimulerer transskription af antiapoptotic gener, BCL-2 og BCL-XL), og som en anti-inflammatorisk og antioxidant.,19,21 ud over dets neuroprotektive virkning kan EPO fremme langsigtede reparationsprocesser, såsom angiogenese, oligodendrogenese og neurogenese.22,23
prækliniske undersøgelser, der har vurderet den synergiske virkning af at kombinere administration af EPO eller rhEPO med hypotermi, har givet modstridende resultater. I en lignende rottemodel for hypo ischaemicisk iskæmisk hjerneskade på dag 7 efter fødslen, Fang et al. fandt ingen signifikante neuroprotektive virkninger af deres kombinerede anvendelse.24 Men i en anden undersøgelse foretaget af Fan et al.,, 25 observerede forfatterne en mild gavnlig effekt på sensorimotorisk funktion hos rottepupperne, skønt denne forskel ikke afspejles i de histologiske træk ved hjernevævsprøver.
undersøgelser hos nyfødte med HIE har vist, at brugen af rhEPO er sikker i doser på 300–2500IU / kg. Lave doser af rhEPO er fundet effektive hos patienter med moderat skade og synes at være forbundet med en nedsat risiko for handicap eller død.26 højere doser (på op til 2500IU/kg) kan reducere forekomsten af anfald og neurologiske abnormiteter ved 6 måneder.,27
i Dag, tre fase III kliniske forsøg i gang med et planlagt rekruttering af i alt 840 nyfødte til at vurdere sikkerheden og effekten af høje doser af EPO (1000IU/kg) kombineret med hypotermi (Erythropoietin for Hypoxisk Iskæmisk Encephalopati hos Nyfødte, NCT03079167; Høj-dosis Epo for Kvælning og Encephalopati, NCT02811263; Erythropoietin i Forvaltningen af Neonatal Hypoxisk Iskæmisk Encephalopati, NCT03163589). Hovedmålet med de første 2 er at reducere 2-års dødelighed eller handicap, mens den tredje vurderer disse to resultater efter 1 år., Vi afventer resultaterne af disse og andre undersøgelser for at fastslå, om EPO eller nogen af dets derivater, der er effektive, og hvordan de skal bruges i den kliniske praksis, vurdering af faktorer som den mindste effektive dosis, administrationsvej, varigheden af behandlingen, osv.
stamceller
anvendelsen af stamceller til behandling af alle mulige sygdomme, herunder HIE, er et forskningsområde, der fortsætter med at vokse., Denne terapeutiske metode kan hjælpe med at reparere og regenerere beskadiget hjernevæv efter den hypo ischaemicisk iskæmiske fornærmelse gennem interaktion mellem stamceller og immunceller i organer, der er fjernt fra hjernen, såsom milten, og således ændre immun/inflammatorisk respons. Tilsvarende kan den funktionelle bedring opnået med deres indgivelse delvis forklares ved interaktionen mellem de transplanterede celler og hjernevæv med den deraf følgende produktion af vækstfaktorer, hvis endelige virkning afspejles i øget neurogenese og cellulær proliferation.,
selvom vi stadig er nødt til at uddybe vores viden for at kunne bruge stamceller som en effektiv terapi, har eksperimentelle undersøgelser hos dyr vist, at forskellige typer stamceller er i stand til at overleve i den beskadigede hjerne, differentiere til neuroner eller glia, integrere i målvævet og positivt ændre adfærdsmæssige resultater (gennemgået i Bennet et al.28)., De seneste undersøgelser har rapporteret, at administrationen af mesenchymal stem cells kombineret med 24h af køling i rotte unger 7 dage efter fødslen opnået bedre resultater i forhold til enten behandling i isolation,29 og har også fundet, at hypotermi udvider den terapeutiske time-vinduet for administration af mesenchymal stem cells til op til 2 dage efter hypoxisk-iskæmiske tilfælde.,30 hertil kommer, at stamceller kan regulere immunforsvaret gennem deres interaktioner med effektor immun-celler i organer væk fra hjernen, som milten, hvis tilvejebringelse er kendt for at have potentiale til at forværre den inflammatoriske respons og iskæmisk skade i den umodne hjerne, og dermed styrke deres neurobeskyttende effekt.,31,32
stamcelleterapi, alene eller i kombination med terapeutisk hypotermi, er et lovende forskningsområde, som stadig kræver kliniske forsøg for at bestemme, blandt andre aspekter, og den mest effektive type af stamceller, og den optimale dosis og varighed af behandlingen for at opnå det bedst mulige behandling resultater.,28 Et af de projekter, der i øjeblikket er i gang i rekruttering fase (Undersøgelse af hCT-MSC i Nyfødte børn Med Moderat eller Svær HIE, NCT03635450) vil omfatte 6 spædbørn, der er født ved en gestationsalder alder af 36 eller flere uger med moderat-til-svær HIE til at blive behandlet med hypotermi og 2 intravenøse doser af mesenchymal stromale celler fra navlestrengen væv (hCT-MSC). Hovedmålene med dette fase i-forsøg er at vurdere sikkerheden ved HCT-MSC og analysere overlevelsesresultater og neuroudviklingsresultater hos deltagere efter henholdsvis 6 og 16 måneder., Et andet fase i-forsøg (NCT00593242) opnåede lovende resultater med den autologe transplantation af navlestrengsblodceller, hvor 74% af de nyfødte, der modtog stamceller, overlevede med score på 85 eller højere i Bayley-skalaerne sammenlignet med 41% af de nyfødte, der blev behandlet med afkøling alene.33
N-acetylcystein
N-acetylcystein (NAC) er en forløber for cystein, der indfanger frie radikaler og glutathion, der er involveret i vedligeholdelse,34 regulering af oxidativt stress., Beviser fra dyremodeller viste en større reduktion i cerebral infarktvolumen hos dyr behandlet med en kombination af NAC og hypotermi sammenlignet med dyr behandlet med kun et af disse indgreb. Desuden viste dyr, der blev behandlet med kombinationsbehandling, lignende resultater i reflekser og hvide stofskader på dem, der blev fundet i kontrolgruppen.35 da dets administration under graviditet ikke har teratogene virkninger,og det kan krydse placenta, er 36 NAC blevet betragtet som et af de mest lovende terapeutiske midler til fremtidig brug i neonatale intensivafdelinger., Så vidt vi ved, er der indtil videre ikke designet kliniske forsøg til at vurdere dets anvendelse til håndtering af HIE, og de tilgængelige beviser er begrænset til forsøg relateret til intra-fostervandsinflammation, chorioamnionitis eller respiratorisk nødsyndrom.
ædelgasser
ædelgasser som xenenon og radon har udvist neuroprotektive effekter i dyremodeller af neonatal HI. Talrige undersøgelser har analyseret muligheden for at anvende .enon som terapeutisk middel (for en gennemgang af beviset, se artiklen af Lobo et al.,37) på grund af dets evne til at reducere e .citotoksicitet efter en HI-fornærmelse gennem modulering af NMDA-glutamatreceptorer.38,39
multicenter klinisk forsøg Total Body hypotermi plus Xenon (TOBY-Xe), der anvendes xenon gas i kombination med hypotermi i en prøve af 92 spædbørn, der er født mellem 36 og 43 uger af drægtigheden., Selv om det ikke fandt signifikante forskelle mellem grupper,40 med henblik på at få mere detaljerede oplysninger om nogle af de variabler, der kan have haft en indvirkning på resultaterne af behandling med denne ædle gas, sådan som sin dosis eller varighed, en klinisk fase II forsøg er i øjeblikket i gang (CoolXenon3 Undersøgelse, NCT02071394).,
På den anden side har der ikke været nogen kliniske forsøg med argon til dato, men argon har vist sig at forbedre resultaterne af køling i form af niveauer af N-acetyl-aspartat/laktat markør, som har været forbundet med stigninger i den gennemsnitlige celledød værdier og udvikling af neurologiske sequelae i påvirket nyfødte.41 disse lovende resultater, sammen med dens højere biotilgængelighed og lavere omkostninger sammenlignet med .enon, gør argon til et molekyle med et stort potentiale for bænk til sengeoversættelse i behandlingen af HIE.,
konklusioner
at opnå en effektiv behandling af HIE er en af de store udfordringer, som moderne medicin står overfor. Af denne grund er der i årevis gjort en betydelig indsats for at analysere mekanismerne, der fører til hjernecelleskader efter perinatal asfyksi med det formål at udvikle effektive behandlinger til at blokere dem. På nuværende tidspunkt forsøger børnelæger og neurovidenskabsmænd at udvikle nye forbindelser, der kan fungere i synergi med hypotermi med det formål at reducere de neurologiske følger af HIE til et minimum., På den anden side, de seneste undersøgelser har begyndt at inddrage køn blandt de variabler til at tage hensyn i forvaltningen af HIE, som dimorphic seksuelle forskelle, der er fundet både i de mekanismer, skade (i eksperimentelle modeller, kvindelige dyr har udstillet større hukommelse underskud, mens mandlige dyr har vist større modtagelighed over for oxidativ stress), og i de veje, de forskellige behandlinger, som er under overvejelse., På trods af de lovende fremskridt, der er gjort med brugen af melatonin eller forbindelser, såsom EPO, er prækliniske undersøgelser stadig nødvendige for yderligere at belyse virkningsmekanismerne for disse molekyler, og kliniske forsøg med større prøver er nødvendige for at bestemme den optimale dosering og administrationsveje for disse og andre behandlinger.
finansiering
undersøgelsen blev støttet af et tilskud fra UPV / EHU som en del af universitetets forskningsgruppefinansieringsprogram (GIU 17/018).
interessekonflikter
forfatterne har ingen interessekonflikter at erklære.