10.6: Gitterstrukturen in kristallinen Feststoffen
Einheitszellen von Metallen
Die Struktur eines kristallinen Feststoffs, ob ein Metall oder nicht, wird am besten unter Berücksichtigung seiner einfachsten sich wiederholenden Einheit beschrieben, die als Einheitszelle bezeichnet wird. Die Einheitszelle besteht aus Gitterpunkten, die die Positionen von Atomen oder Ionen darstellen. Die gesamte Struktur besteht dann aus dieser Einheitszelle, die sich in drei Dimensionen wiederholt, wie in Abbildung \(\pageIndex{1}\) dargestellt.,
Beginnen wir unsere Untersuchung der Kristallgitterstruktur und der Einheitszellen mit der einfachsten Struktur und der grundlegendsten Einheitszelle. Um dies zu visualisieren, stellen Sie sich vor, Sie nehmen eine große Anzahl identischer Kugeln wie Tennisbälle und ordnen sie gleichmäßig in einem Behälter an., Der einfachste Weg, dies zu tun, wäre, Ebenen zu erstellen, in denen sich die Kugeln in einer Ebene direkt über denen in der Ebene darunter befinden, wie in Abbildung \(\pageIndex{2}\) dargestellt. Diese Anordnung wird als einfache kubische Struktur bezeichnet, und die Einheitszelle wird als einfache kubische Einheitszelle oder primitive kubische Einheitszelle bezeichnet.
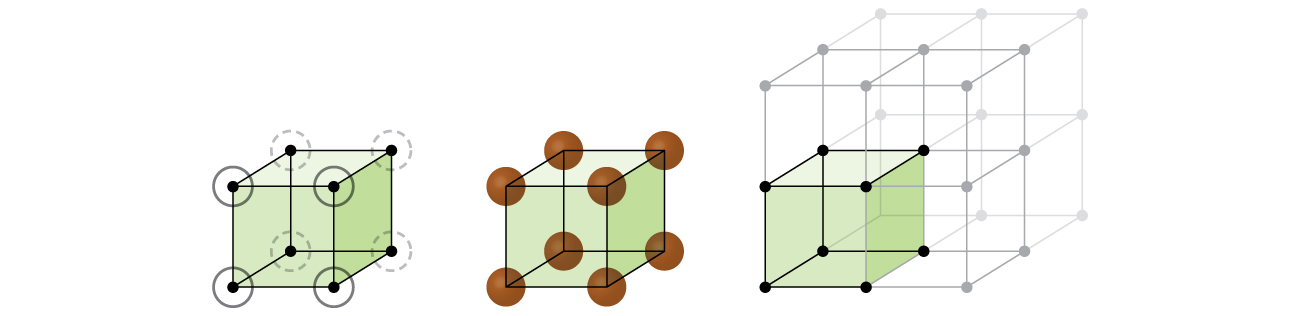
In einer einfachen kubischen Struktur sind die Kugeln nicht so dicht gepackt, wie sie sein könnten, und sie“ füllen “ nur etwa 52% des Volumens des Behälters. Dies ist eine relativ ineffiziente Anordnung, und nur ein Metall (polonium, Po) kristallisiert in einer einfachen kubischen Struktur. Wie in Abbildung \(\pageIndex{3}\) gezeigt, besteht ein Festkörper mit dieser Art von Anordnung aus Ebenen (oder Schichten), in denen jedes Atom nur die vier nächsten Nachbarn in seiner Schicht berührt.ein Atom direkt darüber in der obigen Schicht; und ein Atom direkt darunter in der darunter liegenden Schicht., Die Anzahl der anderen Teilchen, die jedes Teilchen in einem kristallinen Festkörper berührt, wird als Koordinationszahl bezeichnet. Für ein Poloniumatom in einem einfachen kubischen Array beträgt die Koordinationszahl daher sechs.

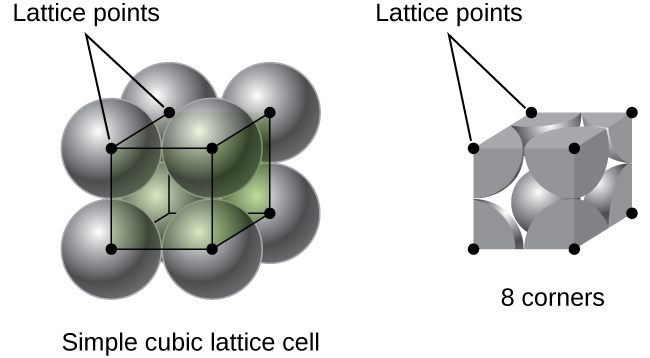
In einem einfachen kubischen Gitter ist die Einheitszelle, die sich in alle Richtungen wiederholt, ein Würfel, der durch die Zentren von acht Atomen definiert ist, wie in Abbildung \(\pageIndex{4}\). Atome an benachbarten Ecken dieser Einheitszelle berühren sich, so dass die Kantenlänge dieser Zelle gleich zwei Atomradien oder einem Atomdurchmesser ist. Eine kubische Einheitszelle enthält nur die Teile dieser Atome, die sich darin befinden. Da ein Atom an einer Ecke einer einfachen kubischen Einheitszelle von insgesamt acht Einheitszellen enthalten ist, befindet sich nur ein Achtel dieses Atoms in einer bestimmten Einheitszelle., Und da jede einfache kubische Einheitszelle an jeder ihrer acht „Ecken“ ein Atom hat, gibt es \(8×\dfrac{1}{8}=1\) atom innerhalb einer einfachen kubischen Einheit Zelle.
Die meisten Metallkristalle sind eine der vier Haupttypen von Einheitszellen., Im Moment konzentrieren wir uns auf die drei kubischen Einheitszellen: einfache kubische (die wir bereits gesehen haben), körperzentrierte kubische Einheitszelle und gesichtszentrierte kubische Einheitszelle-die alle in Abbildung \(\pageIndex{5}\) dargestellt sind. (Beachten Sie, dass es tatsächlich sieben verschiedene Gittersysteme gibt, von denen einige mehr als einen Gittertyp haben, für insgesamt 14 verschiedene Arten von Einheitszellen. Wir lassen die komplizierteren Geometrien für später in diesem Modul.,)
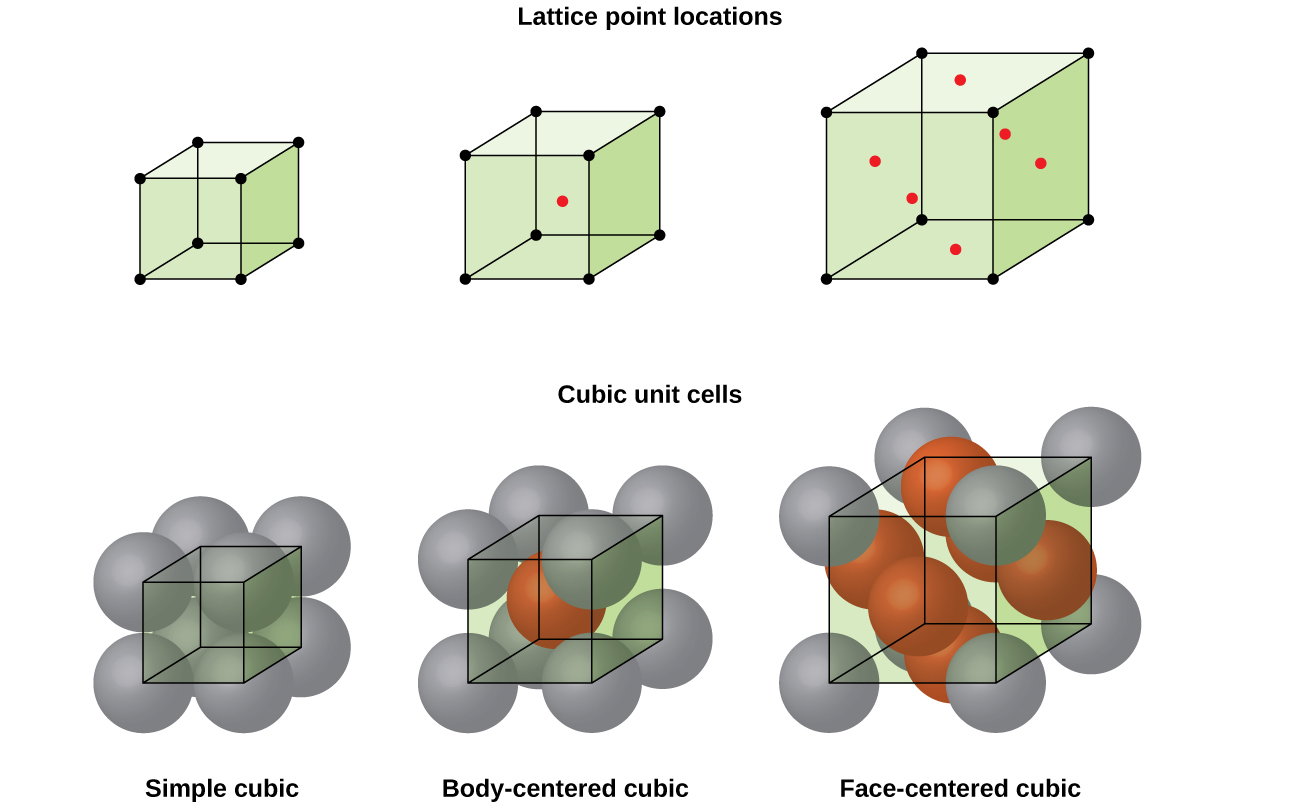
Einige Metalle kristallisieren in einer Anordnung, die eine kubische Einheitszelle mit Atomen an allen Ecken und einem Atom in der Mitte aufweist, wie in Abbildung \(\pageIndex{6}\). Dies wird als körperzentrierter kubischer (BCC) Feststoff bezeichnet., Atome in den Ecken einer BCC-Einheitszelle berühren sich nicht, sondern berühren das Atom in der Mitte. Eine BCC-Einheitszelle enthält zwei Atome: ein Achtel eines Atoms an jeder der acht Ecken (\(8×\dfrac{1}{8}=1\) atom von den Ecken) plus ein Atom von der Mitte. Jedes Atom in dieser Struktur berührt vier Atome in der Schicht darüber und vier Atome in der Schicht darunter. Somit hat ein Atom in einer BCC-Struktur eine Koordinationszahl von acht.,
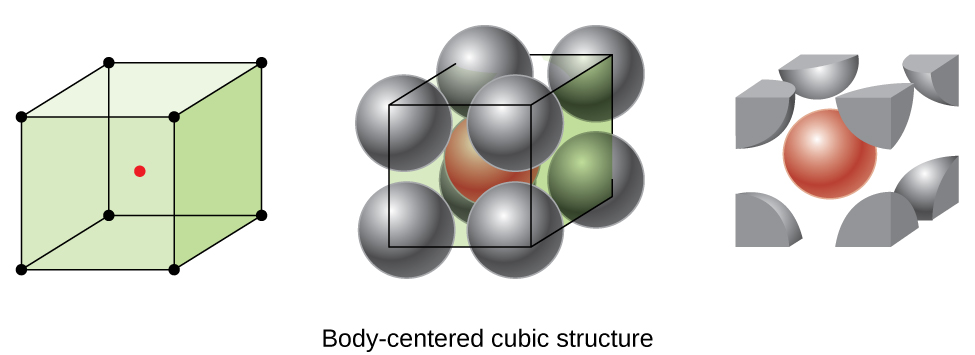
Atome in BCC-Anordnungen sind viel effizienter verpackt als in einer einfachen kubischen Struktur und nehmen etwa 68% des Gesamtvolumens ein. Isomorphen Metalle mit einer BCC-Struktur umfassen, K, Ba, Cr, Mo, W und Fe bei Raumtemperatur., (Elemente oder Verbindungen, die mit der gleichen Struktur kristallisieren, sollen isomorph sein.)
Viele andere Metalle wie Aluminium, Kupfer und Blei kristallisieren in einer Anordnung, die eine kubische Einheitszelle mit Atomen an allen Ecken und in den Zentren jeder Fläche aufweist, wie in Abbildung \(\pageIndex{7}\) dargestellt. Diese Anordnung wird als flächenzentrierter kubischer (FCC) Feststoff bezeichnet., Eine Zelle der FCC-Einheit enthält vier Atome: ein Achtel eines Atoms an jeder der acht Ecken (\(8×\dfrac{1}{8}=1\) atom von den Ecken) und die Hälfte eines Atoms auf jeder der sechs Flächen (\(6×\dfrac{1}{2}=3\) atome von den Gesichtern). Die Atome an den Ecken berühren die Atome in den Zentren der benachbarten Flächen entlang der Flächendiagonalen des Würfels. Da sich die Atome auf identischen Gitterpunkten befinden, haben sie identische Umgebungen.
Atome in einer FCC-Anordnung sind so dicht wie möglich gepackt, wobei Atome 74% des Volumens einnehmen., Diese Struktur wird auch als kubische Kartonverpackung (CCP) bezeichnet. In CCP gibt es drei sich wiederholende Schichten sechseckig angeordneter Atome. Jedes Atom kontaktiert sechs Atome in seiner eigenen Schicht, drei in der Schicht darüber und drei in der Schicht darunter. In dieser Anordnung berührt jedes Atom 12 nahe Nachbarn und hat daher eine Koordinationszahl von 12. Die Tatsache, dass FCC-und CCP-Anordnungen gleichwertig sind, ist möglicherweise nicht sofort offensichtlich, aber warum sie tatsächlich dieselbe Struktur haben, ist in Abbildung \(\pageIndex{8}\) dargestellt.,
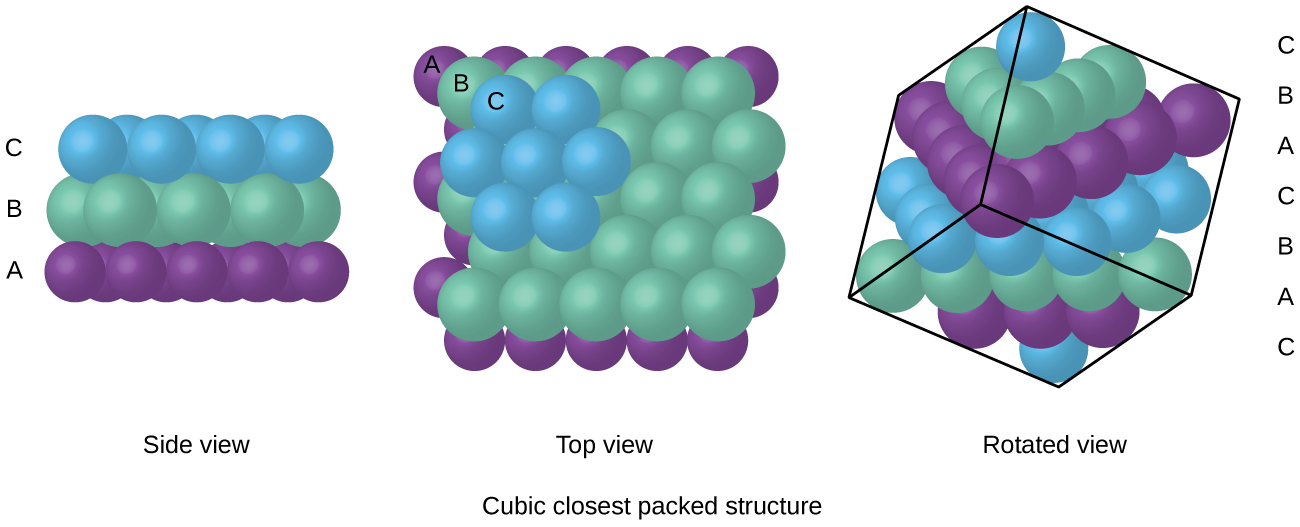
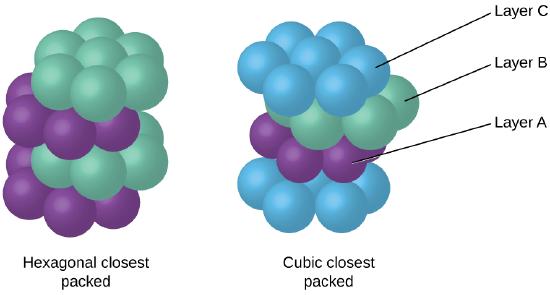
Da eine engere Verpackung den Gesamtabstand zwischen Atomen maximiert und die gesamte intermolekulare Energie minimiert, packen die Atome in den meisten Metallen auf diese Weise., Wir finden zwei Arten der nächsten Verpackung in einfachen metallischen kristallinen Strukturen: CCP, auf das wir bereits gestoßen sind, und hexagonal Closest Packing (HCP) in Abbildung \(\pageIndex{9}\). Beide bestehen aus sich wiederholenden Schichten hexagonal angeordneter Atome. Bei beiden Typen wird eine zweite Schicht (B) auf die erste Schicht (A) gelegt, so dass jedes Atom in der zweiten Schicht mit drei Atomen in der ersten Schicht in Kontakt steht. Die dritte Schicht ist auf zwei Arten positioniert. In HCP befinden sich Atome in der dritten Schicht direkt über Atomen in der ersten Schicht (d. H.,, die dritte Schicht ist auch Typ A), und die Stapelung besteht aus abwechselnden Typ A und Typ B dicht gepackten Schichten (dh ABABAB⋯). In CCP befinden sich Atome in der dritten Schicht nicht über Atomen in einer der ersten beiden Schichten (dh die dritte Schicht ist Typ C), und das Stapeln besteht aus abwechselnden dicht gepackten Schichten vom Typ A, Typ B und Typ C (dh ABCABCABC⋯). Etwa zwei Drittel aller Metalle kristallisieren in dicht gepackten Arrays mit Koordinationszahlen von 12., Metalle, die in einer HCP-Struktur kristallisieren, umfassen Cd, Co, Li, Mg, Na und Zn, und Metalle, die in einer CCP-Struktur kristallisieren, umfassen Ag, Al, Ca, Cu, Ni, Pb und Pt.
Training \(\PageIndex{2}\)
Silber kristallisiert in einer FCC-Struktur. Die Kantenlänge seiner Einheitszelle beträgt 409 pm.
- Was ist der atomare Radius von Ag in dieser Struktur?
- Berechnen Sie die Dichte von Ag.
Antwort a
144 pm
Antwort b
10,5 g/cm3
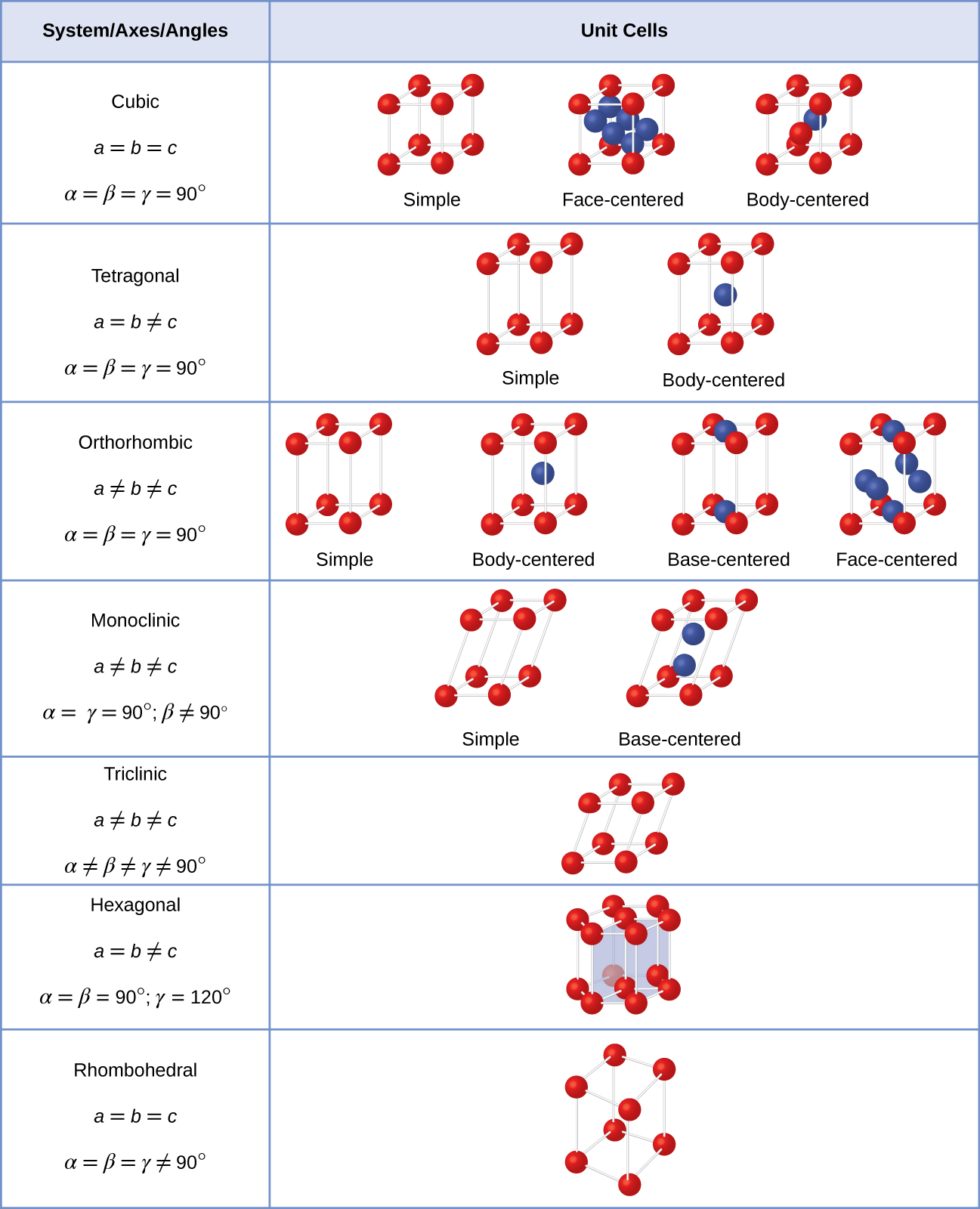
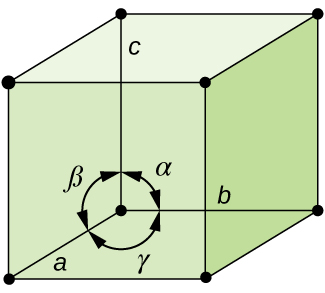
Im Allgemeinen wird eine Einheitszelle durch die Längen von drei Achsen (a, b und c) und die Winkel (α, β und γ) zwischen ihnen definiert, wie in Abbildung \(\pageIndex{10}\) dargestellt., Die Achsen sind definiert als die Längen zwischen Punkten im Raumgitter. Folglich verbinden Einheitszellenachsen Punkte mit identischen Umgebungen.
Es gibt sieben verschiedene Gittersysteme, von denen einige mehr als einen Gittertyp haben, für insgesamt vierzehn verschiedene Einheitszellen, die die in Abbildung \gezeigten Formen haben(\pageIndex{11}\).