6.3: Absolute Konfiguration und die (R) und (S) System
Absolute Konfigurationen von Perspektivformeln
Chemiker benötigen eine bequeme Möglichkeit, ein Stereoisomer von einem anderen zu unterscheiden. Das Cahn-Ingold-Prelog-System ist ein Regelwerk, mit dem wir die stereochemische Konfiguration eines Stereocenters eindeutig definieren können, indem wir die Bezeichnungen „R“ (aus dem lateinischen rectus, was Rechtshänder bedeutet) oder “ S “ (aus dem lateinischen sinister, was Linkshänder bedeutet) verwenden.,
Die Regeln für dieses System der stereochemischen Nomenklatur sind oberflächlich ziemlich einfach.
Regeln für die Zuordnung einer R/S-Bezeichnung zu einem chiralen Zentrum
1: Weisen Sie den vier Substituenten Prioritäten zu, wobei #1 die höchste Priorität und #4 die niedrigste ist. Prioritäten basieren auf der Ordnungszahl.
2: Verfolgen Sie einen Kreis von #1 bis #2 bis #3.
3: Bestimmen Sie die Ausrichtung der Prioritätsgruppe #4. Wenn es in die Ebene der Seite (weg von Ihnen) ausgerichtet ist, gehen Sie zu Schritt 4a. Wenn es aus der Ebene der Seite (zu Ihnen) ausgerichtet ist, gehen Sie zu Schritt 4b.,
4a: (#4-Gruppe, die von Ihnen weg zeigt): Ein Kreis im Uhrzeigersinn in Teil 2 entspricht der R-Konfiguration, während ein Kreis gegen den Uhrzeigersinn der S-Konfiguration entspricht.
4b: (#4-Gruppe zeigt auf Sie): Ein Kreis im Uhrzeigersinn in Teil 2 entspricht der S-Konfiguration, während ein Kreis gegen den Uhrzeigersinn der R-Konfiguration entspricht.
Als erstes Beispiel verwenden wir den 3-Kohlenstoff-Zucker Glyceraldehyd. Das erste, was wir tun müssen, ist, jedem der vier Substituenten, die an das chirale Zentrum gebunden sind, eine Priorität zuzuweisen., Wir betrachten zuerst die Atome, die direkt mit dem chiralen Zentrum verbunden sind: Dies sind H, O (im Hydroxyl), C (im Aldehyd) und C (in der CH2OH-Gruppe).
Zuweisen der R/S-Konfiguration zu Glyceraldehyd:

Zwei Prioritäten sind einfach: Wasserstoff mit einer Ordnungszahl von 1 ist die niedrigste (#4) Priorität und der Hydroxylsauerstoff mit der Ordnungszahl 8 hat Priorität #1. Kohlenstoff hat eine Ordnungszahl von 6. Welche der beiden ‚C‘ – Gruppen hat Priorität #2, der Aldehyd oder der CH2OH?, Um dies zu bestimmen, bewegen wir eine weitere Bindung vom chiralen Zentrum weg: Für den Aldehyd haben wir eine Doppelbindung zu einem Sauerstoff, während wir in der CH2OH-Gruppe eine einzelne Bindung zu einem Sauerstoff haben. Wenn das Atom gleich ist, haben Doppelbindungen eine höhere Priorität als Einzelbindungen. Daher wird der Aldehydgruppe die #2-Priorität und der CH2OH-Gruppe die #3-Priorität zugewiesen.
Wenn unsere Prioritäten zugewiesen sind, schauen wir als nächstes auf die Prioritätsgruppe #4 (die Seite) und sehen, dass sie von uns zurück in die Ebene der Seite zeigt – somit gilt Schritt 4a aus dem obigen Verfahren., Dann verfolgen wir einen Kreis, der durch die Prioritätsgruppen #1, #2 und #3 definiert ist, in aufsteigender Reihenfolge. Der Kreis ist im Uhrzeigersinn, was uns durch Schritt 4a sagt, dass dieser Kohlenstoff die ‚R‘-Konfiguration hat und dass dieses Molekül (R) – Glyceraldehyd ist. Sein Enantiomer muss per Definition (S)-Glyceraldehyd sein.
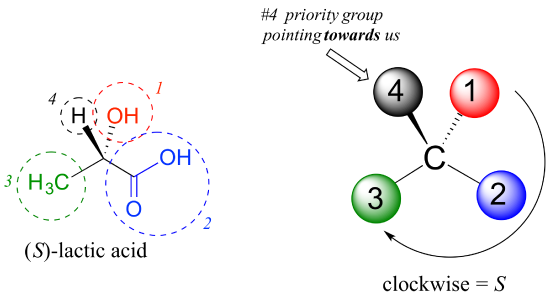
Als nächstes schauen wir uns eines der Enantiomere der Milchsäure an und bestimmen die Konfiguration des chiralen Zentrums. Offensichtlich ist H der # 4 Substituent und OH ist #1. Aufgrund seiner drei Bindungen an Sauerstoff hat der Kohlenstoff in der Säuregruppe Priorität #2 und die Methylgruppe nimmt #3., Die #4-Gruppe, Wasserstoff, wird zufällig in dieser Abbildung auf uns gezeigt (aus der Ebene der Seite), also verwenden wir Schritt 4b: Der Kreis, der von #1 bis #2 bis #3 verfolgt wird, ist im Uhrzeigersinn, was bedeutet, dass das chirale Zentrum die S-Konfiguration hat.
Das Medikament Thalidomid ist eine interessante – aber tragische – Fallstudie zur Bedeutung der Stereochemie im Arzneimitteldesign., Zuerst von einem deutschen Pharmaunternehmen hergestellt und weit verbreitet in Europa und Australien in den späten 1950″s als Beruhigungsmittel und Heilmittel für morgendliche Übelkeit bei schwangeren Frauen verschrieben, Thalidomid wurde bald als Ursache für verheerende Geburtsfehler bei Babys von Frauen beteiligt, die es genommen hatten. Thalidomid enthält ein chirales Zentrum und existiert somit in zwei enantiomeren Formen. Es wurde als racemische Mischung vermarktet: mit anderen Worten, eine 50: 50-Mischung beider Enantiomere.
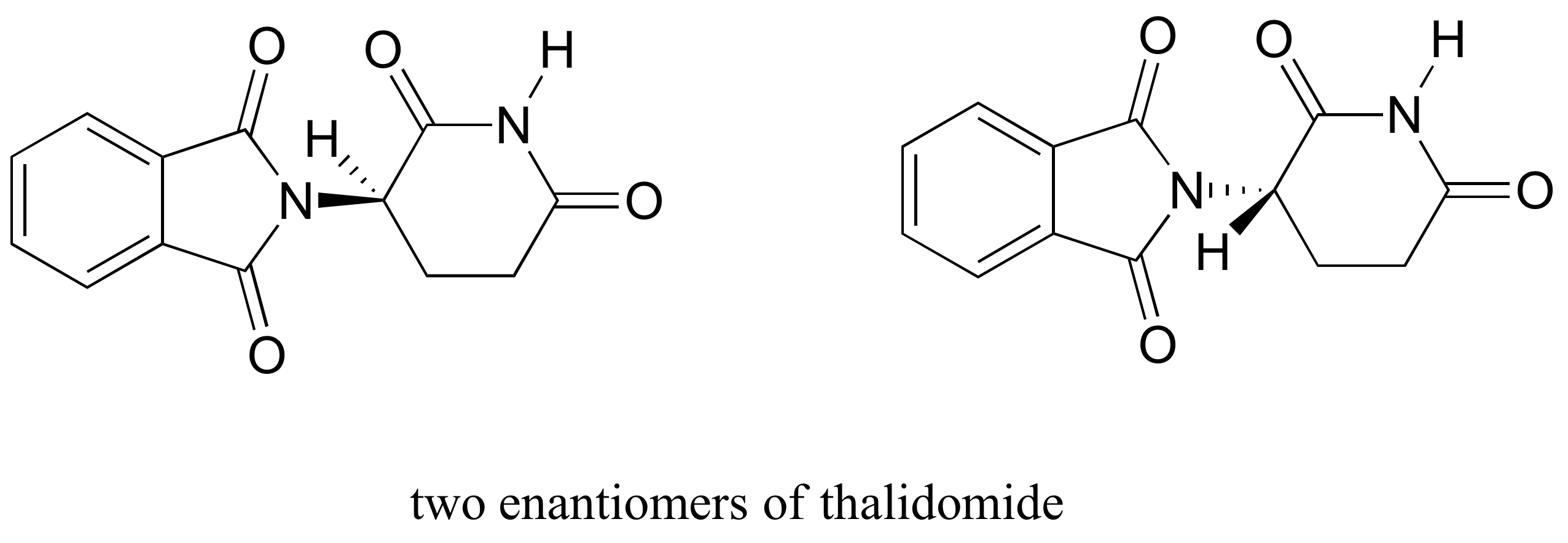
Versuchen wir, die stereochemische Konfiguration des Enantiomers auf der linken Seite zu bestimmen., Von den vier Bindungen zum chiralen Zentrum ist Wasserstoff die Priorität #4. Die Stickstoffgruppe ist #1, die Carbonylseite des Rings ist #2 und die –CH2 Seite des Rings ist #3.
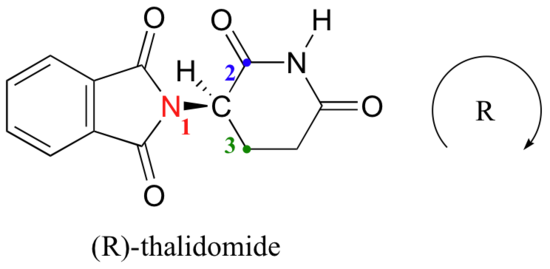
Der Wasserstoff zeigt von uns weg, und die priorisierten Substituenten verfolgen einen Kreis im Uhrzeigersinn: Dies ist das R Enantiomer von Thalidomid. Der andere Enantiomer muss natürlich die S-Konfiguration haben.,
Obwohl Wissenschaftler heute noch nicht sicher sind, wie Thalidomid wirkt, deuten experimentelle Beweise darauf hin, dass es tatsächlich das R-Enantiomer war, das die gewünschten medizinischen Wirkungen hatte, während das S-Enantiomer die Geburtsfehler verursachte. Selbst mit diesem Wissen ist reines (R)-Thalidomid jedoch nicht sicher, da Enzyme im Körper schnell zwischen den beiden Enantiomeren umwandeln – wir werden sehen, wie das in Kapitel 12 geschieht.
Als historische Anmerkung wurde Thalidomid nie für den Einsatz in den Vereinigten Staaten zugelassen. Dies war zum großen Teil den Bemühungen von Dr., Frances Kelsey, ein Food and Drug Officer, der auf Gefahr für ihre Karriere, blockiert seine Zulassung aufgrund ihrer Bedenken über den Mangel an ausreichenden Sicherheitsstudien, insbesondere im Hinblick auf die Fähigkeit des Medikaments in den Blutkreislauf eines sich entwickelnden Fötus. Unglücklicherweise, obwohl zu dieser Zeit klinische Studien für neue Medikamente eine weit verbreitete und unregulierte Verteilung an Ärzte und ihre Patienten im ganzen Land beinhalteten, so dass Familien in den USA nicht von den verursachten Schäden verschont blieben.,
In jüngster Zeit ist es in den USA legal geworden, ein enges Derivat von Thalidomid mit strengen Sicherheitsmaßnahmen für die Behandlung einer Form von Blutkrebs, dem multiplen Myelom, erneut zu verschreiben. In Brasilien wird Thalidomid zur Behandlung von Lepra eingesetzt – aber trotz Sicherheitsmaßnahmen werden Kinder immer noch mit Thalidomid-bedingten Defekten geboren.
Übung 1.: Bestimmen Sie die stereochemischen Konfigurationen der chiralen Zentren in den unten gezeigten Biomolekülen.
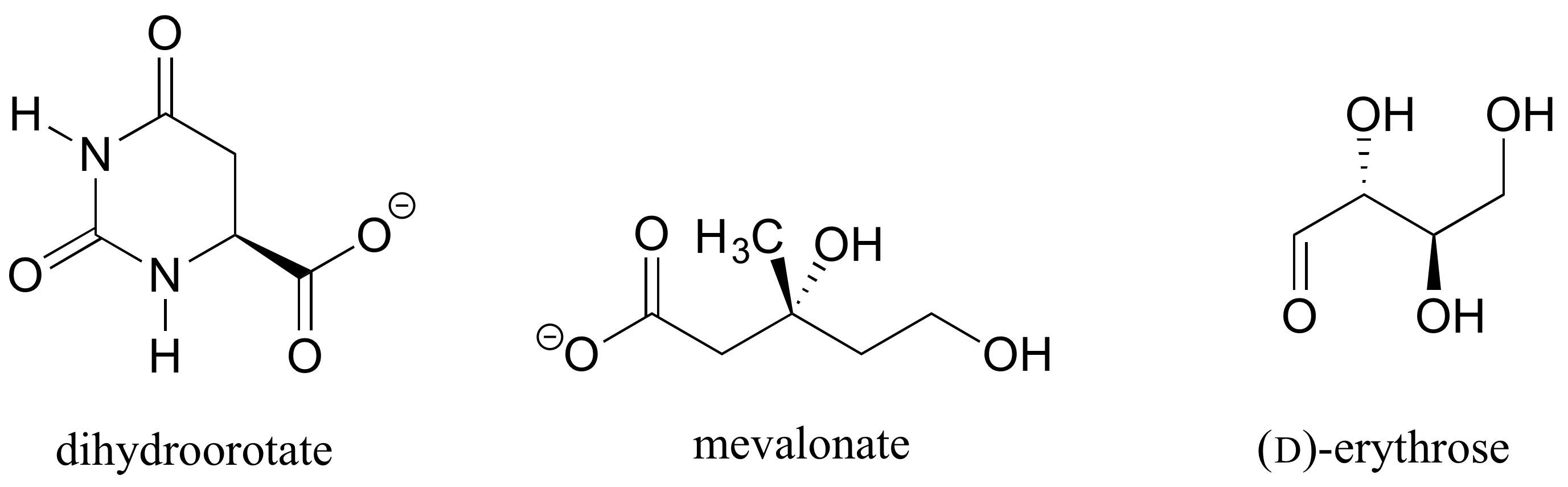
Aufgabe 2.,: Sollte das (R) Enantiomer von Malat einen festen oder gestrichelten Keil für die C-O-Bindung in der folgenden Abbildung haben?
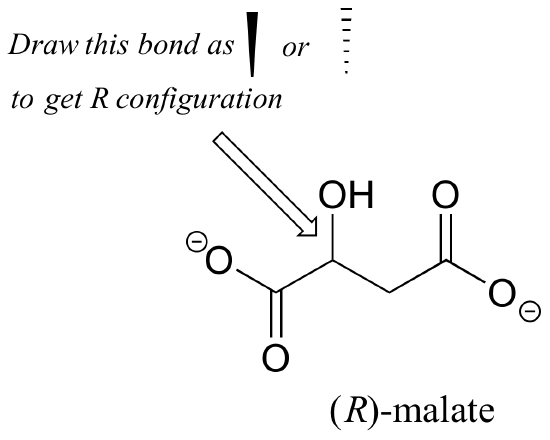
Aufgabe 3.: Verwenden von festen oder gestrichelten Keilen, um Stereochemie zu zeigen, zeichnen Sie das (R) Enantiomer von Ibuprofen und das (S) Enantiomer von 2-Methylerythritol-4-phosphat (Strukturen werden früher in diesem Kapitel ohne Stereochemie gezeigt).
Lösungen für Übungen
Absolute Konfigurationen von Fischer-Projektionen
Um die absolute Konfiguration eines chiralen Zentrums in einer Fisher-Projektion zu bestimmen, verwenden Sie das folgende zweistufige Verfahren.,
Schritt 1
Weisen Sie den vier Liganden (Gruppen), die mit dem CIP-Prioritätssystem an das chirale Zentrum gebunden sind, Prioritätsnummern zu.
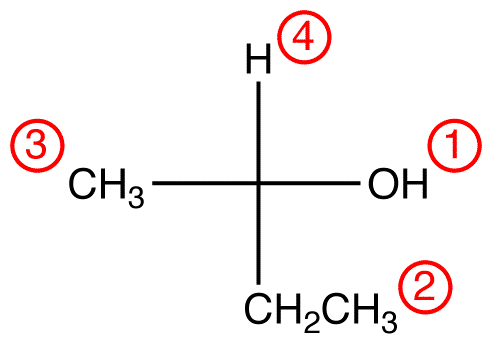
Schritt 2 – vertikale Option
Wenn sich der Ligand mit der niedrigsten Priorität auf einer vertikalen Bindung befindet, zeigt er vom Betrachter weg.
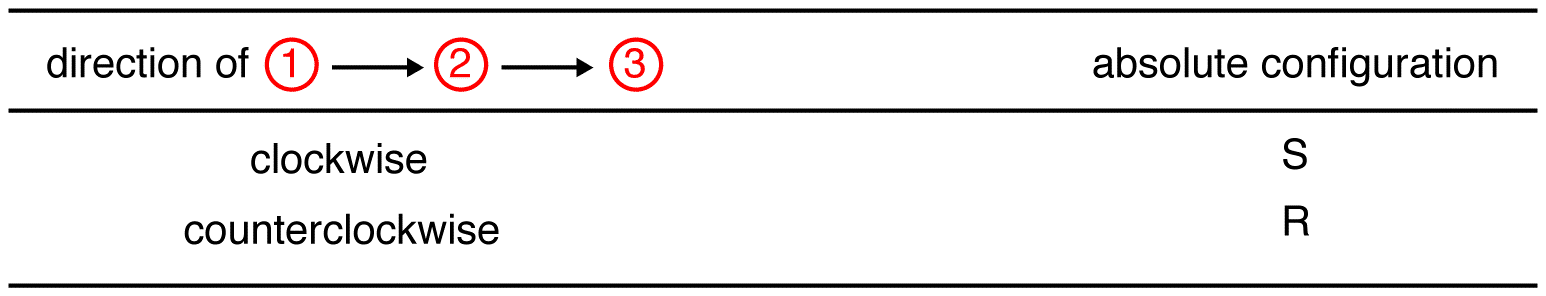
Trace die drei höchsten Priorität Liganden ab der höchsten Priorität ligand (① → ② → ③) in die Richtung, dass geben eine Sehr richtige Antwort.

In der verbindung unten, die bewegung ist im uhrzeigersinn anzeigt eine R-konfiguration., Der vollständige IUPAC-Name für diese Verbindung ist (R)-Butan-2-ol.

Schritt 2-horizontale Option
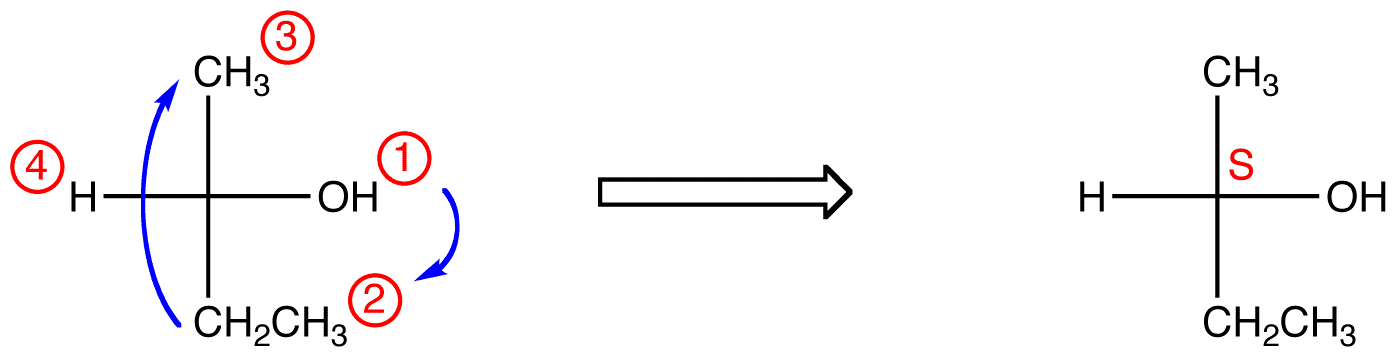
Wenn sich der Ligand mit der niedrigsten Priorität auf einer horizontalen Bindung befindet, zeigt er auf den Betrachter.
Verfolgen Sie die drei Liganden mit der höchsten Priorität, beginnend mit dem Liganden mit der höchsten Priorität ( ① → ② → ③ ), in die Richtung, die eine schrecklich falsche Antwort gibt. Beachten Sie in der folgenden Tabelle, dass die Konfigurationen vom ersten Beispiel an umgekehrt sind.,
In der verbindung unten, die bewegung ist im uhrzeigersinn (R), die ist Schrecklich falsch, so die tatsächliche konfiguration ist S. Die komplette IUPAC name für diese verbindung ist (S)-butan-2-ol.
Bearbeiten von Fischer-Projektionen ohne Änderung der Konfiguration
Eine Fischer-Projektion beschränkt ein dreidimensionales Molekül auf zwei Dimensionen. Folglich gibt es Einschränkungen hinsichtlich der Operationen, die an einer einzigen Projektion ausgeführt werden können, ohne die absolute Konfiguration in chiralen Zentren zu ändern., Die Operationen, die die absolute Konfiguration an einem chiralen Zentrum in einer Fischer-Projektion nicht ändern, können als zwei Regeln zusammengefasst werden.
Regel 1: Die Drehung der Fischer-Projektion um 180 ° in beide Richtungen, ohne sie von der Papierebene abzuheben, ändert nichts an der absoluten Konfiguration im chiralen Zentrum.
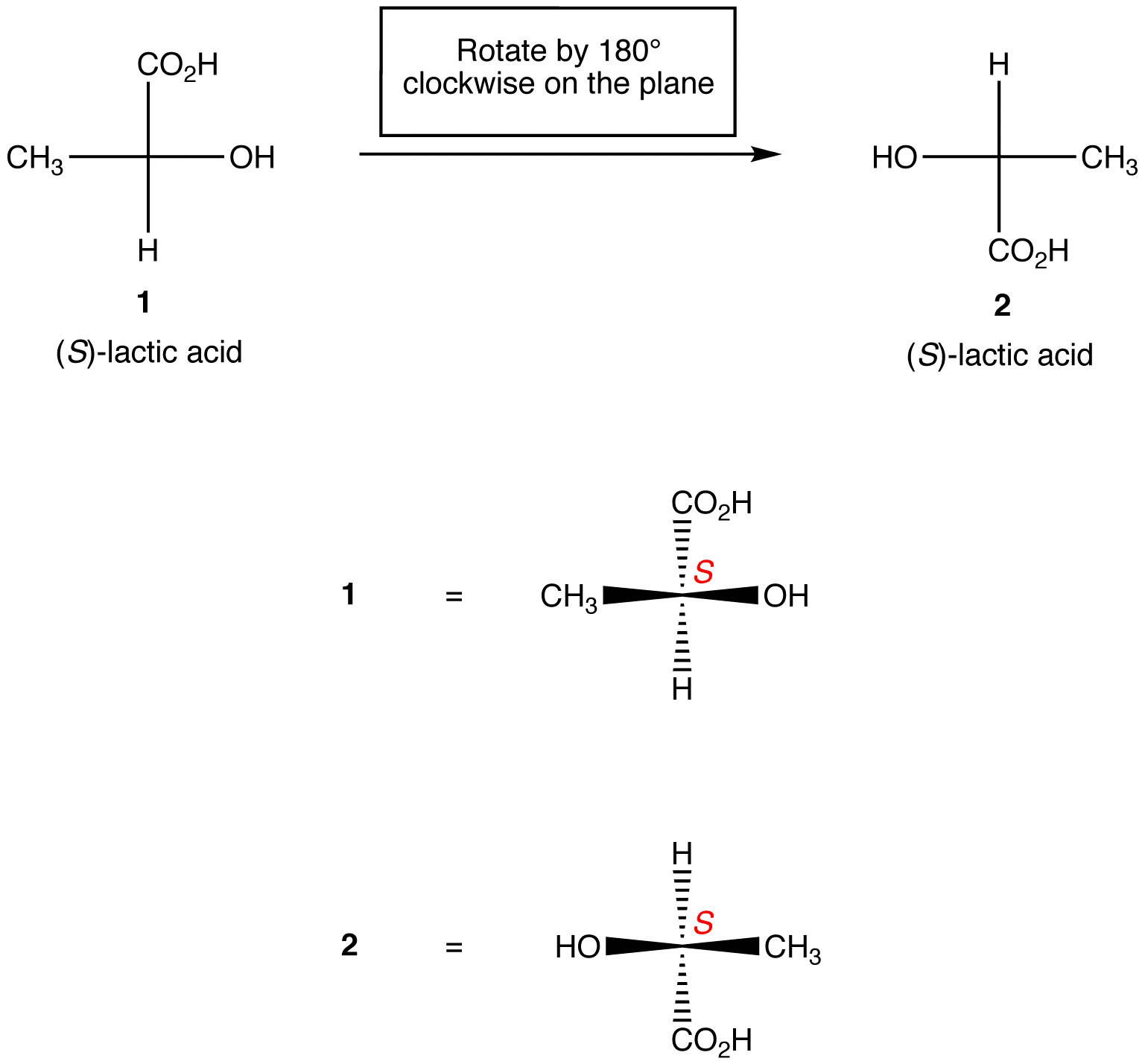
Regel 2: Die Drehung von drei Liganden auf dem chiralen Zentrum in beide Richtungen, wobei der verbleibende Ligand an Ort und Stelle bleibt, ändert die absolute Konfiguration im chiralen Zentrum nicht.,
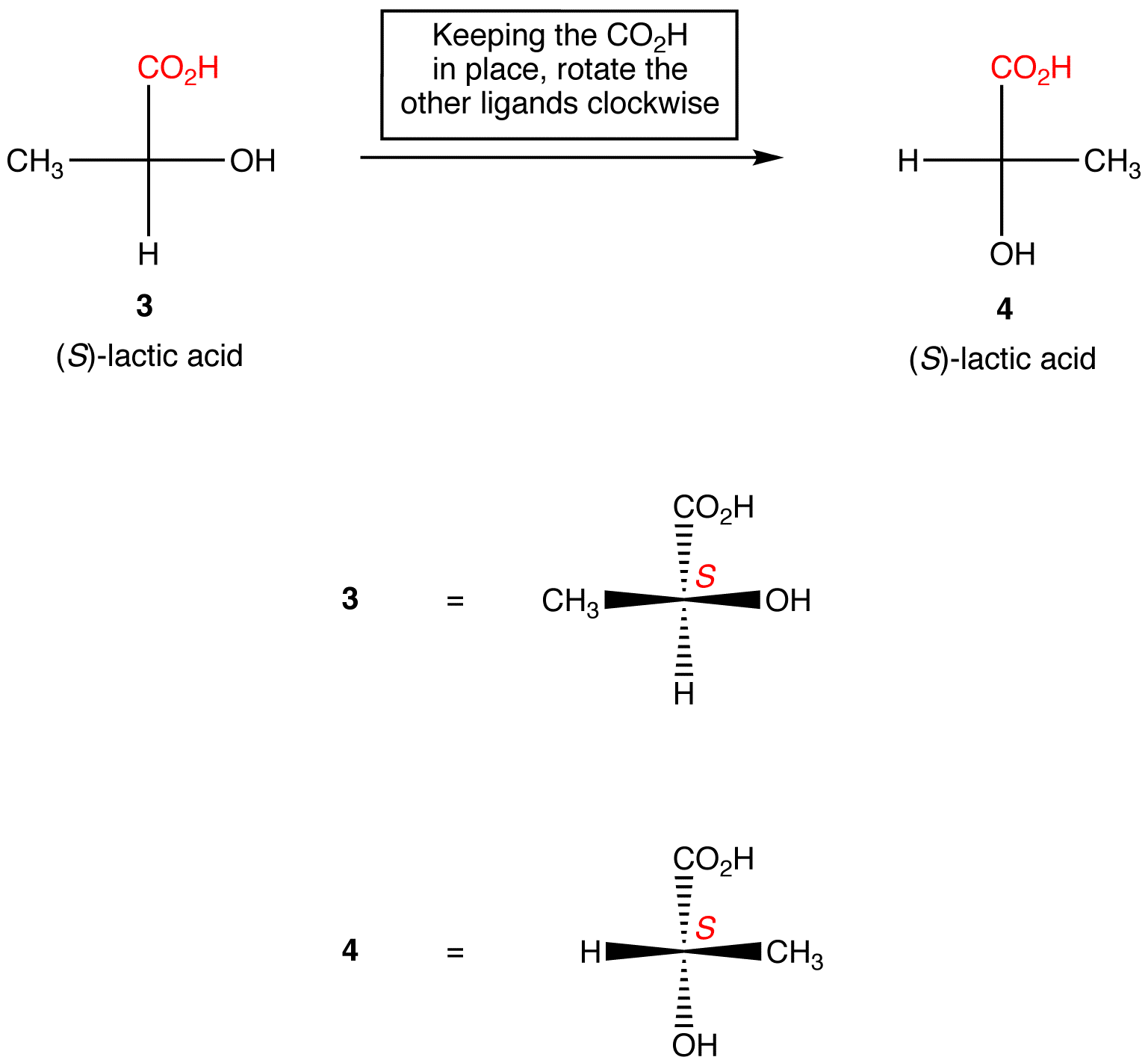
Bearbeiten von Fischer-Projektionen mit Konfigurationsänderung
Die Operationen, die die absolute Konfiguration in einem chiralen Zentrum in einer Fischer-Projektion ändern, können als zwei Regeln zusammengefasst werden.
Regel 1: Die Drehung der Fischer-Projektion um 90 ° in beide Richtungen ändert die absolute Konfiguration im chiralen Zentrum.
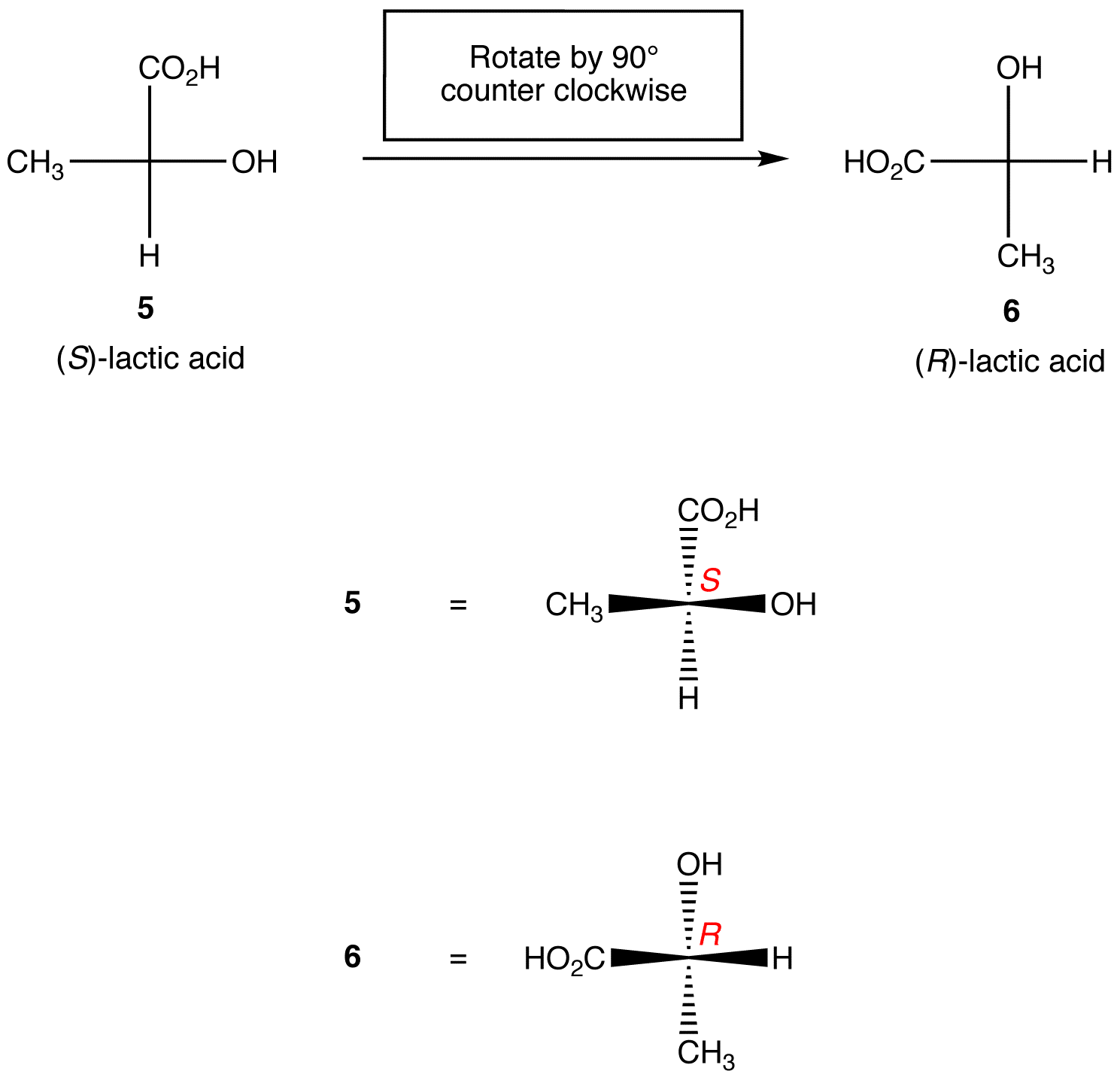
Regel 2: Der Austausch von zwei beliebigen Liganden im chiralen Zentrum ändert die absolute Konfiguration im chiralen Zentrum.,
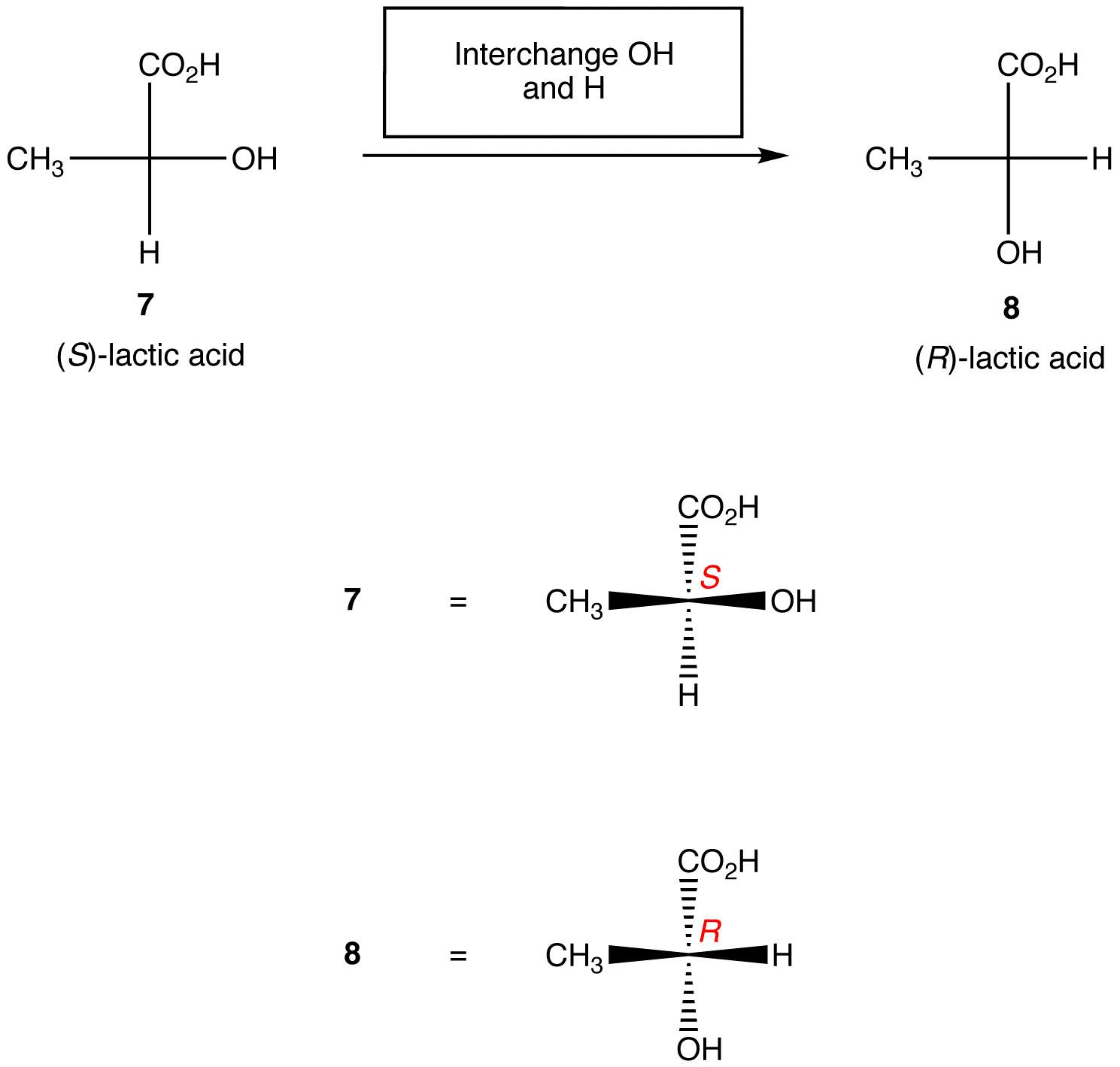
Die obigen Regeln gehen davon aus, dass die betrachtete Projektion nur ein chirales Zentrum enthält. Mit Vorsicht können sie jedoch auf die Projektionen angewendet werden, die eine beliebige Anzahl chiraler Zentren enthalten.
Übung 1
Klassifizieren Sie die folgenden Verbindungen als R oder S?
Lösung
- S: I > Br > F > H. Die niedrigste Priorität Substituenten, H, geht schon in Richtung der Rückseite., Es dreht sich links von I nach Br nach F, also ist es ein S.
- R: Br > Cl > CH3 > H. Sie müssen H und Br wechseln, um das H mit der niedrigsten Priorität hinten zu platzieren. Dann dreht sich CH3 von Br nach Cl nach rechts und gibt Ihnen ein R.
- Weder R noch S: Dieses Molekül ist achiral. Nur chirale Moleküle können R oder S genannt werden
- R: OH > CN > CH2NH2 > H. Das H, die niedrigste Priorität, muss nach hinten geschaltet werden., Wenn Sie dann von OH nach CN zu CH2NH2 wechseln, biegen Sie nach rechts ab und geben Ihnen ein R.
- (5) S: \(\ce{-COOH}\) > \(\ce{-CH_2OH}\) > \(\ce{C#CH}\) > \(\ce {}\). Wenn Sie dann von \(\ce {- COOH}\) nach \(\ce{-CH_2OH}\) nach \(\ce{-C#CH}\), biegen Sie nach links ab und geben Ihnen eine S-Konfiguration.
Übungen
6. Orientieren Sie das Folgende so, dass das Atom mit der geringsten Priorität (4) dahinter liegt, und weisen Sie dann die Stereochemie (R oder S) zu.

7. Draw (R)-2-bromobutan-2-ol.
8., Weisen Sie dem folgenden Molekül R/S zu.
.png?revision=1)

A = S; B = R
8. Die stereo-center ist R.
Andere Ressourcen
Kahn Academy video-tutorial zur R-S naming system
- Schore und Vollhardt. Organische Chemie Struktur und Funktion. New York:W. H. Freeman and Company, 2007.
- McMurry, John und Simanek, Eric. Grundlagen der Organischen Chemie. 6th Ed. Brooks Cole, 2006.,
Mitwirkende und Aufgaben
- Ekta Patel (UCD), Ifemayowa Aworanti (University of Maryland, Baltimore County)
- Organische Chemie Mit Biologischen Schwerpunkt von Tim Soderberg (University of Minnesota, Morris)