Kombinierte Therapie bei neonataler hypoxisch-ischämischer Enzephalopathie / Anales de Pediatria (englische Ausgabe)
Einführung
Mit einer Inzidenz von 1-3 Fällen pro 1000 Vollzeitgeburten ist 1 hypoxisch-ischämische Enzephalopathie (HIE) eine der häufigsten Ursachen für Hirnschäden bei Neugeborenen. Unter Berücksichtigung der wachsenden Zahl von Hochrisikogeburten aufgrund der zunehmenden Entwicklung des Mütteralters und der Häufigkeit von Mehrlingsschwangerschaften ist HIE nach wie vor ein relevantes Problem im Krankenhausumfeld, für das es noch keine endgültige Lösung gibt.,
Die Forschung zur Pathophysiologie der perinatalen Asphyxie hat es uns ermöglicht, den komplexen Prozess zu verstehen, der auf zellulärer und Gewebsebene stattfindet, wenn sich Hirnschäden aufgrund von Sauerstoffmangel entwickeln. Viele der beteiligten Verletzungsmechanismen werden basierend auf dem Zeitpunkt ihrer Entwicklung gruppiert, und es wurden 4 Hauptphasen beschrieben (Abb. 1): primäre Phase oder akute Episode einer hypoxischen Ischämie (HI), latente Phase, sekundäre Phase und tertiäre Phase., In der Primärphase resultiert der Schaden aus einer Verringerung der Sauerstoffzufuhr zu Zellen und Geweben, was zu einem Primärenergieausfall führt. Es folgt eine offensichtliche Erholung der Konzentrationen hochenergetischer phosphorylierter Verbindungen, die als latente Phase bezeichnet werden., Diese Verbesserung ist jedoch nur vorübergehend und weicht der sekundären Phase, in der viele der pathophysiologischen Mechanismen, die an der Entwicklung von Hirnschäden bei Neugeborenen beteiligt sind, ins Spiel kommen, darunter Exzitotoxizität, ein massiver Zustrom von Calciumionen in die Zellen, oxidativer Stress, Entzündungen und in den meisten Fällen Zelltod aufgrund von Nekrose oder Apoptose. Zuletzt ist die tertiäre Phase durch die Persistenz von Hirnschäden Wochen, Monate oder sogar Jahre nach der anfänglichen hypoxisch-ischämischen Beleidigung gekennzeichnet.,
Das Verständnis der zugrunde liegenden Pathophysiologie von HIE hat die Identifizierung potenzieller therapeutischer Ziele ermöglicht, die zur Verringerung der durch Asphyxie verursachten Hirnschäden und zur Entwicklung zahlreicher Behandlungsstrategien beitragen könnten. Einige dieser Behandlungen, die sich derzeit in Studien befinden, sollen synergistisch mit therapeutischer Hypothermie wirken, der einzigen Behandlung gegen HIE, die im Allgemeinen auf der Neugeborenen-Intensivstation angewendet wurde.,
Hypothermie
Hypothermie wurde als neuroprotektive Strategie bei Säuglingen eingesetzt, nachdem ein endogener Kühlmechanismus entdeckt wurde, der sich bei Säuglingen manifestierte, die während der Geburt eine Verletzung erlitten hatten.2 Seine neuroprotektiven Wirkungen hängen hauptsächlich mit der Abnahme der Stoffwechselaktivität des Gehirns um 5% bei jeder Temperaturabnahme von 1°C zusammen, 3,die einige der durch Asphyxie ausgelösten schädlichen Stoffwechselwege moduliert, die in Fig. 2.
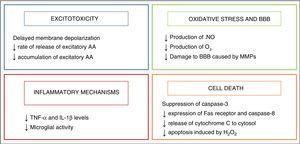
Wirkung von Hypothermie auf Hirnschadenmechanismen.
Kombinationstherapie
Da die Beweise darauf hindeuten,dass aktuelle Hypothermieprotokolle optimal sind4 sind in der klinischen Praxis jedoch von begrenzter Wirksamkeit, 5 Wir müssen das therapeutische Armamentarium für das Management von HIE erweitern.,6 Neuere Forschungen haben sich auf die Entwicklung und Implementierung von Behandlungen konzentriert, die in Kombination mit Hypothermie angewendet werden können, um auf verschiedenen Ebenen der pathophysiologischen Kaskade zu wirken und die Synergie beider Therapien zu fördern (Abb. 3).

Mögliche therapeutische Ziele und neuroprotektive Hauptstrategien, die derzeit Versuchen zur Behandlung von Neugeborenen-HIE unterzogen werden.
Melatonin
Melatonin (N-Acetyl-5-Metoxitriptamina) ist ein Neurohormon, das von der Zirbeldrüse synthetisiert wird und dessen Sekretion einem Tag-Nacht-Zyklus folgt und dessen Hauptrolle in der Regulierung des Tagesrhythmus liegt. Die wichtigsten Aspekte, die seine Verwendung bei der Behandlung von HIE ermöglichen, sind seine starke antioxidative und entzündungshemmende Wirkung7 und seine Fähigkeit, die Blut–Hirn-Schranke zu überqueren und das zentrale Nervensystem zu erreichen.,8
Vor dem Versuch bei Neugeborenen erhöht Melatonin nachweislich das Schutzniveau, das Hypothermie durch die Optimierung des Energiestoffwechsels des Gehirns in einem Ferkelmodell der Asphyxie bietet.9 Im klinischen Umfeld eine Studie von Aly et al.10 zugeteilt die Hälfte der erstickten Neugeborenen zu Hypothermie und 5 Dosen von 10 mg/kg / Tag Melatonin durch den oralen Weg geliefert., Die Autoren fanden eine Verringerung der Serumspiegel von Superoxiddismutase und Stickstoffmonoxid bei den mit Kombinationstherapie behandelten Patienten im Vergleich zu denen, die allein mit Kühlung behandelt wurden, und zeigten so die vorteilhaften Wirkungen der Kombination beider Strategien gegen oxidativen Stress.
Eine aktuelle Studie von Balduini et al., um die Sicherheit, Pharmakokinetik, Dosierung und Wirksamkeit von Melatonin in Kombination mit Hypothermie zu bewerten, wurde festgestellt, dass die Kühlung die Pharmakokinetik von Melatonin11 nicht beeinflusste und dass es möglich war, hohe Serumspiegel des Hormons zu erhalten, das Dosen verabreichte, die im Vergleich zu denen in Versuchstiermodellen niedriger waren. Gegenwärtig rekrutiert die klinische Studie MELPRO (NCT03806816) Patienten mit einer Stichprobe von 100 Neugeborenen., Diese und andere ähnliche Studien sind für die zukünftige Entwicklung klinischer Phase-III-Studien und die anschließende Anwendung von Melatonin in der täglichen klinischen Praxis unerlässlich.
Allopurinol
Der Grund für die Verwendung von Allopurinol bei der Behandlung von HIE ist seine hemmende Wirkung auf die Xanthinoxidase, ein Enzym, das an oxidativem Stress beteiligt ist. Darüber hinaus wirkt dieses Medikament als Frei-Eisen-Chelator und sequestriert Hydroxylradikale.,12,13 Eine präklinische Studie an Rattenwelpen, in der die Tiere einer von 5 Gruppen zugeordnet wurden (Kontrollgruppe, HI-Gruppe, mit Hypothermie behandelte Gruppe, Gruppe, die mit Allopurinol behandelt wurde, und Gruppe, die mit Kombinationstherapie behandelt wurde), ergab, dass 72 h nach der HI-Beleidigung die Kombinationstherapiegruppe das niedrigste Infarktvolumen aufwies.,14
Wenn es um seine pharmakologischen Eigenschaften geht, kann Allopurinol schnell die Plazenta überqueren und therapeutische Konzentrationen bei Neugeborenen erreichen, wie in einer Studie an schwangeren Frauen gezeigt wurde, die 500 mg Allopurinol intravenös erhielten, mit dem Nachweis optimaler Allopurinolspiegel 5min später in Nabelschnurblutproben.15 Eine Studie von van Bel et al., im Jahr 1998, das seine potentielle antioxidative Wirkung bei erstickten Neugeborenen mit schweren HIE analysiert fand, dass die intravenöse Verabreichung von 40 mg / kg Allopurinol eine Verringerung der Bildung von freien Radikalen erreicht.13 Eine später von Benders et al. durchgeführte Studie. im Jahr 2006 wurden keine Unterschiede zwischen der mit Allopurinol behandelten Gruppe und der Kontrollgruppe festgestellt.16 In den Schlussfolgerungen identifizierten diese Autoren den extremen Schweregrad von HIE bei den in die Stichprobe einbezogenen Neugeborenen als mögliche Erklärung für das Fehlen signifikanter Unterschiede., Sie stellten auch die Hypothese auf, dass der Zeitraum bis zur Verabreichung von Allopurinol (3–4h nach Reperfusion) zu lang gewesen sein könnte, um günstige Ergebnisse zu erzielen. In Bezug auf den letzteren Punkt, Gunes et al. verabreichte die gleiche Dosis Allopurinol, die in den beiden vorherigen Studien verabreicht wurde, jedoch innerhalb von 2h nach der Geburt, und fand Verbesserungen der neurologischen Entwicklungsergebnisse in der Behandlungsgruppe.,17 In gleicher Weise erhöhte die Verabreichung von intravenösem Allopurinol an Mütter während der Geburt von Föten mit Hypoxie oder beginnender Hypoxie die Wirksamkeit der Behandlung und senkte die Nabelschnurblutspiegel von Protein S-100β, einem Marker für Hirnschäden.18 Derzeit wird eine klinische Studie unter dem Namen Effect of Allopurinol für hypoxisch-ischämische Hirnverletzungen auf neurokognitive Ergebnisse (NCT03162653) durchgeführt, um die potenziellen therapeutischen Wirkungen der Verabreichung dieses Enzyminhibitors in den ersten Minuten nach der Geburt zu bewerten.,
Erythropoietin
Erythropoietin (EPO) ist ein Zytokin von 30,4 kDa, das von der Leber im fötalen Leben und nach der Geburt von der Niere und dem sich entwickelnden Gehirn synthetisiert wird und dort als Wachstumsfaktor und neuroprotektives Mittel wirkt.19 Die Verwendung von sowohl EPO als auch rekombinantem humanem EPO (rhEPO) in HIE beruht auf seiner Aktivität durch den Einsatz von EPO-Rezeptoren, die in Neuronen und Glia vorhanden sind,20 als potentes Antiapoptotikum (stimulierende Transkription der antiapoptotischen Gene BCL-2 und BCL-XL) und als entzündungshemmendes und antioxidatives Mittel.,19,21 Zusätzlich zu seiner neuroprotektiven Wirkung kann EPO langfristige Reparaturprozesse wie Angiogenese, Oligodendrogenese und Neurogenese fördern.22,23
Präklinische Studien, die den Synergieeffekt der Kombination der Verabreichung von EPO oder rhEPO mit Hypothermie bewertet haben, haben widersprüchliche Ergebnisse erbracht. In einem ähnlichen Rattenmodell von hypoxisch-ischämischen Hirnschäden am Tag 7 nach der Geburt, Fang et al. fand keine signifikanten neuroprotektiven Wirkungen ihrer kombinierten Verwendung.24 Jedoch in einer anderen Studie von Fan et al.,,25 die Autoren beobachten eine milde, wohltuende Wirkung auf die sensomotorische Funktion in der Ratte Welpen, obwohl dieser Unterschied spiegelt sich nicht in die histologischen Merkmale von Gehirn tissue samples.
Studien bei Neugeborenen mit HIE haben gezeigt, dass die Anwendung von rhEPO in Dosen von 300–2500IU/kg sicher ist. Niedrige Dosen von rhEPO wurden bei Patienten mit mäßigen Schäden als wirksam befunden und scheinen mit einem verringerten Risiko für Behinderung oder Tod verbunden zu sein.26 Höhere Dosen (von bis zu 2500IU/kg) können die Häufigkeit von Anfällen und neurologischen Anomalien nach 6 Monaten reduzieren.,27
Heute laufen drei klinische Phase-III-Studien mit einer geplanten Rekrutierung von insgesamt 840 Neugeborenen zur Beurteilung der Sicherheit und Wirksamkeit hoher EPO-Dosen (1000IU/kg) in Kombination mit Hypothermie (Erythropoietin für hypoxische ischämische Enzephalopathie bei Neugeborenen, NCT03079167; Hochdosiertes Erythropoetin für Asphyxie und Enzephalopathie, NCT02811263; Erythropoetin bei der Behandlung von neonataler hypoxischer ischämischer Enzephalopathie, NCT03163589). Das Hauptziel der ersten 2 ist es, die 2-Jahres-Mortalität oder-behinderung zu reduzieren, während die dritte diese beiden Ergebnisse nach einem Jahr bewertet., Wir warten auf die Ergebnisse dieser und anderer Studien, um festzustellen, ob EPO oder eines seiner Derivate wirksam sind und wie sie in der klinischen Praxis angewendet werden sollten, und bewerten Faktoren wie die minimale wirksame Dosis, den Verabreichungsweg, die Dauer der Behandlung usw.
Stammzellen
Die Verwendung von Stammzellen zur Behandlung aller Arten von Krankheiten, einschließlich HIE, ist ein Forschungsgebiet, das weiter wächst., Dieser therapeutische Ansatz könnte dazu beitragen, geschädigtes Hirngewebe nach der hypoxisch-ischämischen Beleidigung durch die Wechselwirkung von Stammzellen mit Immunzellen in vom Gehirn entfernten Organen wie der Milz zu reparieren und zu regenerieren, wodurch die Immun – /Entzündungsreaktion verändert wird. In ähnlicher Weise kann die mit ihrer Verabreichung erzielte funktionelle Erholung teilweise durch die Wechselwirkung der transplantierten Zellen und des Hirngewebes mit der daraus resultierenden Produktion von Wachstumsfaktoren erklärt werden, deren endgültiger Effekt sich in einer erhöhten Neurogenese und Zellproliferation widerspiegeln würde.,
Obwohl wir unser Wissen noch vertiefen müssen, um Stammzellen als wirksame Therapie einsetzen zu können, haben experimentelle Studien an Tieren gezeigt, dass verschiedene Arten von Stammzellen in der Lage sind, im geschädigten Gehirn zu überleben, sich in Neuronen oder Glia zu differenzieren, sich in das Zielgewebe zu integrieren und Verhaltensergebnisse günstig zu verändern (überprüft in Bennet et al.28)., Jüngste Studien haben berichtet,dass die Verabreichung von mesenchymalen Stammzellen in Kombination mit 24h Kühlung bei Rattenwelpen 7 Tage nach der Geburt bessere Ergebnisse im Vergleich zu beiden isolierten Behandlungen erzielte, 29 und haben auch festgestellt, dass Hypothermie das therapeutische Zeitfenster für die Verabreichung von mesenchymalen Stammzellen auf bis zu 2 Tage nach dem hypoxisch-ischämischen Ereignis erweitert.,Darüber hinaus können Stammzellen die Immunantwort durch ihre Wechselwirkungen mit Effektorimmunzellen regulieren, die sich in vom Gehirn entfernten Organen wie der Milz befinden, deren Mobilisierung bekanntermaßen das Potenzial hat, die Entzündungsreaktion und ischämische Schädigung im unreifen Gehirn zu verschlimmern, wodurch ihre neuroprotektive Wirkung verstärkt wird.,31,32
Die Stammzelltherapie allein oder in Kombination mit therapeutischer Hypothermie ist ein vielversprechendes Forschungsfeld, das noch klinische Studien erfordert, um unter anderem die effektivste Art von Stammzellen und die optimale Dosierung und Dauer der Behandlung zu bestimmen, um die bestmöglichen Behandlungsergebnisse zu erzielen.,28 Eines der derzeit laufenden Projekte in der Rekrutierungsphase (Studie an hCT-MSC bei Neugeborenen mit mittelschwerem oder schwerem HIE, NCT03635450) umfasst 6 Säuglinge, die im Gestationsalter von 36 oder mehr Wochen mit mittelschwerem bis schwerem HIE geboren wurden, um mit Hypothermie behandelt zu werden, und 2 intravenöse Dosen mesenchymaler Stromazellen aus Nabelschnurgewebe (hCT-MSC). Die Hauptziele dieser phase-I-Studie zur Bewertung der Sicherheit von hCT-MSC und analysieren das überleben und die neurologische Entwicklungsstörungen, die Ergebnisse im Teilnehmer bei der 6 und 16 Monaten, beziehungsweise., Eine weitere Phase-I-Studie (NCT00593242) erzielte vielversprechende Ergebnisse mit der autologen Transplantation von Nabelschnurblutzellen, wobei 74% der Neugeborenen, die Stammzellen erhielten, mit Werten von 85 oder höher in den Bayley-Skalen überlebten 41% der Neugeborenen, die allein mit Kühlung behandelt wurden.33
N-Acetylcystein
N-Acetylcystein (NAC) ist ein Vorläufer von Cystein,das freie Radikale abfängt und an der Glutathionerhaltung beteiligt ist, 34 reguliert so oxidativen Stress., Beweise aus Tiermodellen zeigten eine stärkere Reduktion des zerebralen Infarkt-Volumen in der die Tiere behandelt mit einer Kombination aus NAC und Hypothermie im Vergleich zu behandelten Tiere mit nur einer von diesen Eingriffen. Darüber hinaus zeigten Tiere, die mit einer Kombinationstherapie behandelt wurden, ähnliche Ergebnisse bei Reflexen und Schäden an der weißen Substanz als in der Kontrollgruppe.35 Da seine Verabreichung während der Schwangerschaft keine teratogenen Wirkungen hat und die Plazenta überqueren kann,gilt 36 NAC als eines der vielversprechendsten Therapeutika für die zukünftige Anwendung auf Neugeborenen-Intensivstationen., Nach unserem Wissen wurden jedoch bisher keine klinischen Studien entwickelt, um seine Verwendung bei der Behandlung von HIE zu bewerten, und die verfügbaren Beweise beschränken sich auf Studien im Zusammenhang mit intraamniotischen Entzündungen, Chorioamnionitis oder Atemnotsyndrom.
Edelgase
Edelgase wie Xenon und Radon haben neuroprotektive Wirkungen in Tiermodellen von Neugeborenen-HI gezeigt. Zahlreiche Studien haben die Möglichkeit der Verwendung von Xenon als Therapeutikum analysiert (eine Überprüfung der Beweise finden Sie im Artikel von Lobo et al.,37) aufgrund seiner Fähigkeit, die Exzitotoxizität nach einer HI-Beleidigung durch die Modulation von NMDA-Glutamatrezeptoren zu reduzieren.38,39
Die multizentrische klinische Studie Total Body hypothermia plus Xenon (TOBY-Xe) verwendete Xenongas in Kombination mit Hypothermie in einer Stichprobe von 92 Säuglingen, die zwischen 36 und 43 Schwangerschaftswochen geboren wurden., Obwohl keine signifikanten Unterschiede zwischen den Gruppen festgestellt wurden, 40 Mit dem Ziel, detailliertere Informationen über einige der Variablen zu erhalten, die sich möglicherweise auf die Behandlungsergebnisse mit diesem Edelgas ausgewirkt haben, wie z. B. Dosierung oder Dauer, ist derzeit eine klinische Phase-II-Studie im Gange (CoolXenon3-Studie, NCT02071394).,
Auf der anderen Seite gab es bisher keine klinischen Studien mit Argon, aber es wurde gezeigt, dass Argon die Kühlergebnisse in Bezug auf die Spiegel des N-Acetyl-Aspartat/Lactat-Markers verbessert, was mit einem Anstieg der durchschnittlichen Zelltodwerte und der Entwicklung neurologischer Folgen bei betroffenen Neugeborenen in Verbindung gebracht wurde.41 Diese vielversprechenden Ergebnisse, zusammen mit seiner höheren Bioverfügbarkeit und geringeren Kosten im Vergleich zu Xenon, machen Argon zu einem Molekül mit einem hohen Potenzial für eine Translation von Bett zu Bett bei der Behandlung von HIE.,
Schlussfolgerungen
Eine wirksame Behandlung für HIE zu erreichen, ist eine der großen Herausforderungen der modernen Medizin. Aus diesem Grund werden seit Jahren erhebliche Anstrengungen unternommen, um die Mechanismen zu analysieren, die nach perinataler Asphyxie zu Hirnzellschäden führen, mit dem Ziel, wirksame Behandlungen zu entwickeln, um sie zu blockieren. Gegenwärtig versuchen Kinderärzte und Neurowissenschaftler, neue Verbindungen zu entwickeln, die in Synergie mit Hypothermie wirken könnten, um die neurologischen Folgen von HIE auf ein Minimum zu reduzieren., Auf der anderen Seite haben neuere Studien begonnen, das Geschlecht unter die Variablen aufzunehmen, die bei der Behandlung von HIE zu berücksichtigen sind, da dimorphe sexuelle Unterschiede sowohl in den Verletzungsmechanismen gefunden wurden (in experimentellen Modellen zeigten weibliche Tiere größere Gedächtnisdefizite, während männliche Tiere eine größere Anfälligkeit für oxidativen Stress zeigten) und in den Wegen der verschiedenen betrachteten Behandlungen., Trotz der vielversprechenden Fortschritte bei der Verwendung von Melatonin oder Verbindungen wie EPO sind noch präklinische Studien erforderlich, um die Wirkmechanismen dieser Moleküle weiter aufzuklären, und klinische Studien mit größeren Proben sind erforderlich, um die optimale Dosierung und den optimalen Verabreichungsweg dieser und anderer Behandlungen zu bestimmen.
Förderung
Die Studie wurde durch ein Stipendium der UPV/EHU im Rahmen des Forschungsgruppenförderprogramms der Universität (GIU 17/018) unterstützt.
Interessenkonflikte
Die Autoren haben keine Interessenkonflikte zu erklären.