10.6: estructuras de celosía en sólidos cristalinos
células unitarias de metales
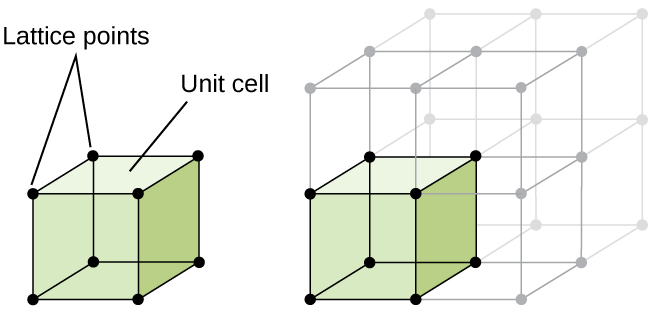
la estructura de un sólido cristalino, ya sea un metal o no, se describe mejor considerando su unidad repetitiva más simple, que se conoce como su célula unitaria. La célula unitaria consiste en puntos de celosía que representan las ubicaciones de átomos o iones. Toda la estructura consiste entonces en esta celda unitaria que se repite en tres dimensiones, como se ilustra en la figura \(\PageIndex{1}\).,
comencemos nuestra investigación de la estructura de celosía cristalina y las células unitarias con la estructura más directa y la célula unitaria más básica. Para visualizar esto, imagine tomar un gran número de esferas idénticas, como pelotas de tenis, y colocarlas uniformemente en un recipiente., La forma más sencilla de hacer esto sería hacer capas en las que las esferas de una capa están directamente por encima de las de la capa de abajo, como se ilustra en la figura \(\PageIndex{2}\). Esta disposición se llama estructura cúbica simple, y la célula unitaria se llama célula unitaria cúbica simple o célula unitaria cúbica primitiva.
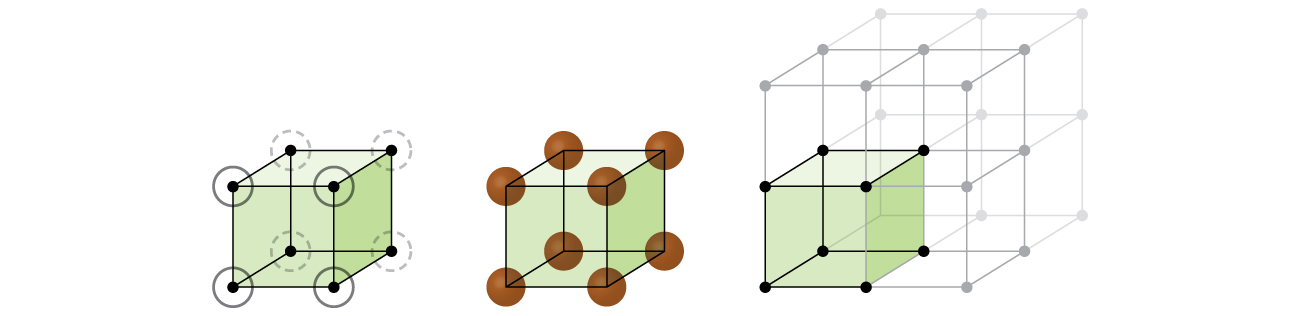
en una estructura cúbica simple, las esferas no están empaquetadas tan cerca como podrían estar, y solo» llenan » alrededor del 52% del volumen del contenedor. Este es un arreglo relativamente ineficiente, y solo un metal (Polonio, Po) cristaliza en una estructura cúbica simple. Como se muestra en la figura \(\PageIndex{3}\), un sólido con este tipo de disposición consiste en planos (o capas) en los que cada átomo contacta solo con los cuatro vecinos más cercanos en su capa; un átomo directamente encima de él en la capa superior; y un átomo directamente debajo de él en la capa inferior., El número de otras partículas que cada partícula en un sólido cristalino entra en contacto se conoce como su número de coordinación. Para un átomo de polonio en una matriz cúbica simple, el número de coordinación es, por lo tanto, seis.

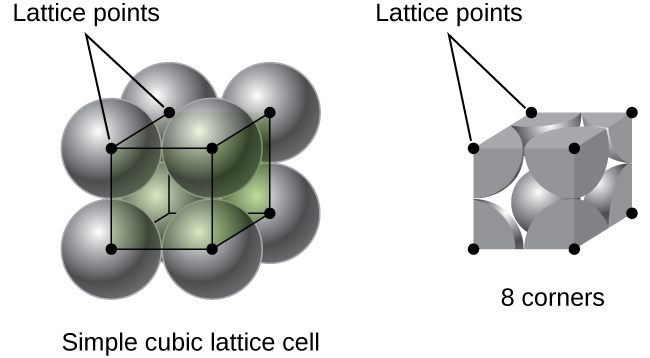
en una red cúbica simple, la celda unidad que se repite en todas las direcciones es un cubo definido por los centros de ocho átomos, como se muestra en la figura \(\PageIndex{4}\). Los átomos en las esquinas adyacentes de esta célula unidad entran en contacto entre sí, por lo que la longitud del borde de esta célula es igual a dos radios atómicos, o un diámetro atómico. Una célula unitaria cúbica contiene solo las partes de estos átomos que están dentro de ella. Dado que un átomo en una esquina de una célula unitaria cúbica SIMPLE está contenido por un total de ocho células unitarias, solo una octava parte de ese átomo está dentro de una célula unitaria específica., Y dado que cada célula de unidad cúbica simple tiene un átomo en cada una de sus ocho «esquinas», hay \(8×\dfrac{1}{8}=1\) átomo dentro de una celda de unidad cúbica simple.
La mayoría de los cristales metálicos son uno de los cuatro tipos principales de células unitarias., Por ahora, nos centraremos en las tres células unitarias cúbicas: cúbica simple (que ya hemos visto), célula unitaria cúbica centrada en el cuerpo y célula unitaria cúbica centrada en la cara, todas las cuales se ilustran en la figura \(\PageIndex{5}\). (Tenga en cuenta que en realidad hay siete sistemas de celosía diferentes, algunos de los cuales tienen más de un tipo de celosía, para un total de 14 tipos diferentes de celdas unitarias. Dejamos las geometrías más complicadas para más adelante en este módulo.,)
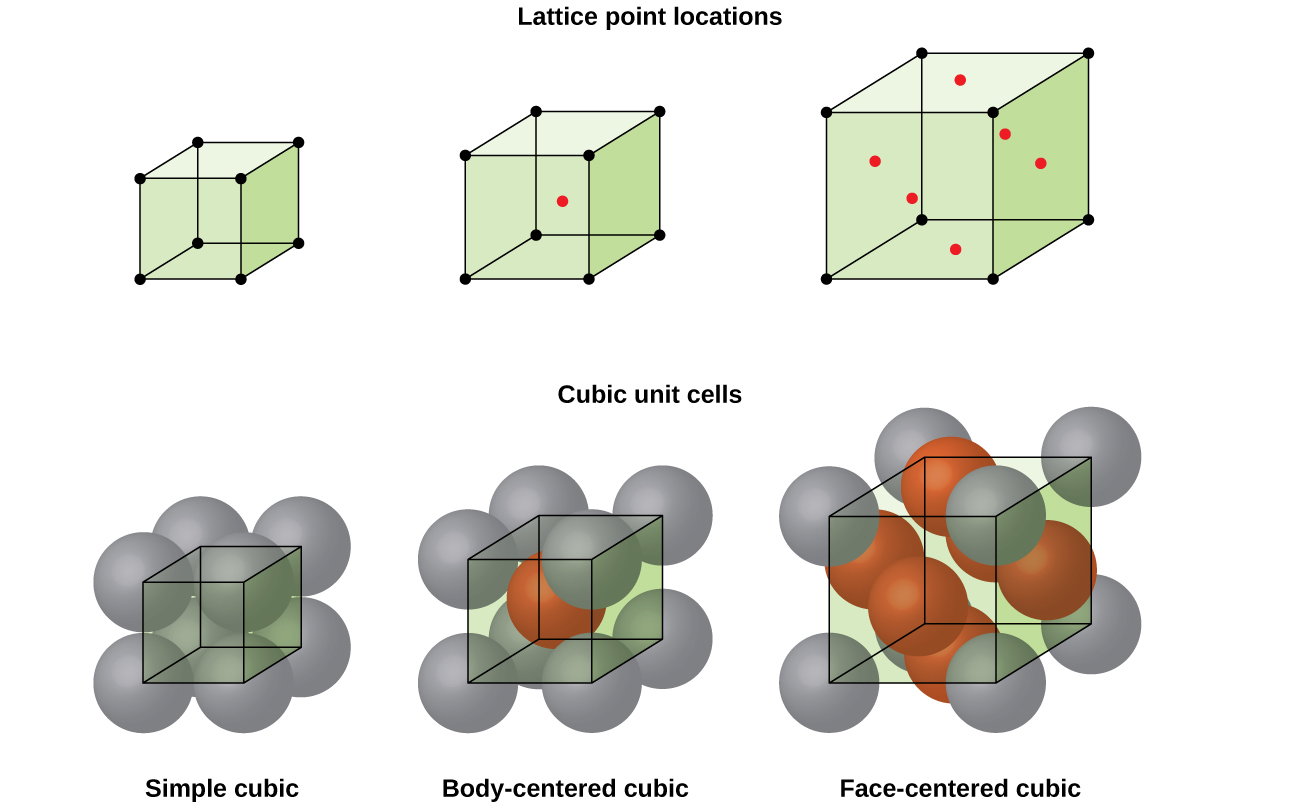
algunos metales cristalizan en una disposición que tiene una celda de unidad cúbica con átomos en todas las esquinas y un átomo en el centro, como se muestra en la figura \(\PageIndex{6}\). Esto se denomina sólido cúbico centrado en el cuerpo (CCB)., Los átomos en las esquinas de una célula unitaria BCC no entran en contacto entre sí, sino que entran en contacto con el átomo en el centro. Una célula unidad BCC contiene dos átomos: un octavo de un átomo en cada una de las ocho esquinas (\(8×\dfrac{1}{8}=1\) átomo de las esquinas) más un átomo del centro. Cualquier átomo en esta estructura toca cuatro átomos en la capa superior y cuatro átomos en la capa inferior. Por lo tanto, un átomo en una estructura BCC tiene un número de coordinación de ocho.,
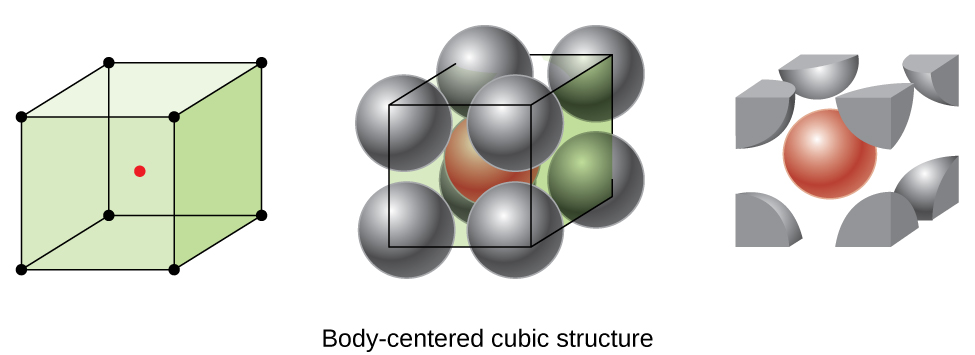
Los átomos en los arreglos BCC se empaquetan de manera mucho más eficiente que en una estructura cúbica simple, ocupando aproximadamente el 68% del volumen total. Los metales isomorfos con una estructura BCC incluyen K, Ba, Cr, Mo, W y Fe a temperatura ambiente., (Se dice que los elementos o compuestos que cristalizan con la misma estructura son isomorfos.)
muchos otros metales, como el aluminio, el cobre y el plomo, cristalizan en una disposición que tiene una celda de unidad cúbica con átomos en todas las esquinas y en los centros de cada cara, como se ilustra en la figura \(\PageIndex{7}\). Esta disposición se denomina sólido cúbico centrado en la cara (FCC)., Una célula unitaria FCC contiene cuatro átomos: un octavo de un átomo en cada una de las ocho esquinas (\(8×\dfrac{1}{8}=1\) átomo de las esquinas) y la mitad de un átomo en cada una de las seis caras (\(6×\dfrac{1}{2}=3\) átomos de las caras). Los átomos en las esquinas tocan los átomos en los centros de las caras adyacentes a lo largo de las diagonales de la cara del cubo. Debido a que los átomos están en puntos de celosía idénticos, tienen entornos idénticos.
Los átomos en una disposición FCC se empaquetan lo más juntos posible, con átomos ocupando el 74% del volumen., Esta estructura también se llama cubic closest packing (CCP). En CCP, hay tres capas repetitivas de átomos dispuestos hexagonalmente. Cada átomo de contactos seis átomos en su propia capa, tres en la capa superior, y tres en la capa de abajo. En esta disposición, cada átomo toca 12 vecinos cercanos, y por lo tanto tiene un número de coordinación de 12. El hecho de que los acuerdos FCC y CCP sean equivalentes puede no ser inmediatamente obvio, pero por qué son realmente la misma estructura se ilustra en la figura \(\PageIndex{8}\).,
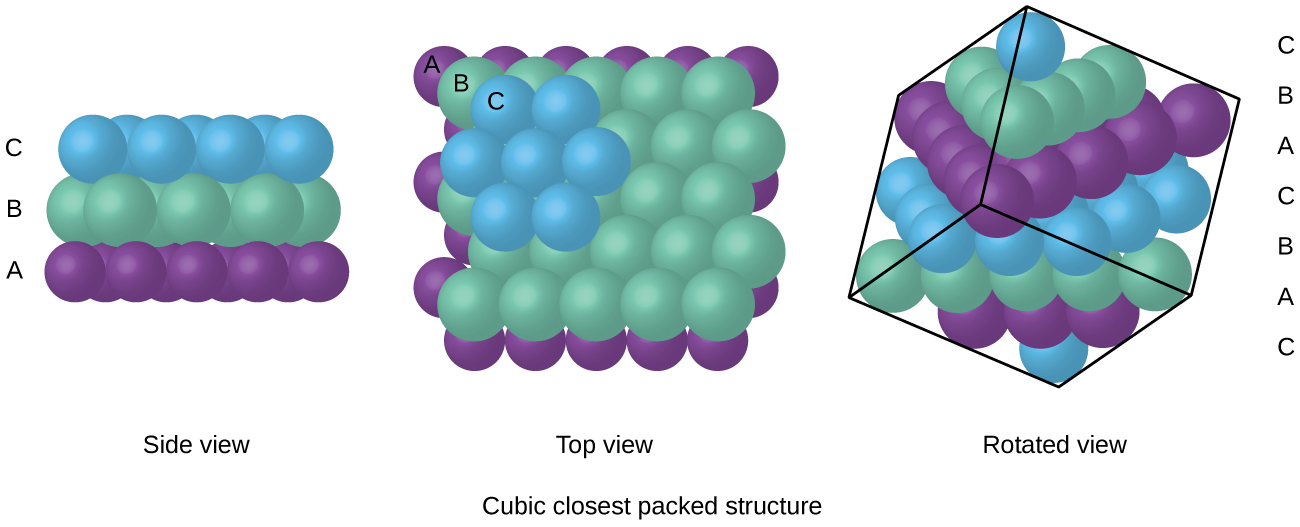
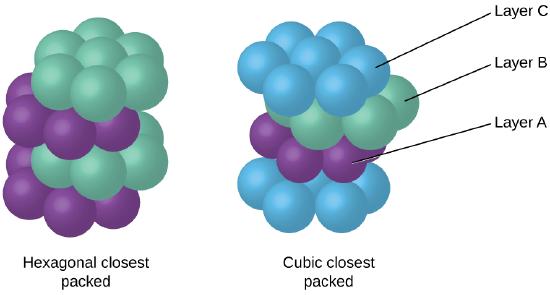
debido a que el empaque más cercano maximiza las atracciones generales entre los átomos y minimiza la energía intermolecular total, los átomos en la mayoría de los metales se empaquetan de esta manera., Encontramos dos tipos de empaque más cercano en estructuras cristalinas metálicas simples: CCP, que ya hemos encontrado, y el empaque más cercano hexagonal (HCP) que se muestra en la figura \(\PageIndex{9}\). Ambos consisten en capas repetitivas de átomos dispuestos hexagonalmente. En ambos tipos, una segunda capa (B) se coloca en la primera capa (a) de modo que cada átomo en la segunda capa está en contacto con tres átomos en la primera capa. La tercera capa se coloca de una de dos maneras. En HCP, los átomos en la tercera capa están directamente por encima de los átomos en la primera capa (I. e.,, la tercera capa también es de tipo A), y el apilamiento consiste en alternar capas de tipo A y tipo B (es decir, ABABAB⋯). En CCP, los átomos en la tercera capa no están por encima de los átomos en ninguna de las dos primeras capas (es decir, la tercera capa es de tipo C), y el apilamiento consiste en alternar capas de tipo A, Tipo B y tipo C (es decir, ABCABCABC⋯). Alrededor de dos tercios de todos los metales cristalizan en matrices más cercanas con números de coordinación de 12., Los metales que cristalizan en una estructura de HCP incluyen Cd, Co, Li, Mg, Na y Zn, y los metales que cristalizan en una estructura de CCP incluyen Ag, Al, Ca, Cu, Ni, Pb y Pt.
ejercicio \(\PageIndex{2}\)
La Plata cristaliza en una estructura FCC. La longitud del borde de su celda unitaria es de 409 pm.
- ¿Cuál es el radio atómico de Ag en esta estructura?
- calcular la densidad de Ag.
respuesta a
144 pm
respuesta B
10.5 g/cm3
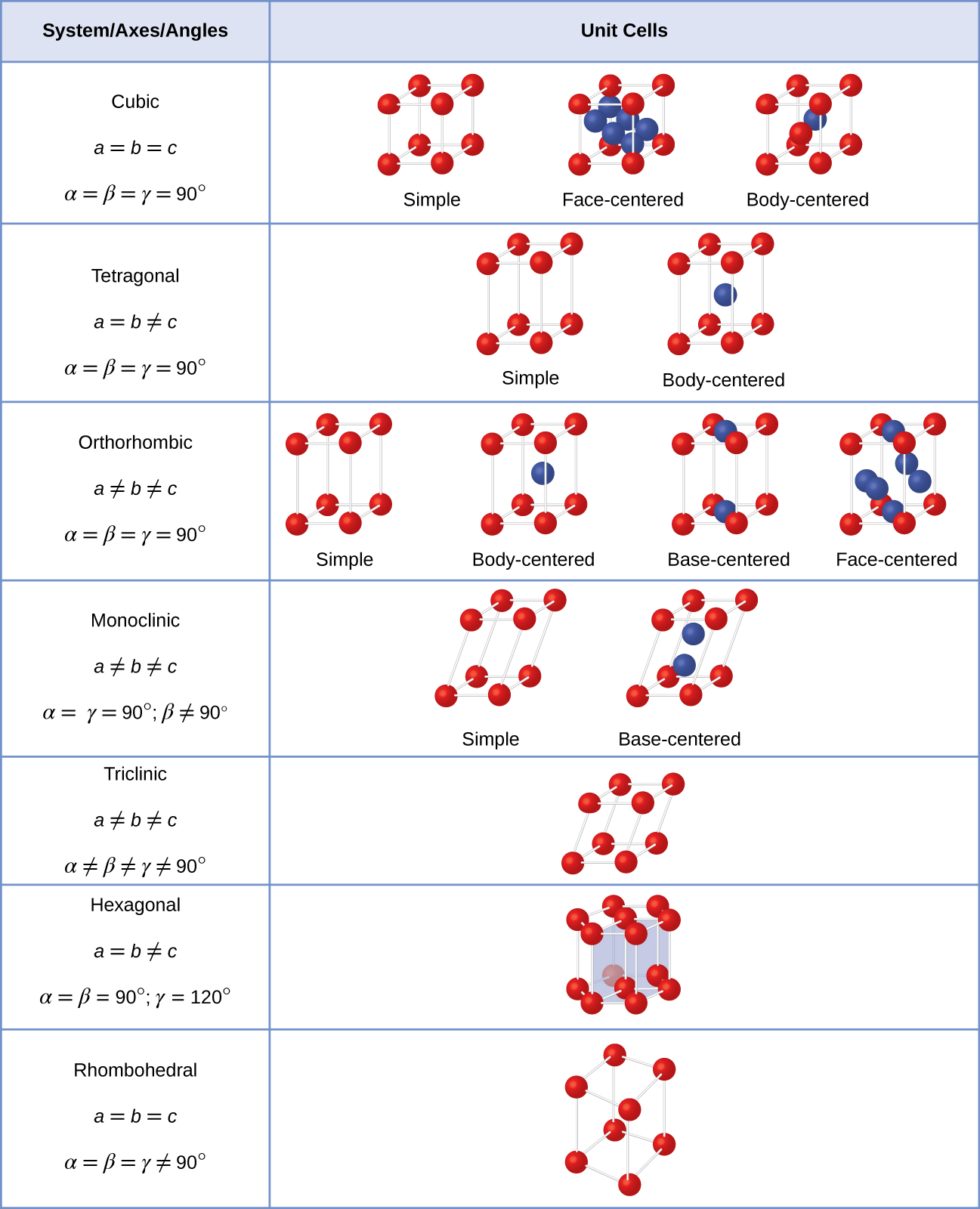
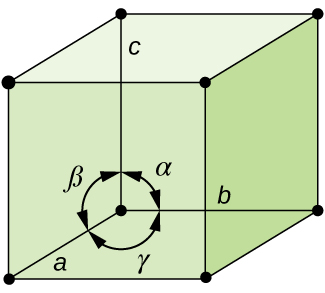
en general, una celda unitaria se define por las longitudes de tres ejes (a, b y c) y los ángulos (α, β y γ) entre ellos, como se ilustra en la figura \(\PageIndex{10}\)., Los ejes se definen como las longitudes entre los puntos en la red espacial. En consecuencia, los ejes de célula unitaria unen puntos con ambientes idénticos.
hay siete sistemas de celosía diferentes, algunos de los cuales tienen más de un tipo de celosía, para un total de catorce celdas unitarias diferentes, que tienen las formas mostradas en la figura \(\PageIndex{11}\).