6.3: Absolute Configuration and the (R) and (S) System (Español)
Absolute Configurations of Perspective Formulas
Los químicos necesitan una forma conveniente de distinguir un estereoisómero de otro. El sistema Cahn-Ingold-Prelog es un conjunto de reglas que nos permite definir inequívocamente la configuración estereoquímica de cualquier estereocentro, utilizando las designaciones » R ‘(del latín rectus, que significa diestro) o » S ‘ (del latín siniestro, que significa zurdo).,
las reglas para este sistema de nomenclatura estereoquímica son, en la superficie, bastante simples.
reglas para asignar una designación R/S a un centro quiral
1: asigne prioridades a los cuatro sustituyentes, siendo #1 la prioridad más alta y #4 la más baja. Las prioridades se basan en el número atómico.
2: traza un círculo de #1 a #2 a #3.
3: determinar la orientación del grupo de prioridad # 4. Si está orientada en el plano de la página (lejos de ti), vaya al paso 4a. Si está orientada hacia fuera del plano de la página (hacia usted) vaya al paso 4b.,
4a: (#4 grupo apuntando lejos de ti): un círculo en sentido horario en la parte 2 corresponde a la configuración R, mientras que un círculo en sentido antihorario corresponde a la configuración S.
4b: (#4 grupo apuntando hacia usted): un círculo en sentido horario en la parte 2 corresponde a la configuración S, mientras que un círculo en sentido antihorario corresponde a la configuración R.
usaremos el gliceraldehído de azúcar de 3 carbonos como nuestro primer ejemplo. Lo primero que debemos hacer es asignar una prioridad a cada uno de los cuatro sustituyentes ligados al centro quiral., Primero observamos los átomos que están unidos directamente al centro quiral: estos son H, O (en el hidroxilo), C (En el aldehído) y C (En el grupo CH2OH).
asignar la configuración R / s al gliceraldehído:

dos prioridades son fáciles: el hidrógeno, con un número atómico de 1, es la prioridad MÁS BAJA (#4), y el hidroxil oxígeno, con número atómico 8, es la prioridad #1. El carbono tiene un número atómico de 6. ¿Cuál de los dos grupos ‘C’ es la prioridad # 2, el aldehído o el CH2OH?, Para determinar esto, movemos un enlace más lejos del centro quiral: para el aldehído tenemos un enlace doble a un oxígeno, mientras que en el grupo CH2OH tenemos un enlace simple a un oxígeno. Si el átomo es el mismo, los enlaces dobles tienen una prioridad MÁS ALTA que los enlaces simples. Por lo tanto, al grupo aldehído se le asigna la prioridad #2 y al grupo CH2OH la prioridad #3.
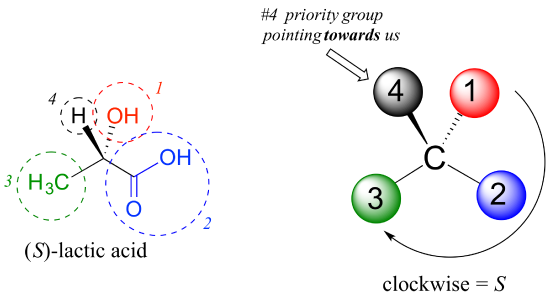
con nuestras prioridades asignadas, miramos a continuación al grupo de prioridades #4 (El hidrógeno) y vemos que está apuntando hacia atrás, hacia el plano de la página, por lo que se aplica el paso 4a del procedimiento anterior., Luego, trazamos un círculo definido por los grupos prioritarios #1, #2 y #3, en orden creciente. El círculo es en el sentido de las agujas del reloj, que por el paso 4a nos dice que este carbono tiene la configuración ‘R’, y que esta molécula es (R)-gliceraldehído. Su enantiómero, por definición, debe ser (S)-gliceraldehído.
a continuación, veamos uno de los enantiómeros del ácido láctico y determinemos la configuración del centro quiral. Claramente, H es el sustituyente # 4 Y OH ES #1. Debido a sus tres enlaces al oxígeno, el carbono en el grupo ácido toma Prioridad #2, y el grupo metilo toma #3., El Grupo # 4, hidrógeno, pasa a ser dibujado apuntando hacia nosotros (fuera del plano de la página) en esta figura, por lo que usamos el paso 4b: el círculo trazado de #1 a #2 a #3 es en el sentido de las agujas del reloj, lo que significa que el centro quiral tiene la configuración S.
el medicamento talidomida es un estudio de caso interesante, pero trágico, en la importancia de la estereoquímica en el diseño de medicamentos., Fabricada por primera vez por una compañía farmacéutica alemana y prescrita ampliamente en Europa y Australia a finales de la década de 1950 como sedante y remedio para las náuseas matutinas en mujeres embarazadas, la talidomida pronto fue implicada como la causa de defectos de nacimiento devastadores en bebés nacidos de mujeres que la habían tomado. La talidomida contiene un centro quiral, y por lo tanto existe en dos formas enantioméricas. Se comercializó como una mezcla racémica:en otras palabras, una mezcla 50: 50 de ambos enantiómeros.
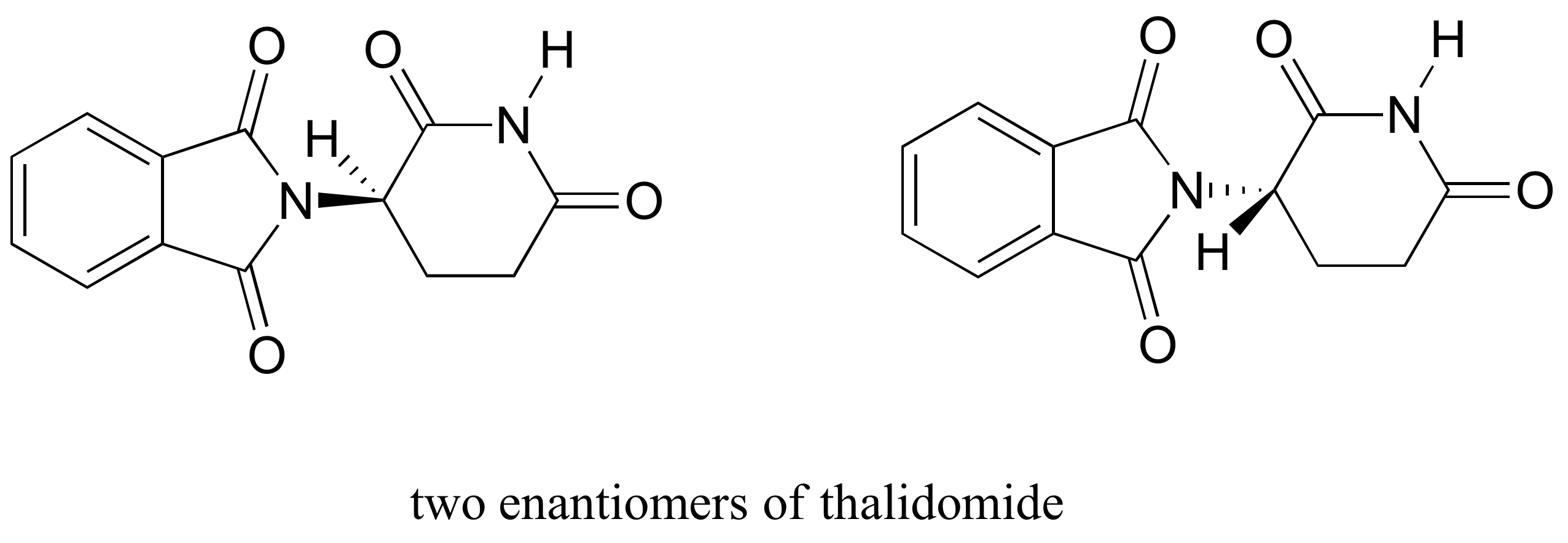
intentemos determinar la configuración estereoquímica del enantiómero de la izquierda., De los cuatro enlaces al centro quiral, la prioridad # 4 es el hidrógeno. El grupo nitrógeno es #1, el lado carbonilo del anillo es #2, y el lado-CH2 del anillo es #3.
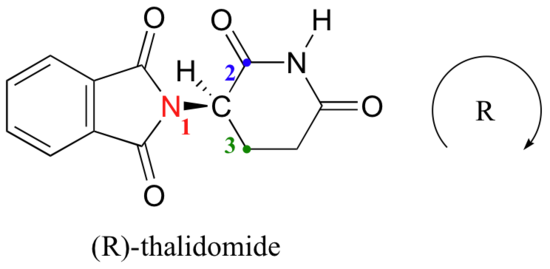
El hidrógeno se muestra apuntando lejos de nosotros, y los sustituyentes priorizados trazan un círculo en el sentido de las agujas del reloj: Este es el enantiómero R de talidomida. El otro enantiómero, por supuesto, debe tener la configuración S.,
aunque los científicos todavía no están seguros de cómo funciona la talidomida, la evidencia experimental sugiere que en realidad fue el enantiómero R el que tuvo los efectos médicos deseados, mientras que el enantiómero S causó los defectos de nacimiento. Incluso con este conocimiento, sin embargo, la talidomida pura (r) no es segura, porque las enzimas en el cuerpo se convierten rápidamente entre los dos enantiómeros, veremos cómo sucede en el capítulo 12.
como nota histórica, la talidomida nunca fue aprobada para su uso en los Estados Unidos. Esto fue gracias en gran parte a los esfuerzos del Dr., Frances Kelsey, una Oficial de alimentos y medicamentos que, en peligro para su carrera, bloqueó su aprobación debido a su preocupación por la falta de estudios de seguridad adecuados, particularmente con respecto a la capacidad del medicamento para ingresar al torrente sanguíneo de un feto en desarrollo. Desafortunadamente, sin embargo, en ese momento los ensayos clínicos de nuevos medicamentos involucraron una distribución generalizada y no regulada a los médicos y sus pacientes en todo el país, por lo que las familias en los Estados Unidos no se salvaron del daño causado.,
recientemente, un derivado cercano de la talidomida se ha vuelto legal para recetar nuevamente en los Estados Unidos, con estrictas medidas de seguridad aplicadas, para el tratamiento de una forma de cáncer de la sangre llamado mieloma múltiple. En Brasil, la talidomida se usa en el tratamiento de la lepra, pero a pesar de las medidas de seguridad, los niños todavía nacen con defectos relacionados con la talidomida.
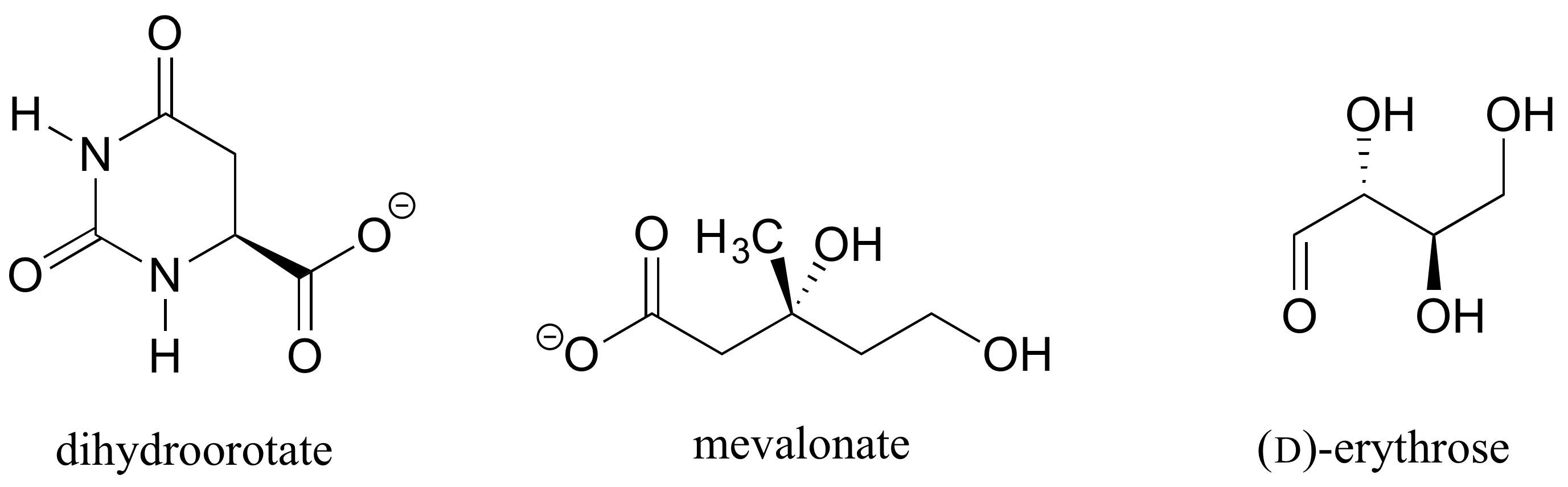
Ejercicio 1.: Determinar las configuraciones estereoquímicas de los centros quirales en las biomoléculas que se muestran a continuación.
el Ejercicio 2.,: ¿Debería el enantiómero (R) de malato tener una cuña sólida o punteada para el enlace C-O en la figura de abajo?
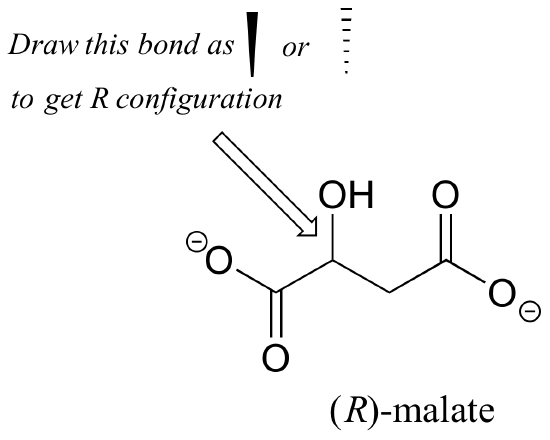
Ejercicio 3.: Usando cuñas sólidas o discontinuas para mostrar estereoquímica, dibuje el enantiómero (R) de ibuprofeno y el enantiómero (S) de 2-metileritritol-4-fosfato (las estructuras se muestran anteriormente en este capítulo sin estereoquímica).
soluciones para ejercicios
configuraciones absolutas de proyecciones de Fischer
para determinar la configuración absoluta de un centro quiral en una proyección de Fisher, utilice el siguiente procedimiento en dos pasos.,
Paso 1
asigne números de prioridad a los cuatro ligandos (grupos) unidos al centro quiral utilizando el sistema de prioridad CIP.
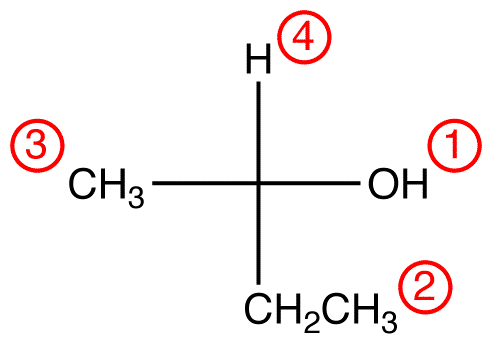
Paso 2 – opción vertical
Si el ligando de menor prioridad está en un enlace Vertical, entonces está apuntando lejos del visor.
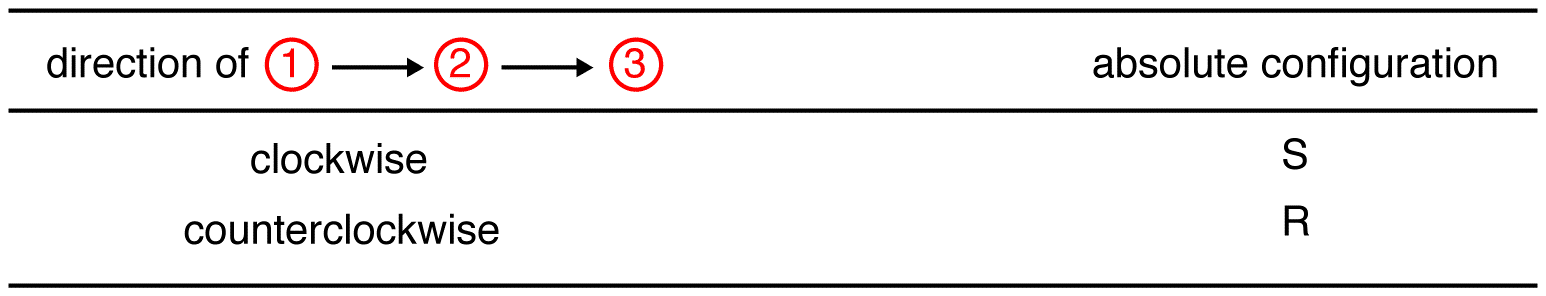
Trace los tres ligandos de mayor prioridad comenzando por el ligando de mayor prioridad ( ① → ② → ③ ) en la dirección que dará una respuesta muy correcta.

en el compuesto de abajo, el movimiento es en el sentido de las agujas del reloj indicando una configuración R., El nombre completo de la IUPAC para este compuesto es (R)-butan-2-ol.

Paso 2-opción horizontal
Si el ligando de menor prioridad está en un enlace Horizontal, entonces está apuntando hacia el visor.
Trace los tres ligandos de mayor prioridad comenzando en el ligando de mayor prioridad ( ① → ② → ③ ) en la dirección que dará una respuesta horriblemente equivocada. Tenga en cuenta en la tabla siguiente que las configuraciones se invierten desde el primer ejemplo.,
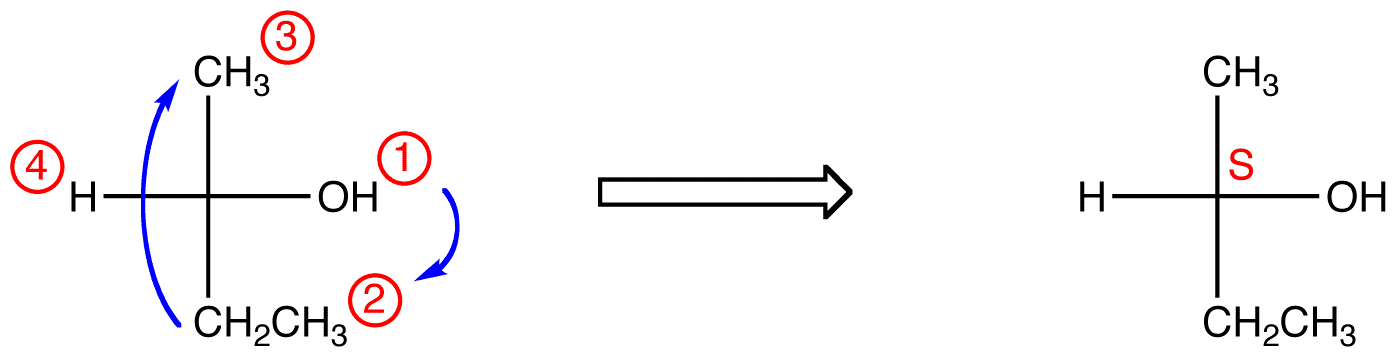
en el compuesto a continuación, el movimiento es en el sentido de las agujas del Reloj (R), Lo que es terriblemente incorrecto, por lo que la configuración real es S. El nombre completo de la IUPAC para este compuesto es (S)-butan-2-ol.
manipular las proyecciones de Fischer sin cambiar la configuración
Una proyección de Fischer restringe una molécula tridimensional en dos dimensiones. En consecuencia, hay limitaciones en cuanto a las operaciones que se pueden realizar en una proyección de Fischer sin cambiar la configuración absoluta en los centros quirales., Las operaciones que no cambian la configuración absoluta en un centro quiral en proyecciones de Fischer se pueden resumir en dos reglas.
Regla 1: La rotación de la proyección de Fischer en 180º en cualquier dirección Sin levantarla del plano del papel no cambia la configuración absoluta en el centro quiral.
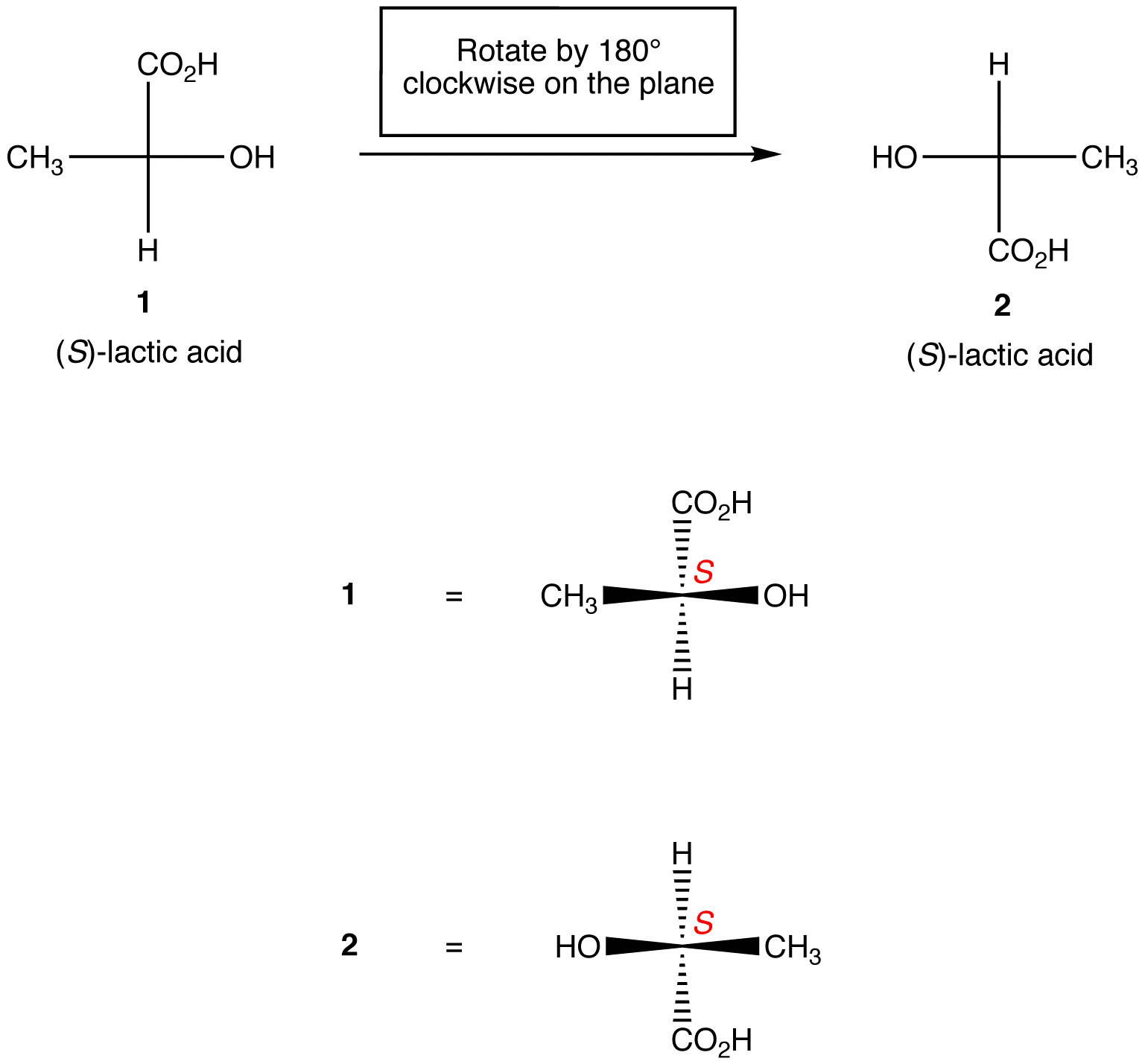
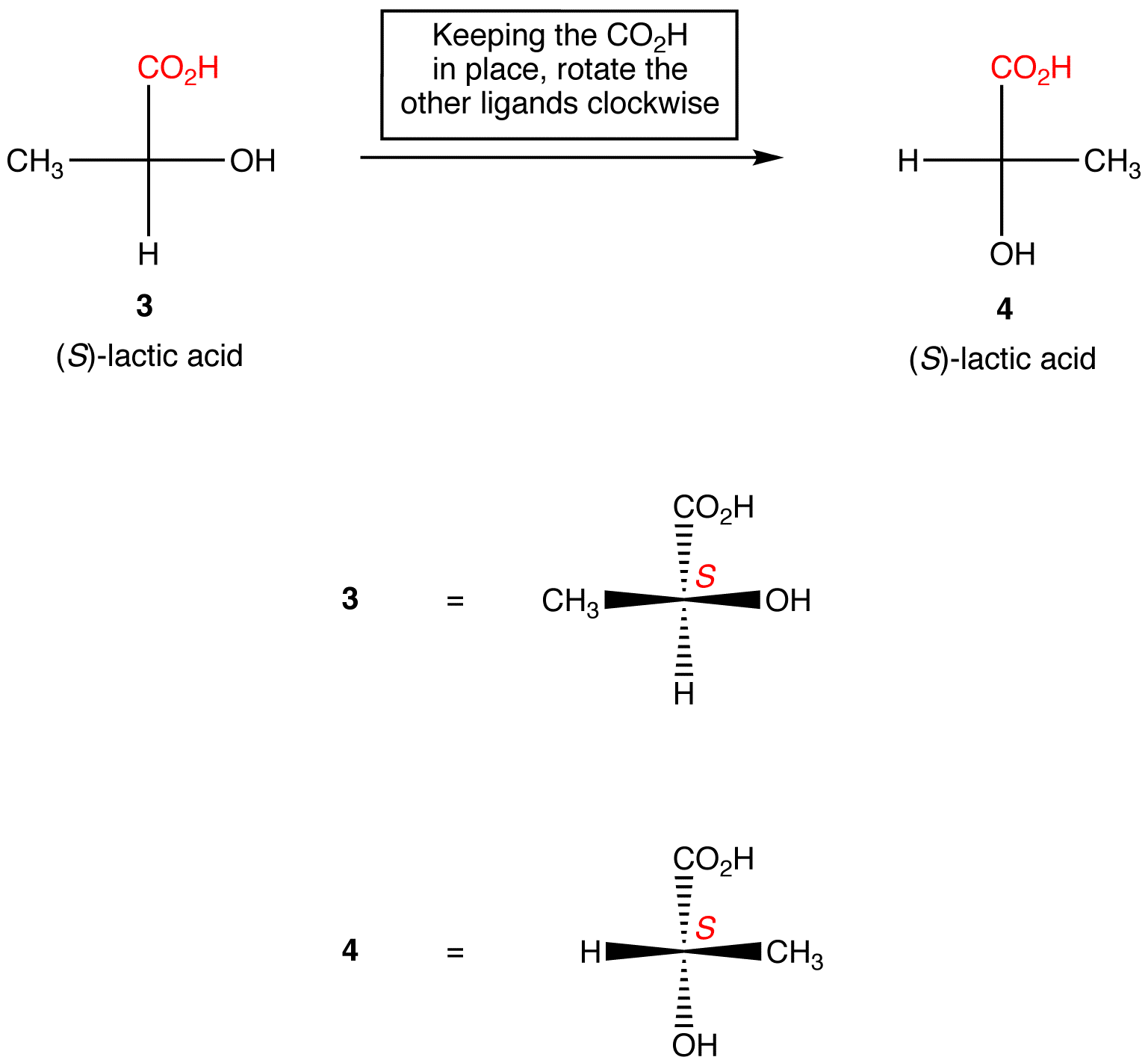
Regla 2: La rotación de tres ligandos en el centro quiral en cualquier dirección, manteniendo el ligando restante en su lugar, no cambia la configuración absoluta en el centro quiral.,
manipular las proyecciones de Fischer con cambio de Configuración
Las operaciones que cambian la configuración absoluta en un centro quiral en una proyección de Fischer se pueden resumir en dos reglas.
Regla 1: La rotación de la proyección de Fischer en 90º en cualquier dirección cambia la configuración absoluta en el centro quiral.
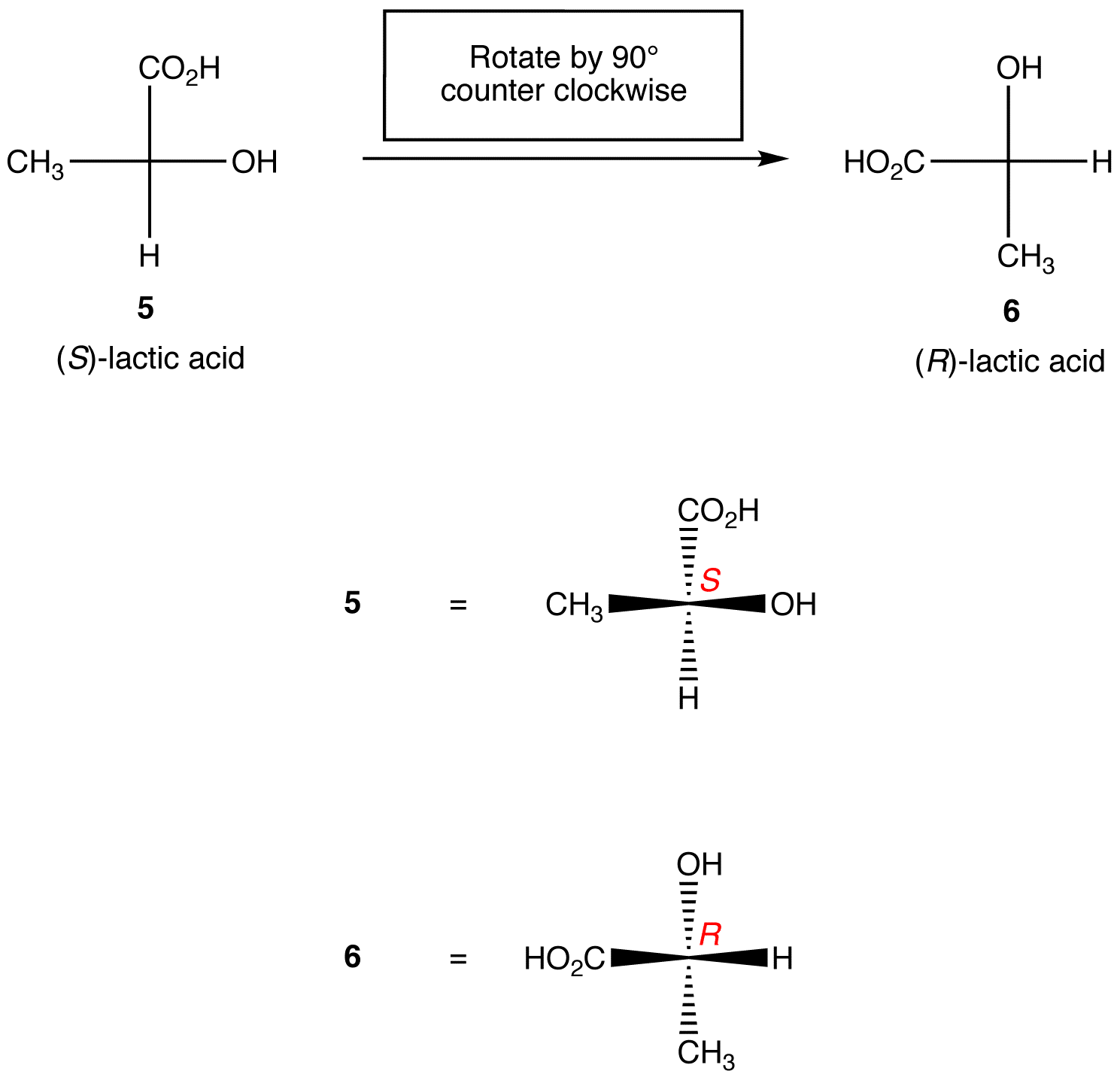
Regla 2: Intercambiar dos ligandos cualesquiera en el centro quiral cambia la configuración absoluta en el centro quiral.,
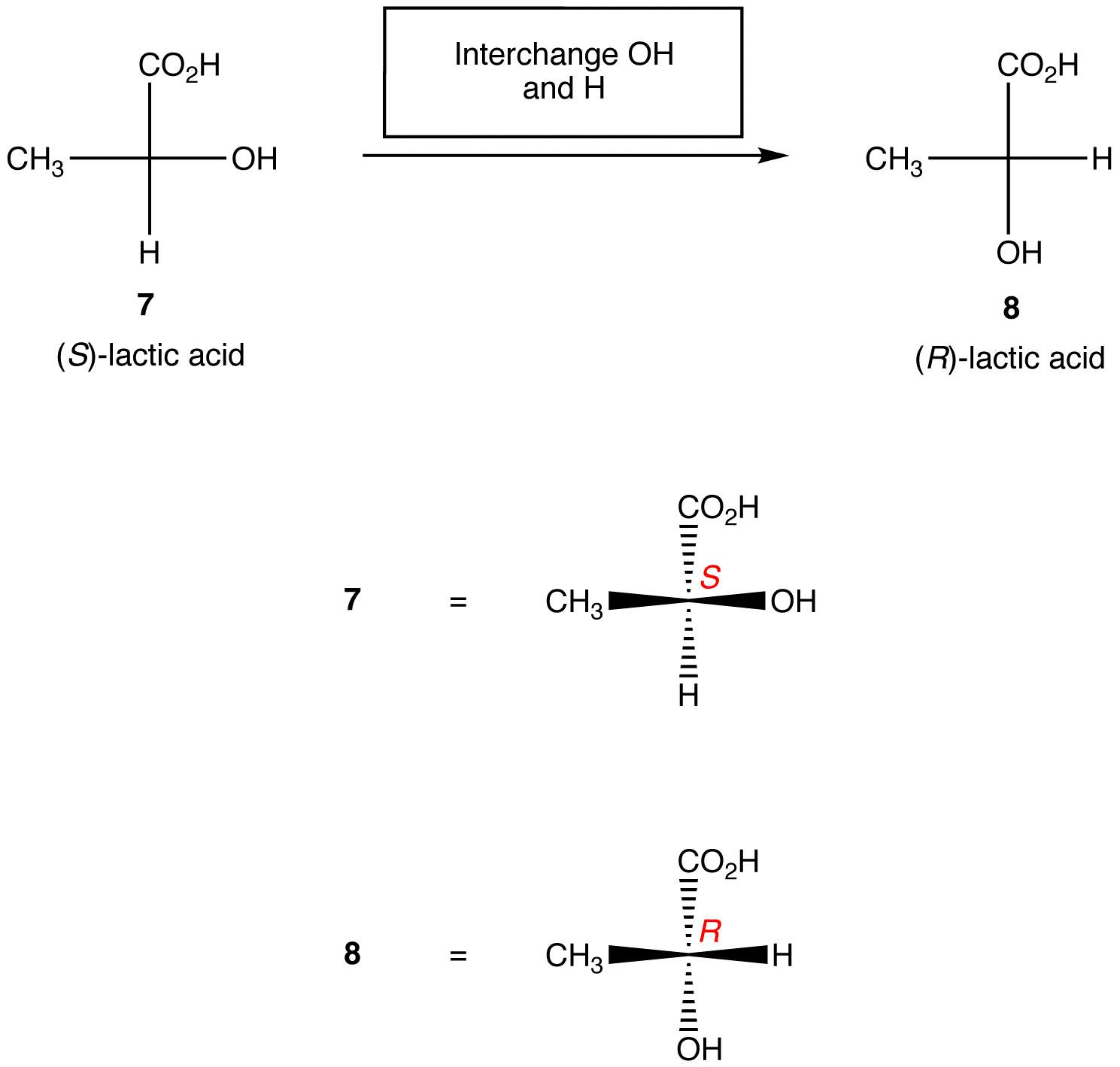
Las reglas anteriores asumen que la proyección de Fischer bajo consideración contiene solo un centro quiral. Sin embargo, con cuidado, se pueden aplicar a las proyecciones de Fischer que contienen cualquier número de centros quirales.
Ejercicio 1
Clasifique los siguientes compuestos como R o S?
Solución
- S: I > Br > F > H. El sustituyente de menor prioridad, H, ya se va hacia la parte de atrás., Gira a la izquierda yendo de I A Br A F, por lo que»s A S.
- R: Br > Cl > CH3 > H. tienes que cambiar la H y la Br para colocar la H, la prioridad MÁS BAJA, en la parte posterior. Luego, yendo de Br a Cl, CH3 gira a la derecha, dándole una R.
- ni R Ni S: esta molécula es aquiral. Sólo las moléculas quirales puede ser denominado R o S.
- R: OH > CN > CH2NH2, > H. La H, la prioridad más baja, tiene que ser cambiado a la espalda., Entonces, ir de OH CN, CH2NH2, usted está dando vuelta a la derecha, dándole un R.
- (5) S: \(\ce{-COOH}\) > \(\ce{-CH_2OH}\) > \(\ce{C#CH}\) > \(\ce{H}\). Entonces, yendo de \(\ce {- COOH}\) a \(\ce{-CH_2OH}\) a \(\ce{-C#CH}\) usted está girando a la izquierda, dándole una configuración S.
Ejercicios
6. Oriente lo siguiente para que el átomo de menor prioridad (4) esté retrasado, luego asigne estereoquímica (R O S).

7. Draw (R)-2-bromobutan-2-ol.
8., Asigne R / S a la siguiente molécula.
.png?revision=1)
Soluciones

A = S; B = R
8. El centro estéreo es R.
otros recursos
Kahn Academy video tutorial sobre el sistema de nomenclatura R-S
- Schore y Vollhardt. Estructura y función de la química orgánica. New York: W. H. Freeman and Company, 2007.McMurry, John y Simanek, Eric. Fundamentos de Química Orgánica. 6th Ed. Brooks Cole, 2006.,
colaboradores y atribuciones
- Ekta Patel (UCD), Ifemayowa Aworanti (University of Maryland Baltimore County)
- química orgánica con énfasis biológico por Tim Soderberg (University of Minnesota, Morris)