Terapia combinada en encefalopatía hipóxico-isquémica neonatal | Anales de Pediatría
Introducción
con una incidencia de 1-3 casos por 1000 nacimientos a término,1 la encefalopatía hipóxico-isquémica (EIH) es una de las causas más frecuentes de daño cerebral en recién nacidos. Teniendo en cuenta el creciente número de partos de alto riesgo debido a las tendencias crecientes en la edad materna y en la frecuencia de embarazos múltiples, entre otros factores, la Ehi sigue siendo un problema relevante en el ámbito hospitalario para el que aún no existe una solución definitiva.,
La investigación sobre la fisiopatología de la asfixia perinatal nos ha permitido comprender el complejo proceso que tiene lugar a nivel celular y tisular a medida que se desarrolla el daño cerebral debido a la falta de oxígeno. Muchos de los mecanismos de lesión involucrados se agrupan en función del tiempo transcurrido hasta su desarrollo, y se han descrito 4 fases principales (Fig. 1): fase primaria, o episodio agudo de isquemia hipóxica (HI), fase latente, fase secundaria y fase terciaria., En la fase primaria, el daño proviene de una reducción en el suministro de oxígeno a las células y tejidos, lo que resulta en una falla de energía primaria. Esto es seguido por una recuperación aparente en los niveles de compuestos fosforilados de alta energía, conocidos como la fase latente., Sin embargo, esta mejoría es solo temporal y da paso a la fase secundaria, en la que entran en juego Muchos de los mecanismos fisiopatológicos implicados en el desarrollo del daño cerebral en los recién nacidos, entre los que destacan la excitotoxicidad, la afluencia masiva de iones de calcio a las células, el estrés oxidativo, la inflamación y, en la mayoría de los casos, la muerte celular por necrosis o apoptosis. Por último, la fase terciaria se caracteriza por la persistencia del daño cerebral semanas, meses o incluso años después del insulto hipóxico-isquémico inicial.,
la comprensión de la fisiopatología subyacente de la EIH ha permitido la identificación de potenciales dianas terapéuticas que podrían ayudar a reducir el daño cerebral causado por asfixia y el desarrollo de numerosas estrategias de tratamiento. Algunos de estos tratamientos, actualmente en ensayos, están destinados a trabajar sinérgicamente con la hipotermia terapéutica, el único tratamiento contra la EIH que se ha adoptado generalmente en el entorno de cuidados intensivos neonatales.,
hipotermia
la hipotermia comenzó a utilizarse como estrategia neuroprotectora en lactantes tras el descubrimiento de un mecanismo de enfriamiento endógeno que se manifestaba en lactantes que habían sufrido algún tipo de lesión durante el parto.2 sus efectos neuroprotectores están relacionados principalmente con la disminución de la actividad metabólica del cerebro, del 5% con cada disminución de 1°C de la temperatura3,que modula algunas de las vías metabólicas dañinas desencadenadas por asfixia, que se resumen en la Fig. 2.
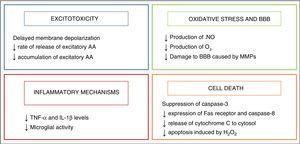
efecto de la hipotermia sobre los mecanismos de daño cerebral.
terapia combinada
dado que la evidencia sugiere que los protocolos actuales de hipotermia son optimales4 pero tienen una efectividad limitada en la práctica clínica5,necesitamos ampliar el arsenal terapéutico para el manejo de la EIH.,6 investigaciones recientes se han centrado en el desarrollo e implementación de tratamientos que pueden ser utilizados en combinación con la hipotermia, diseñados para actuar en diferentes niveles de la cascada fisiopatológica y promover la sinergia de ambas terapias (Fig. 3).

posibles dianas terapéuticas y principales estrategias neuroprotectoras actualmente sujetas a ensayos para el manejo de EIH neonatal.
melatonina
La melatonina (N-acetil-5-metoxitriptamina) es una neurohormona sintetizada por la glándula pineal cuya secreción sigue un ciclo noche/día y cuyo papel principal es regular el ritmo circadiano. Los aspectos clave que permiten su uso en el manejo de HIE son su potente actividad antioxidante y antiinflamatoria7 y su capacidad para cruzar la barrera hematoencefálica y llegar al sistema nervioso central.,8
antes de ser probado en recién nacidos, se ha demostrado que la melatonina aumenta el nivel de protección proporcionado por la hipotermia a través de la optimización del metabolismo energético cerebral en un modelo de asfixia en lechones.9 en el ámbito clínico, un estudio publicado por Aly et al.10 asignaron la mitad de los recién nacidos asfixiados a hipotermia y 5 dosis de 10mg/kg / día de melatonina administrada por vía oral., Los autores encontraron una reducción en los niveles séricos de superóxido dismutasa y óxido nítrico en los pacientes tratados con terapia combinada en comparación con los tratados con enfriamiento solo, demostrando así los efectos beneficiosos de la combinación de ambas estrategias contra el estrés oxidativo.
Un estudio reciente realizado por Balduini et al., para evaluar la seguridad, la farmacocinética, la dosis y la eficacia de la melatonina utilizada en combinación con hipotermia, se encontró que el enfriamiento no afectaba la farmacocinética de la melatonina11 y que era posible obtener niveles séricos elevados de la hormona que administraba dosis más bajas en comparación con las utilizadas en modelos animales experimentales. En la actualidad, el ensayo clínico MELPRO (NCT03806816) está reclutando pacientes, con el objetivo de una muestra de 100 recién nacidos., Este y otros estudios similares son indispensables para el desarrollo futuro de ensayos clínicos de fase III y el uso posterior de la melatonina en la práctica clínica diaria.
alopurinol
la razón para el uso de alopurinol en el manejo de HIE es su efecto inhibitorio sobre la xantina oxidasa, una enzima involucrada en el estrés oxidativo. Además, este medicamento actúa como quelante de hierro libre y secuestra los radicales hidroxilo.,12,13 un estudio preclínico en crías de rata en el que los animales se asignaron a 1 de los 5 grupos (Grupo control, grupo HI, grupo tratado con hipotermia, grupo tratado con alopurinol y grupo tratado con terapia de combinación) encontró que 72h después del insulto de HI, el grupo de terapia de combinación presentó el menor volumen de infarto.,14
cuando se trata de sus características farmacológicas, el alopurinol puede atravesar rápidamente la placenta y alcanzar concentraciones terapéuticas en recién nacidos, como se demostró en un estudio realizado en mujeres embarazadas que recibieron 500 mg de alopurinol por vía intravenosa, con evidencia de niveles óptimos de alopurinol 5min más tarde en muestras de sangre de cordón umbilical.15 un estudio realizado por van bel et al., en 1998 que analizó su potencial efecto antioxidante en recién nacidos asfixiados con EIH grave encontró que la administración intravenosa de 40mg/kg de alopurinol logró una reducción en la formación de radicales libres.13 Sin embargo, un estudio realizado posteriormente por Benders et al. en 2006 no se encontraron diferencias entre el grupo tratado con alopurinol y el grupo control.16 en las conclusiones, estos autores identificaron la extrema gravedad del Ehi en los recién nacidos incluidos en la muestra como una posible explicación para la falta de diferencias significativas., También plantearon la hipótesis de que el período transcurrido hasta la administración de alopurinol (3–4h después de la reperfusión) podría haber sido demasiado largo para lograr resultados favorables. En relación con este último punto, Gunes et al. administró la misma dosis de alopurinol que se administró en los 2 estudios anteriores, pero dentro de las 2 horas desde el nacimiento, y encontró mejoras en los resultados del neurodesarrollo en el grupo de tratamiento.,17 en la misma línea, la administración de alopurinol intravenoso a las madres durante el parto de fetos con hipoxia o hipoxia incipiente aumentó la eficacia del tratamiento, reduciendo los niveles en sangre del cordón umbilical de la proteína S-100β, que es un marcador de daño cerebral.Actualmente se está llevando a cabo un ensayo clínico denominado Effect of alopurinol for Hypoxic-ischemic Brain Injury on Neurocognitive Outcome (Nct03162653) para evaluar los posibles efectos terapéuticos de la administración de este inhibidor enzimático en los primeros minutos después del nacimiento.,
eritropoyetina
la eritropoyetina (EPO) es una citocina de 30,4 kDa sintetizada por el hígado durante la vida fetal y después del nacimiento por el riñón y el cerebro en desarrollo, donde actúa como factor de crecimiento y agente neuroprotector.19 el uso de EPO y EPO humana recombinante (rhEPO) en HIE se basa en su actividad, a través de la participación de los receptores EPO presentes en las neuronas y la glia20,como potente agente antiapoptótico (estimulante de la transcripción de los genes ANTIAPOPTÓTICOS BCL-2 y BCL-XL), y como antiinflamatorio y antioxidante.,19,21 además de su efecto neuroprotector, la EPO puede promover procesos de reparación a largo plazo, como la angiogénesis, oligodendrogénesis y neurogénesis.22,23
Los estudios preclínicos que han evaluado el efecto sinérgico de combinar la administración de EPO o rhEPO con hipotermia han arrojado resultados contradictorios. En un modelo similar de daño cerebral hipóxico-isquémico en ratas en el día 7 después del nacimiento, Fang et al. no se encontraron efectos neuroprotectores significativos de su uso combinado.24 Sin embargo, en otro estudio realizado por Fan et al.,, 25 los autores observaron un leve efecto beneficioso sobre la función sensoriomotora en las crías de rata, aunque esta diferencia no se reflejó en las características histológicas de las muestras de tejido cerebral.
Los estudios en recién nacidos con HIE han demostrado que el uso de rhEPO es seguro en dosis de 300-2500iu / kg. Dosis bajas de rhEPO se han encontrado eficaces en pacientes con daño moderado, y parecen estar asociados con un menor riesgo de discapacidad o muerte.26 dosis más altas (de hasta 2500 UI / kg) pueden reducir la incidencia de convulsiones y anomalías neurológicas a los 6 meses.,27
en la actualidad, se están llevando a cabo tres ensayos clínicos de fase III con un reclutamiento planificado de un total de 840 recién nacidos para evaluar la seguridad y eficacia de dosis altas de EPO (1000IU/kg) combinadas con hipotermia (eritropoyetina para la encefalopatía isquémica hipóxica en recién nacidos, nct03079167; eritropoyetina en dosis altas para la asfixia y la encefalopatía, nct02811263; eritropoyetina en el tratamiento de la hipoxia Neonatal encefalopatía isquémica, nct03163589). El objetivo principal de los primeros 2 es reducir la mortalidad o discapacidad a 2 años, mientras que el tercero evaluará estos dos resultados después de 1 año., Esperamos los resultados de estos y otros estudios para determinar si la EPO o alguno de sus derivados son eficaces y cómo deben utilizarse en la práctica clínica, valorando factores como la dosis mínima efectiva, la vía DE ADMINISTRACIÓN, La duración del tratamiento, etc.
células madre
el uso de células madre para el tratamiento de todo tipo de enfermedades, incluida la HIE, es un campo de investigación que continúa creciendo., Este enfoque terapéutico podría ayudar a reparar y regenerar el tejido cerebral dañado después del insulto hipóxico-isquémico a través de la interacción de células madre con células inmunes en órganos distantes del cerebro, como el bazo, alterando así la respuesta inmune/inflamatoria. Del mismo modo, la recuperación funcional lograda con su administración puede explicarse en parte por la interacción de las células trasplantadas y el tejido cerebral, con la consiguiente producción de factores de crecimiento cuyo efecto final se reflejaría en un aumento de la neurogénesis y la proliferación celular.,
aunque todavía necesitamos profundizar nuestros conocimientos para poder utilizar las células madre como terapia eficaz, estudios experimentales en animales han demostrado que diferentes tipos de células madre son capaces de sobrevivir en el cerebro dañado, diferenciarse en neuronas o glias, integrarse en el tejido diana y modificar favorablemente los resultados conductuales (revisado en Bennet et al.28)., Estudios recientes han reportado que la administración de células madre mesenquimales combinadas con 24 horas de enfriamiento en crías de rata 7 días después del nacimiento lograron mejores resultados en comparación con cualquiera de los tratamientos aislados29,y también han encontrado que la hipotermia amplía la ventana terapéutica de tiempo para la administración de células madre mesenquimales hasta 2 días después del evento hipóxico-isquémico.,30 Además, las células madre pueden regular la respuesta inmune a través de sus interacciones con células inmunes efectoras ubicadas en órganos distantes del cerebro, como el bazo, cuya movilización es conocida por tener el potencial de exacerbar la respuesta inflamatoria y el daño isquémico en el cerebro inmaduro, potenciando así su efecto neuroprotector.,31,32
la terapia con células madre, sola o en combinación con hipotermia terapéutica, es un campo de investigación prometedor que aún requiere ensayos clínicos para determinar, entre otros aspectos, el tipo más efectivo de células madre y la dosis y duración óptimas del tratamiento para obtener los mejores resultados posibles del tratamiento.,28 uno de los proyectos actualmente en curso en la fase de reclutamiento (Estudio de hCT-MSC en recién nacidos con eHi moderado o severo, NCT03635450) incluirá 6 bebés nacidos a una edad gestacional de 36 o más semanas con eHi moderado a severo para ser tratados con hipotermia y 2 dosis intravenosas de células estromales mesenquimales derivadas de tejido del cordón umbilical (hCT-MSC). Los principales objetivos de este ensayo de fase I son evaluar la seguridad del hCT-MSC y analizar los resultados de supervivencia y desarrollo neurológico en los participantes a los 6 y 16 meses, respectivamente., Otro ensayo de fase I (NCT00593242) obtuvo resultados prometedores con el trasplante autólogo de células sanguíneas del cordón umbilical, con 74% de los recién nacidos que recibieron células madre sobreviviendo con puntajes de 85 o más en las escalas de Bayley en comparación con 41% de los recién nacidos tratados con enfriamiento solo.33
N-acetilcisteína
la N-acetilcisteína (NAC) es un precursor de la cisteína que elimina los radicales libres e interviene en el mantenimiento del glutatión34,regulando así el estrés oxidativo., La evidencia de modelos animales mostró una mayor reducción en el volumen de infarto cerebral en animales tratados con una combinación de NAC e hipotermia en comparación con animales tratados con solo una de estas intervenciones. Además, los animales tratados con terapia combinada mostraron resultados similares en reflejos y daño a la sustancia blanca a los encontrados en el grupo control.35 dado que su administración durante el embarazo no tiene efectos teratogénicos y puede atravesar la placenta36,la NAC ha llegado a ser considerada como uno de los agentes terapéuticos más prometedores para su uso futuro en unidades de cuidados intensivos neonatales., Sin embargo, hasta la fecha no se han diseñado ensayos clínicos para evaluar su uso en el tratamiento de la EIH, y la evidencia disponible se limita a ensayos relacionados con inflamación intra-amniótica, corioamnionitis o síndrome de distrés respiratorio.
gases nobles
los gases nobles como el xenón y el radón han mostrado efectos neuroprotectores en modelos animales de HI neonatal. Numerosos estudios han analizado la posibilidad de utilizar xenón como agente terapéutico (para una revisión de la evidencia, ver el artículo de Lobo et al.,37) debido a su capacidad para reducir la excitotoxicidad después de un insulto HI a través de la modulación de los receptores de glutamato NMDA.
el ensayo clínico multicéntrico hipotermia corporal total más xenón (TOBY-Xe) utilizó gas xenón en combinación con hipotermia en una muestra de 92 niños nacidos entre las semanas 36 y 43 de gestación., Aunque no se encontraron diferencias significativas entre los grupos40, con el objetivo de obtener información más detallada sobre algunas de las variables que pueden haber influido en los resultados del tratamiento con este gas noble, como su dosis o duración, actualmente se está llevando a cabo un ensayo clínico en fase II (Estudio CoolXenon3, NCT02071394).,
por otro lado, no se han realizado ensayos clínicos de argón hasta la fecha, pero se ha demostrado que el argón mejora los resultados de enfriamiento en términos de los niveles del marcador N-acetil-aspartato/lactato, lo que se ha asociado con aumentos en los valores promedio de muerte celular y el desarrollo de secuelas neurológicas en recién nacidos afectados.41 estos resultados prometedores, junto con su mayor biodisponibilidad y menor costo en comparación con el xenón, hacen del argón una molécula con un alto potencial para la traducción de banco a cabecera en el tratamiento de HIE.,
conclusiones
lograr un tratamiento eficaz para la Ehi es uno de los grandes retos a los que se enfrenta la medicina moderna. Por esta razón, desde hace años se han realizado esfuerzos sustanciales para analizar los mecanismos que conducen al daño de las células cerebrales después de la asfixia perinatal con el objetivo de desarrollar tratamientos eficaces para bloquearlos. En la actualidad, pediatras y neurocientíficos están intentando desarrollar nuevos compuestos que puedan trabajar en sinergia con la hipotermia con el objetivo de reducir al mínimo las secuelas neurológicas de la EIH., Por otro lado, estudios recientes han comenzado a incluir el sexo entre las variables a tener en cuenta en el manejo de la EIH, ya que se han encontrado diferencias sexuales dimórficas tanto en los mecanismos de lesión (en modelos experimentales, las hembras han mostrado mayores déficits de memoria, mientras que los machos han mostrado mayor susceptibilidad al estrés oxidativo), como en las vías de los diferentes tratamientos considerados., A pesar de los prometedores avances realizados con el uso de melatonina o compuestos como la EPO, todavía se necesitan estudios preclínicos para dilucidar aún más los mecanismos de acción de estas moléculas, y se necesitan ensayos clínicos con muestras más grandes para determinar la dosis óptima y las vías de administración de estos y otros tratamientos.
financiación
el estudio ha contado con el apoyo de una beca concedida por la UPV / EHU en el marco del programa de financiación de grupos de investigación de la Universidad (GIU 17/018).
conflictos de intereses
los autores no tienen conflictos de intereses que declarar.