10.6: Ristikko Rakenteiden Kiteinen Kiintoaineiden
Yksikkö Solujen Metallien
rakenne, kiteinen kiinteä aine, onko metallia tai ei, on parhaiten kuvata tarkastelemalla sen yksinkertaisin toistuva yksikkö, joka on tarkoitettu niin sen yksikkö solu. Yksikkösolu koostuu hilapisteistä, jotka edustavat atomien tai ionien paikkoja. Koko rakenne sitten koostuu tämä yksikkö solu toistuva kolmiulotteisesti, kuten Kuvassa \(\PageIndex{1}\).,
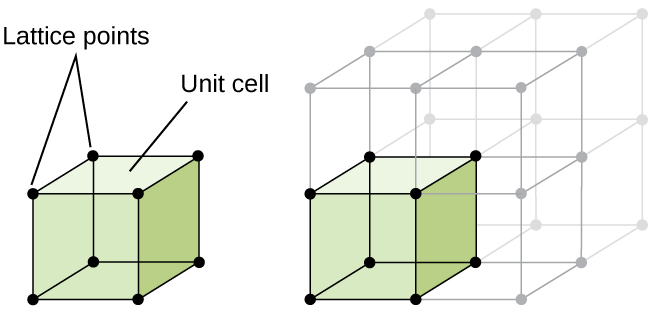
aloitetaan tutkinta kidehilan rakenne ja yksikön soluja, joilla on kaikkein yksinkertainen rakenne ja kaikkein perusyksikkö on solu. Visualisoida tämän, kuvitella, kun suuri määrä identtisiä aloilla, kuten tennispalloja, ja järjestää ne tasaisesti astiaan., Yksinkertaisin tapa tehdä tämä olisi tehdä kerroksia, jossa pallot yksi kerros on suoraan yläpuolella niille kerroksen alla, kuten Kuvassa \(\PageIndex{2}\). Tätä järjestelyä kutsutaan yksinkertaiseksi kuutiorakenteeksi, ja yksikkösoluksi kutsutaan yksinkertaista kuutioyksikkösolua tai primitiivistä kuutioyksikkösolua.
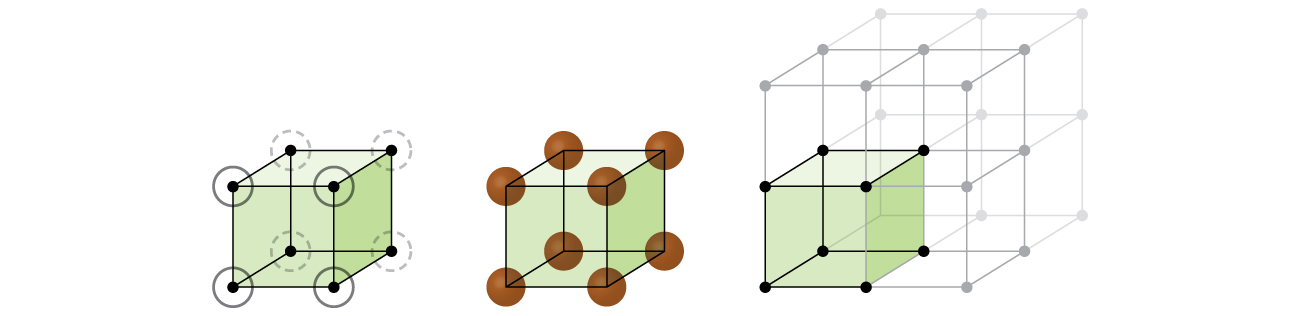
yksinkertainen kuutio rakenne, pallot eivät ole pakattu niin tiiviisti kuin ne voisivat olla, ja he vain ”täyttää” noin 52% säiliön tilavuus. Tämä on suhteellisen tehoton järjestely, ja vain yksi metalli (polonium, Po) kiteytyy yksinkertainen kuutio rakenne. Kuten Kuvassa \(\PageIndex{3}\), kiinteä tämän tyyppinen järjestely koostuu konetta (tai tasot), jossa jokainen atomi yhteystiedot vain neljä naapurit sen kerros; yksi atomi suoraan sen yläpuolella kerroksen yläpuolella, ja yksi atomi suoraan sen alapuolella kerroksen alla., Niiden muiden hiukkasten lukumäärä, jotka kukin hiukkanen on kiteisessä kiinteässä kontaktissa, tunnetaan sen koordinaatiolukuna. Yksinkertaisessa kuutioryhmässä poloniumatomille koordinaatioluku on siis kuusi.

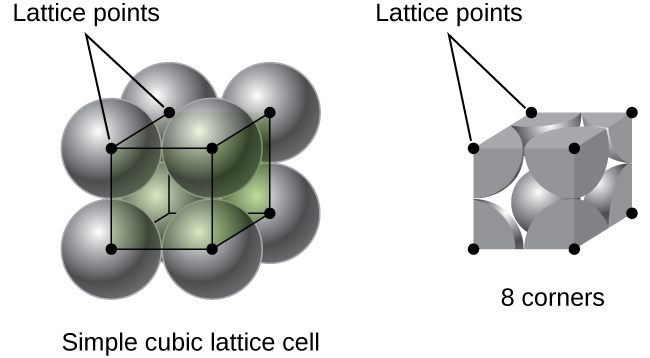
yksinkertainen cubic lattice, yksikkö solu, joka toistuu kaikissa suunnissa on kuutio määritelty keskuksia kahdeksan atomit, kuten Kuvassa \(\PageIndex{4}\). Atomien klo viereisen kulmat tämä yksikkö solu yhteyttä toisiinsa, niin reunan pituus tämä solu on yhtä suuri kuin kaksi atomic säteet, tai yhden atomin halkaisija. Kuutiollinen yksikkösolu sisältää vain näiden atomien osat, jotka ovat sen sisällä. Koska atomin kulmassa yksinkertainen kuutio yksikkö solu sisälsi yhteensä kahdeksan yksikön soluja, vain yksi kahdeksasosa, että atomi on tietyn yksikkö solu., Ja koska jokainen yksinkertainen kuutio yksikkö solu on yksi atomi sen kussakin kahdeksan ”kulmat” on \(8×\dfrac{1}{8}=1\) atomin sisällä yksi yksinkertainen kuutio yksikkö solu.
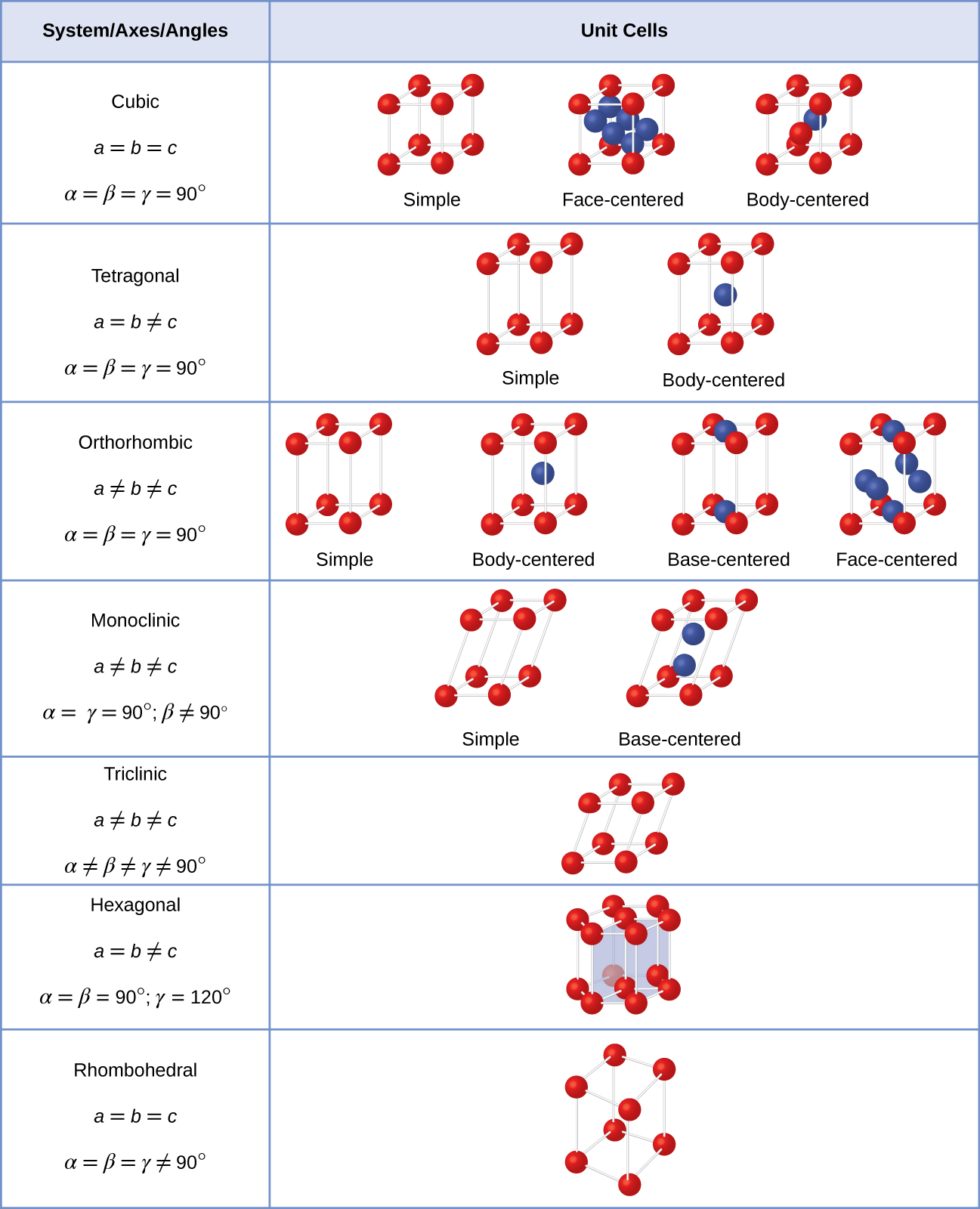
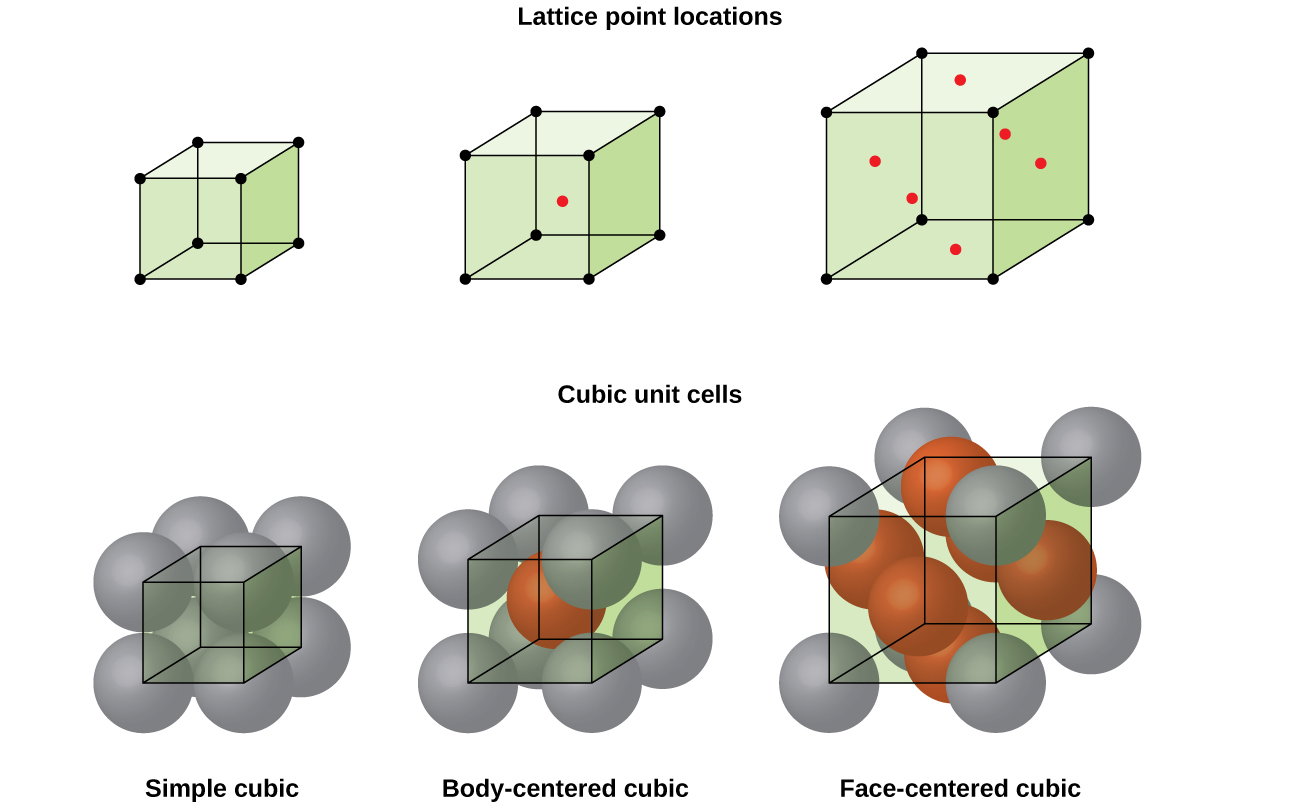
Useimmat metalli kiteitä ovat yksi neljästä päätyyppiä yksikön soluja., Nyt keskitymme kolme kuutiometriä yksikön soluja: simple cubic (jotka olemme jo nähneet), body-centered cubic yksikkö solu, ja face-centered cubic yksikkö solu—jotka kaikki on havainnollistettu Kuvassa \(\PageIndex{5}\). (Huomaa, että on olemassa seitsemän eri ristikko järjestelmiä, joista osa on enemmän kuin yksi tyyppi ristikko, yhteensä 14 eri yksikön soluja. Jätämme monimutkaisemmat geometriat myöhemmin tässä moduulissa.,)
Jotkut metallit kiteytyvät järjestely, joka on kuutio kiderakenne, jossa atomit kaikki kulmat ja atomin keskellä, kuten Kuvassa \(\PageIndex{6}\). Tätä kutsutaan korikeskeiseksi kuutioksi (BCC) kiinteäksi., BCC-yksikkösolun kulmissa olevat atomit eivät kosketa toisiaan, vaan ne koskettavat keskellä olevaa atomia. BCC-yksikkö solu sisältää kaksi atomia: yksi kahdeksasosa atom kussakin kahdeksan kulmat (\(8×\dfrac{1}{8}=1\) atom kulmat) sekä yksi atomi päässä keskustasta. Jokainen atomi tässä rakenteessa koskettaa neljää atomia sen yläpuolella olevassa kerroksessa ja neljää atomia sen alapuolella olevassa kerroksessa. Näin ollen BCC: n rakenteessa olevan atomin koordinaatioluku on kahdeksan.,
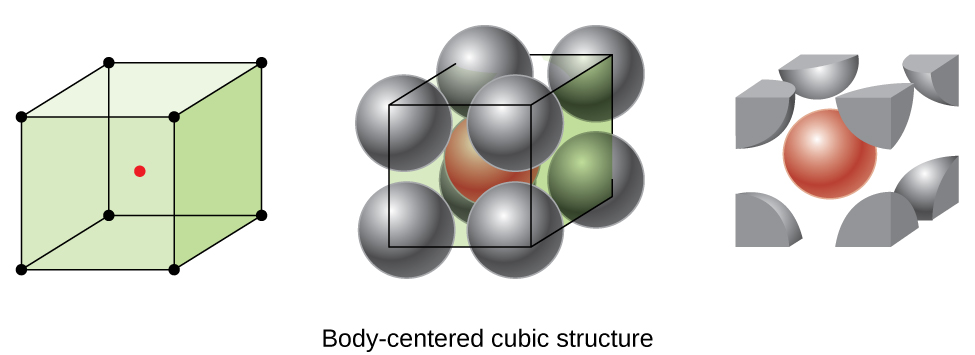
Atomien BCC järjestelyt ovat paljon tehokkaammin pakattu kuin yksinkertainen kuutio rakenne, miehittää noin 68% koko määrästä. Isomorfisia metalleja, joilla on BCC-rakenne, ovat k, Ba, Cr, Mo, W ja fe huoneenlämmössä., (Alkuaineiden tai yhdisteiden, jotka kiteytyvät samalla rakenteella, sanotaan olevan isomorfisia.)
Monet muut metallit, kuten alumiini, kupari ja lyijy, kiteytyä järjestely, joka on kuutio kiderakenne, jossa atomit kaikki kulmat ja keskuksissa kunkin kasvot, kuten Kuvassa \(\PageIndex{7}\). Tätä järjestelyä kutsutaan kasvokeskeiseksi kuutioksi (FCC) kiinteäksi., FCC-yksikön solu sisältää neljä atomia: yksi kahdeksasosa atom kussakin kahdeksan kulmat (\(8×\dfrac{1}{8}=1\) atom kulmat) ja puolet atomin kullakin kuusi kohtaa (\(6×\dfrac{1}{2}=3\) atomien kasvot). Kulmien atomit koskettavat vierekkäisten tahkojen keskuksissa olevia atomeja kuution kasvojen lävistäjiä pitkin. Koska atomit ovat identtisissä hilapisteissä, niillä on identtiset ympäristöt.
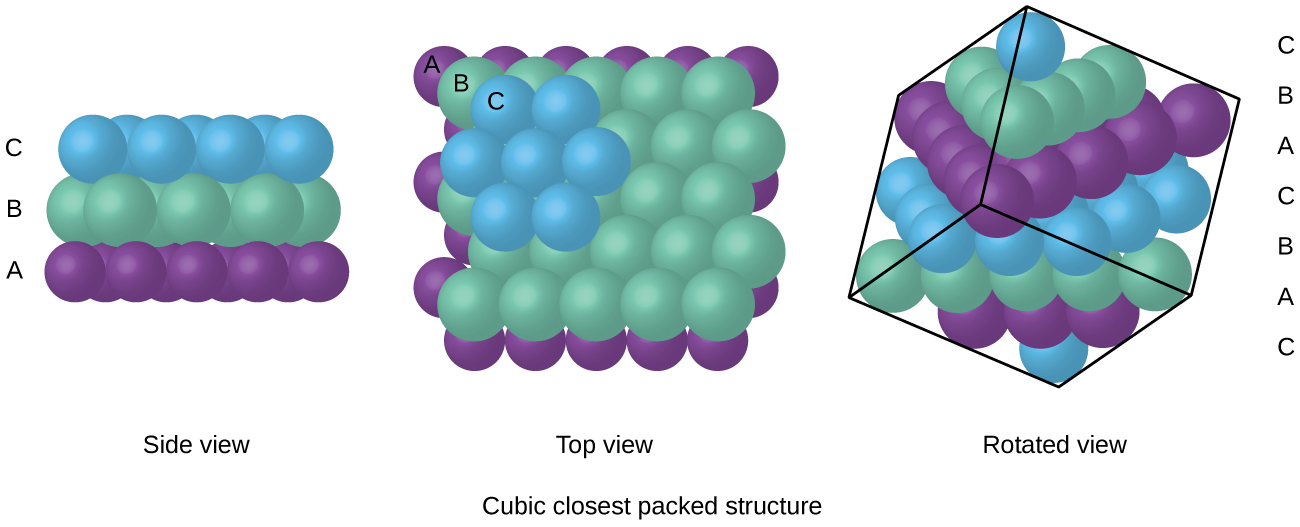
FCC-järjestelyssä olevat atomit pakataan mahdollisimman tiiviisti yhteen atomien ollessa 74% tilavuudesta., Tätä rakennetta kutsutaan myös kuutiollisimmaksi pakkaukseksi (CCP). CCP: ssä on kolme toistuvaa kerrosta heksagonaalisesti järjestyneitä atomeja. Jokainen atomi koskettaa kuusi atomia omassa kerroksessaan, kolme ylhäällä ja kolme alla olevassa kerroksessa. Tässä järjestely, jokainen atomi koskettaa 12 lähellä naapureita, ja siksi on koordinoinnin määrä 12. Se, että FCC: n ja keskusvastapuolen järjestelyt vastaavat toisiaan, ei välttämättä ole heti itsestään selvää, mutta miksi ne ovat todellisuudessa sama rakenne, käy ilmi kuviosta \(\PageIndex{8}\).,
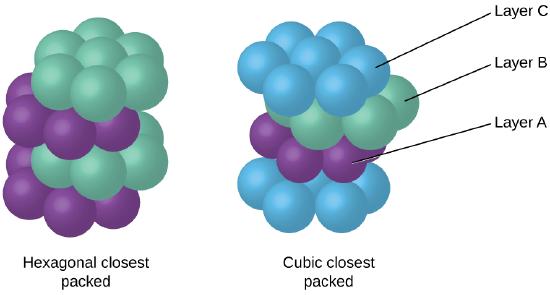
Koska lähempänä pakkaus maksimoi yleistä nähtävyyksiä atomien ja minimoi yhteensä molekyylien välisten energiaa, atomien useimmat metallit pack tällä tavalla., Löydämme kahdenlaisia lähinnä pakkaus yksinkertainen metallinen kiderakenteita: KESKUSVASTAPUOLEN, jonka olemme jo kohdanneet, ja kuusikulmainen lähinnä pakkaus (HCP) Kuvassa \(\PageIndex{9}\). Molemmat koostuvat toistuvista kuusikulmion järjestämien atomien kerroksista. Molemmissa tyypeissä ensimmäisen kerroksen (A) päälle asetetaan toinen kerros (B) siten, että toisen kerroksen jokainen atomi on kosketuksissa ensimmäisen kerroksen kolmen atomin kanssa. Kolmas kerros on sijoitettu kahdella tavalla. HCP: ssä kolmannen kerroksen atomit ovat suoraan ensimmäisen kerroksen atomien yläpuolella (ts., kolmas kerros on myös tyyppi A), ja pinoaminen koostuu vuorotellen A-tyypin ja B-tyypin close-pakattu kerroksia (esimerkiksi ABABAB⋯). Vuonna KESKUSVASTAPUOLEN, atomien kolmas kerros eivät ole edellä atomien joko ensimmäisen kaksi kerrosta (eli kolmas kerros on tyyppi C), ja pinoaminen koostuu vuorotellen A-tyypin, B-tyypin ja C-tyypin close-pakattu kerroksia (eli ABCABCABC⋯). Noin kaksi kolmasosaa kaikista metalleista kiteytyy lähimmäksi pakatuissa matriiseissa, joiden koordinaatioluvut ovat 12., Metallit, että kiteytyä vuonna HCP rakenne sisältää Cd -, Co -, Li -, Mg -, Na -, ja Zn -, ja metalleja, jotka kiteytyvät KESKUSVASTAPUOLEN rakenne ovat Ag, Al, Ca, Cu, Ni, Pb, ja Pt.
Harjoitus \(\PageIndex{2}\)
Hopea kiteytyy FCC-rakenne. Sen yksikkösolun reunapituus on 409 pm.
- Mikä on atomic säde Ag tämä rakenne?
- lasketaan Ag: n tiheys.
Vastata
144 pm.
Vastaus b
10.5 g/cm3
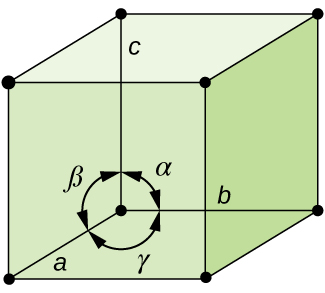
yleensä, yksikkö solu on määritelty pituudet kolme akselia (a -, b -, ja c) ja kulmat (α, β, ja γ) niiden välille, kuten Kuvassa \(\PageIndex{10}\)., Akselit määritellään avaruushilan pisteiden välisiksi pituuksiksi. Näin ollen yksikkökennoakselit yhtyvät pisteisiin identtisten ympäristöjen kanssa.
On olemassa seitsemän eri ristikko järjestelmiä, joista osa on enemmän kuin yksi tyyppi ristikko, yhteensä neljätoista eri yksikön soluja, joilla on muotoja Kuvassa \(\PageIndex{11}\).