10.6: Structures en réseau dans les solides cristallins
cellules unitaires des métaux
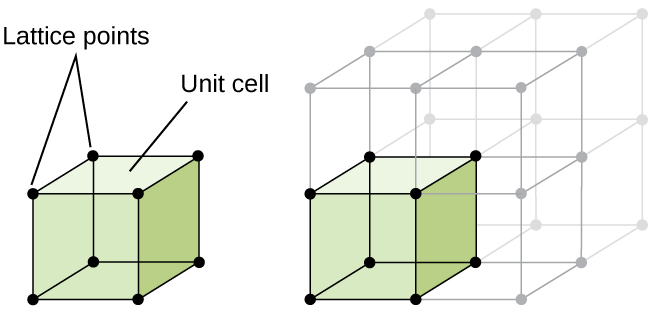
la structure d’un solide cristallin, qu’il soit métallique ou non, est mieux décrite en considérant son unité répétitive la plus simple, appelée cellule unitaire. La cellule unité se compose de points de réseau qui représentent les emplacements des atomes ou des ions. La structure entière est alors constituée de cette cellule unitaire se répétant en trois dimensions, comme illustré dans la Figure \(\PageIndex{1}\).,
commençons notre étude de la structure du réseau cristallin et des cellules unitaires avec la structure la plus simple et la cellule unitaire la plus basique. Pour visualiser cela, imaginez prendre un grand nombre de sphères identiques, telles que des balles de tennis, et les disposer uniformément dans un récipient., La façon la plus simple de le faire serait de créer des calques dans lesquels les sphères d’un calque sont directement au-dessus de celles du calque ci-dessous, comme illustré dans la Figure \(\PageIndex{2}\). Cet arrangement est appelé structure cubique simple, et la cellule unitaire est appelée cellule unitaire cubique simple ou cellule unitaire cubique primitive.
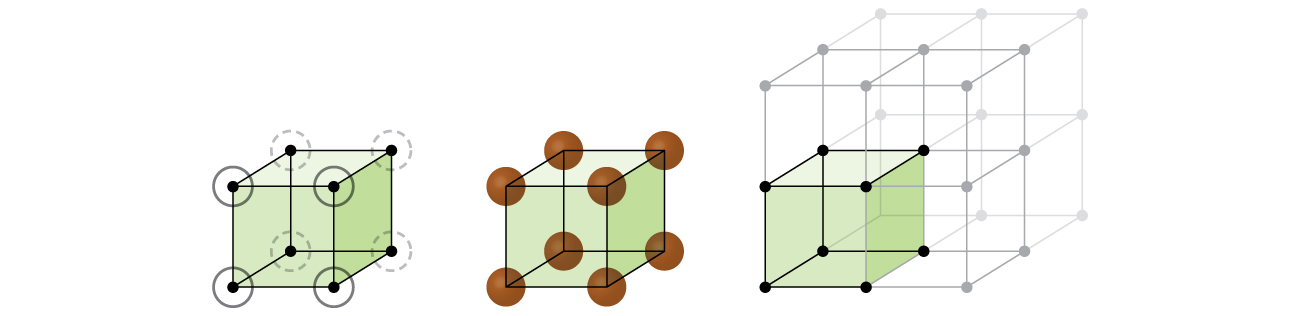
dans une structure cubique simple, les sphères ne sont pas emballées aussi étroitement qu’elles pourraient l’être, et elles ne « remplissent” qu’environ 52% du volume du conteneur. C’est un arrangement relativement inefficace, et un seul métal (polonium, Po) cristallise dans une structure cubique simple. Comme le montre la Figure \(\PageIndex{3}\), un solide avec ce type d’arrangement est constitué de plans (ou de couches) dans lesquels chaque atome ne contacte que les quatre voisins les plus proches de sa couche; un atome directement au-dessus dans la couche ci-dessus; et un atome directement en dessous dans la couche ci-dessous., Le nombre d’autres particules que chaque particule dans un solide cristallin entre en contact est connu comme son nombre de coordination. Pour un atome de polonium dans un réseau cubique simple, le nombre de coordination est donc de six.

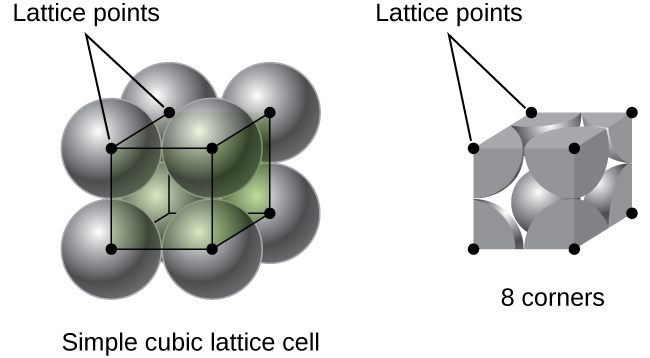
dans un réseau cubique simple, la cellule unité qui se répète dans toutes les directions est un cube défini par les centres de huit atomes, comme le montre la Figure \(\PageIndex{4}\). Les atomes aux coins adjacents de cette cellule unitaire entrent en contact les uns avec les autres, de sorte que la longueur du bord de cette cellule est égale à deux rayons atomiques, ou un diamètre atomique. Une cellule unitaire cubique ne contient que les parties de ces atomes qui s’y trouvent. Étant donné qu’un atome à un coin d’une cellule unitaire cubique simple est contenu par un total de huit cellules unitaires, seulement un huitième de cet atome se trouve dans une cellule unitaire spécifique., Et puisque chaque cellule unitaire cubique simple a un atome à chacun de ses huit « coins », il y a \(8× \ dfrac{1}{8}=1\) atome dans une cellule unité cubique simple.
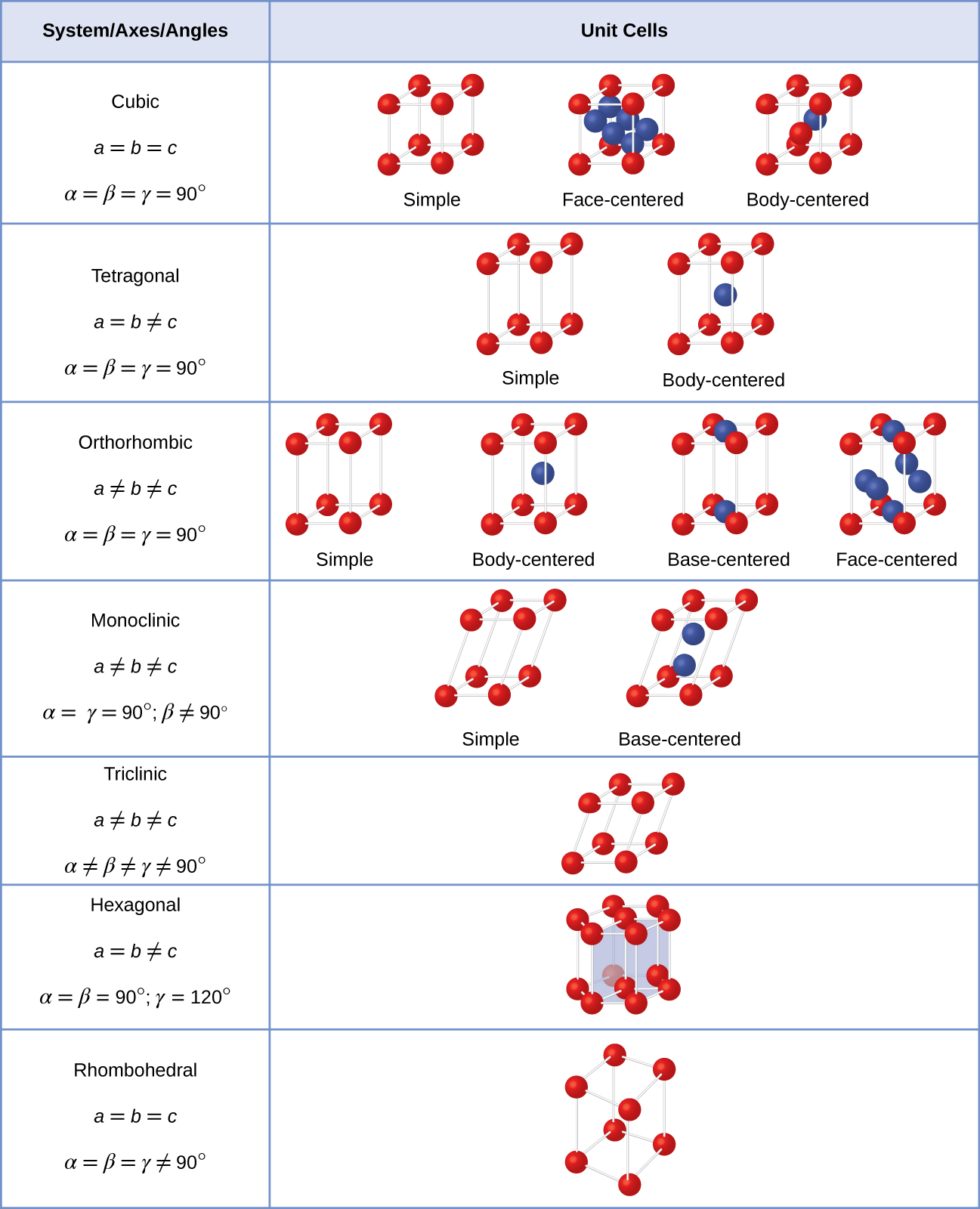
la Plupart des cristaux sont l’un des quatre principaux types de cellules unitaires., Pour l’instant, nous allons nous concentrer sur les trois cellules unitaires cubiques: cubique simple (que nous avons déjà vu), cellule unitaire cubique centrée sur le corps et cellule unitaire cubique centrée sur la face-qui sont toutes illustrées dans la Figure \(\PageIndex{5}\). (Notez qu’il existe en fait sept systèmes de treillis différents, dont certains ont plus d’un type de treillis, pour un total de 14 types différents de cellules unitaires. Nous laissons les géométries plus compliquées pour plus tard dans ce module.,)
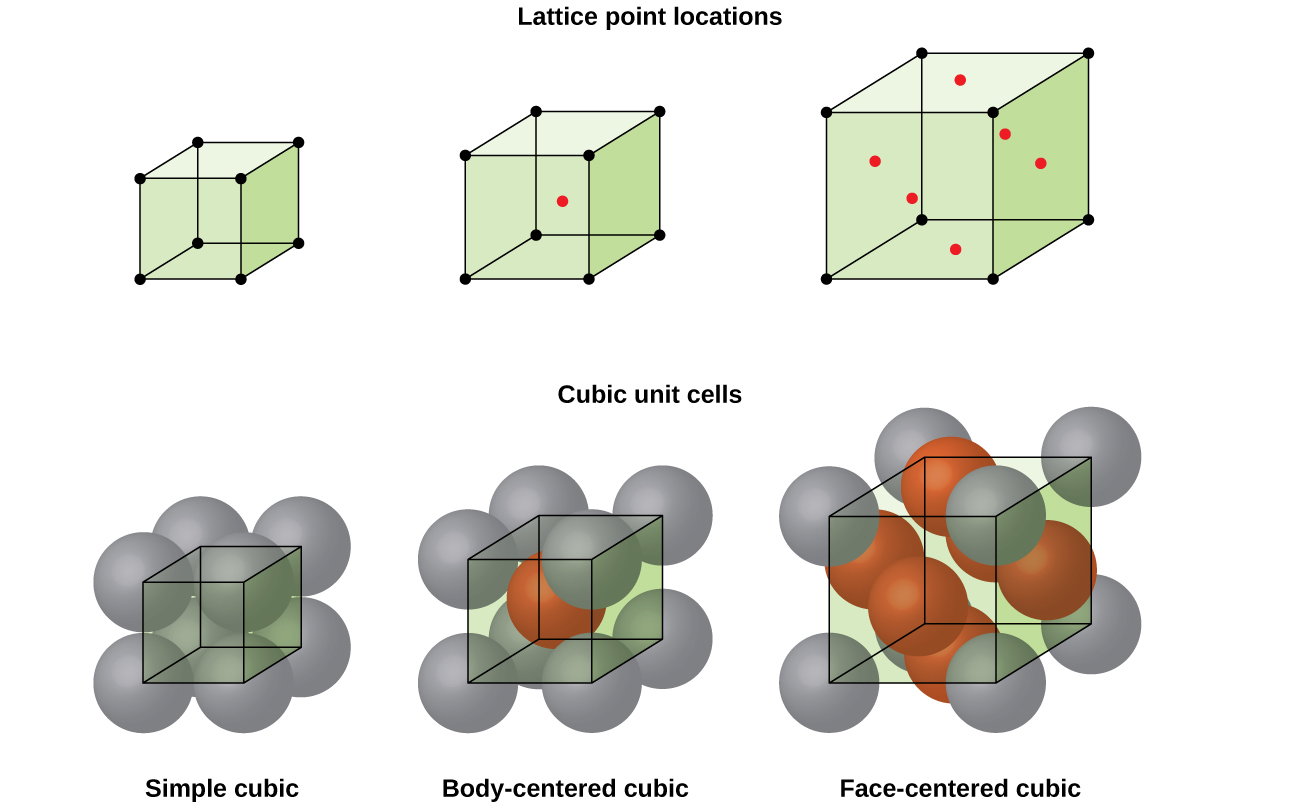
certains métaux cristallisent dans un arrangement qui a une cellule unitaire cubique avec des atomes à tous les Coins et un atome au centre, comme le montre la Figure \(\PageIndex{6}\). C’est ce qu’on appelle un solide cubique centré sur le corps (BCC)., Les atomes dans les coins d’une cellule de L’unité BCC ne se contactent pas mais entrent en contact avec l’atome au centre. Une cellule unité BCC contient deux atomes: un huitième d’atome à chacun des huit coins (\(8× \ dfrac{1}{8}=1\) atome des coins) plus un atome du centre. Tout atome dans cette structure touche quatre atomes dans la couche au-dessus et quatre atomes dans la couche en dessous. Ainsi, un atome dans une structure BCC a un nombre de coordination de huit.,
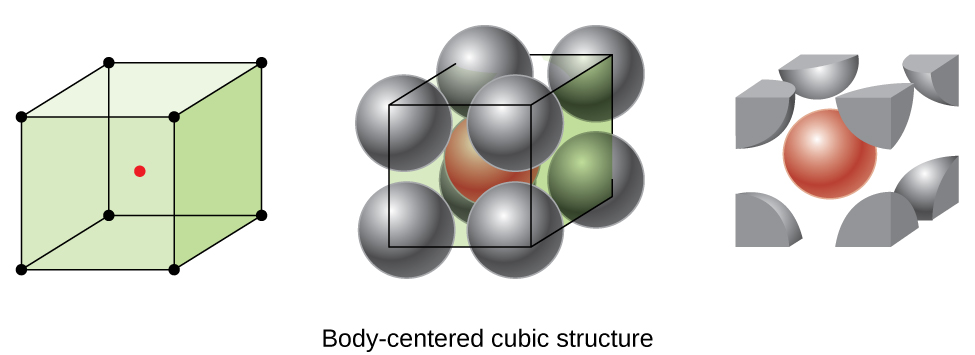
Les atomes dans les arrangements BCC sont beaucoup plus efficacement emballés que dans une structure cubique simple, occupant environ 68% du volume total. Les métaux isomorphes avec une structure BCC comprennent K, Ba, Cr, Mo, W et Fe à température ambiante., (Les éléments ou composés qui cristallisent avec la même structure sont dits isomorphes.)
de nombreux autres métaux, tels que l’aluminium, le cuivre et le plomb, cristallisent dans un arrangement qui a une cellule unitaire cubique avec des atomes à tous les Coins et au centre de chaque face, comme illustré dans la Figure \(\PageIndex{7}\). Cet arrangement est appelé un solide cubique centré sur la face (FCC)., Une cellule unitaire FCC contient quatre atomes: un huitième d’atome à chacun des huit coins (\(8× \ dfrac{1}{8}=1\) atome des Coins) et la moitié d’un atome sur chacune des six faces (\(6× \ dfrac{1}{2}=3\) atomes des faces). Les atomes aux coins touchent les atomes au centre des faces adjacentes le long des diagonales de face du cube. Parce que les atomes sont sur des points de réseau identiques, ils ont des environnements identiques.
Les atomes dans un arrangement de FCC sont emballés aussi étroitement ensemble que possible, avec des atomes occupant 74% du volume., Cette structure est également appelée emballage cubique le plus proche (CCP). Dans CCP, il y a trois couches répétées d’atomes disposés hexagonalement. Chaque atome entre en contact avec six atomes dans sa propre couche, trois dans la couche ci-dessus et trois dans la couche ci-dessous. Dans cet arrangement, chaque atome touche 12 voisins proches, et a donc un numéro de coordination de 12. Le fait que les accords FCC et CCP soient équivalents n’est peut-être pas immédiatement évident, mais la Figure \(\PageIndex{8}\) illustre pourquoi ils sont en fait la même structure.,
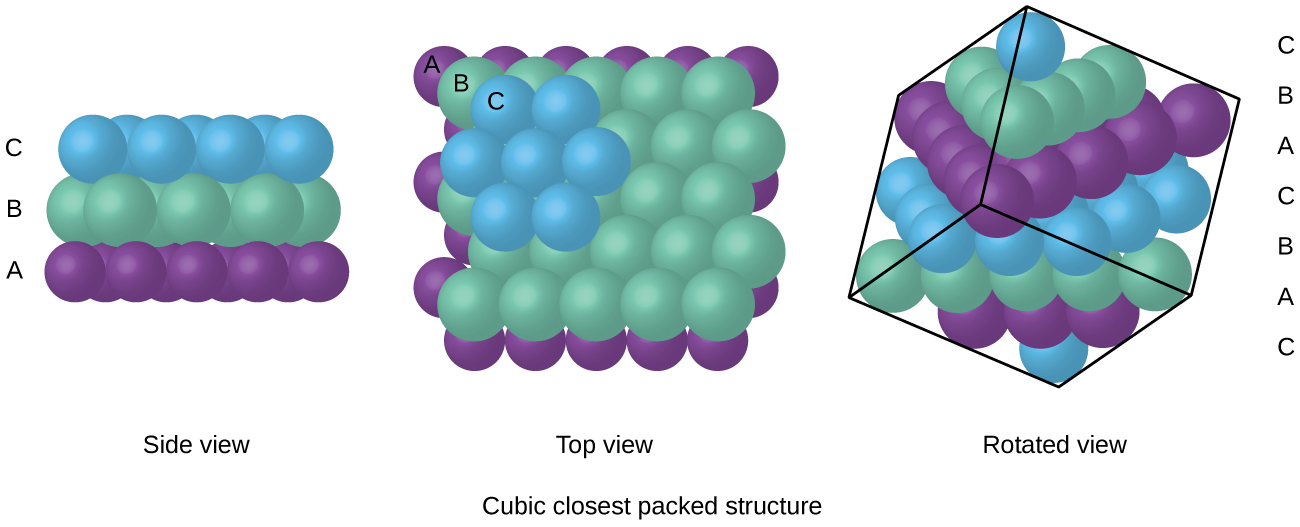
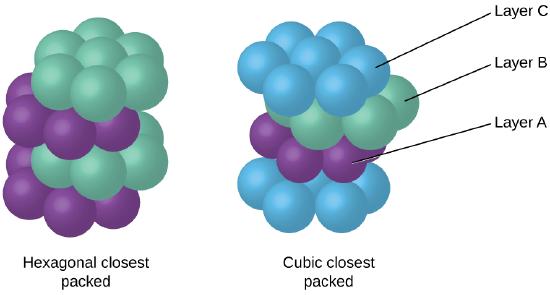
parce que l’emballage plus étroit maximise les attractions globales entre les atomes et minimise l’énergie intermoléculaire totale, les atomes de la plupart des métaux s’emballent de cette manière., Nous trouvons deux types d’emballage le plus proche dans des structures cristallines métalliques simples: le CCP, que nous avons déjà rencontré, et l’emballage le plus proche hexagonal (HCP) illustré à la Figure \(\PageIndex{9}\). Les deux se composent de couches répétées d’atomes disposés hexagonalement. Dans les deux types, une deuxième couche (B) est placée sur la première couche (A) de sorte que chaque atome de la deuxième couche soit en contact avec trois atomes de la première couche. La troisième couche est positionnée de l’une des deux manières suivantes. Dans HCP, les atomes de la troisième couche sont directement au-dessus des atomes de la première couche (c’est-à-dire,, la troisième couche est également de type A), et l’empilement consiste en une alternance de couches rapprochées de type A et de type B (C’est-à-dire ABABAB⋯). Dans CCP, les atomes de la troisième couche ne sont pas au-dessus des atomes de l’une ou l’autre des deux premières couches (c.-à-d., la troisième couche est de type C), et l’empilement consiste en une alternance de couches rapprochées de type A, de type B et de type C (C.-À-D., ABCABCABC⋯). Environ les deux tiers de tous les métaux cristallisent dans des réseaux emballés les plus proches avec des nombres de coordination de 12., Les métaux qui cristallisent dans une structure HCP comprennent Cd, Co, Li, Mg, Na et Zn, et les métaux qui cristallisent dans une structure CCP comprennent Ag, Al, Ca, Cu, Ni, Pb et Pt.
exercice \(\PageIndex{2}\)
l’Argent cristallise dans une structure FCC. La longueur du bord de sa cellule unitaire est de 409 pm.
- Quel est le Rayon atomique D’Ag dans cette structure?
- calculer la densité de Ag.
réponse a
144 pm
réponse b
10.5 g/cm3
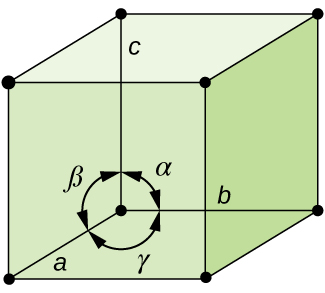
en général, une cellule unitaire est définie par les longueurs de trois axes (a, b et c) et les angles (α, β Et γ) entre eux, comme illustré dans la Figure \(\PageIndex{10}\)., Les axes sont définis comme étant les longueurs entre les points du réseau d’espace. Par conséquent, les axes de cellules unitaires joignent des points avec des environnements identiques.
Il existe sept systèmes de treillis différents, dont certains ont plus d’un type de treillis, pour un total de quatorze cellules unitaires différentes, qui ont les formes montrées dans la Figure \(\PageIndex{11}\).