6.3: Configuration absolue et système (R) et (s)
Configurations absolues des formules de Perspective
les chimistes ont besoin d’un moyen pratique de distinguer un stéréoisomère d’un autre. Le système Cahn-Ingold-Prelog est un ensemble de règles qui nous permet de définir sans ambiguïté la configuration stéréochimique de tout stéréocentre, en utilisant les désignations « R » (du latin rectus, signifiant droitier) ou » S » (du latin sinister, signifiant gaucher).,
Les règles de ce système de nomenclature stéréochimique sont, en surface, assez simples.
règles d’attribution D’une désignation R/S à un centre chiral
1: attribuez des priorités aux quatre substituants, #1 étant la priorité la plus élevée et #4 la plus basse. Les priorités sont basées sur le numéro atomique.
2: tracer un cercle de #1 à #2 à #3.
3: Déterminer l’orientation du groupe prioritaire #4. Si elle est orientée dans le plan de la page (loin de vous), passez à l’étape 4a. Si elle est orientée de l’avion de la page (vers vous) passez à l’étape 4b.,
4a: (groupe#4 pointant loin de vous): un cercle dans le sens des aiguilles d’une montre dans la partie 2 correspond à la configuration R, tandis qu’un cercle dans le sens antihoraire correspond à la configuration S.
4b: (groupe#4 pointant vers vous): un cercle dans le sens des aiguilles d’une montre dans la partie 2 correspond à la configuration S, tandis qu’un cercle dans le sens antihoraire correspond à la configuration R.
nous utiliserons le glycéraldéhyde de sucre à 3 carbones comme premier exemple. La première chose que nous devons faire est d’attribuer une priorité pour chacun des quatre substituants liés au centre chiral., Nous regardons d’abord les atomes qui sont directement liés au centre chiral: ce sont H, O (dans l’hydroxyle), C (dans l’aldéhyde) et C (dans le groupe CH2OH).
assigner la configuration R/S au glycéraldéhyde:

deux priorités sont faciles: l’hydrogène, de numéro atomique 1, est la priorité la plus basse (#4) et l’oxygène hydroxyle, de numéro atomique 8, est la priorité #1. Le carbone a un numéro atomique de 6. Lequel des deux groupes » C » est prioritaire #2, l’aldéhyde ou le CH2OH?, Pour déterminer cela, nous éloignons une liaison de plus du centre chiral: pour l’aldéhyde, nous avons une double liaison à un oxygène, tandis que sur le groupe CH2OH, nous avons une seule liaison à un oxygène. Si l’atome est le même, les liaisons doubles ont une priorité plus élevée que les liaisons simples. Par conséquent, le groupe aldéhyde reçoit la priorité #2 et le groupe CH2OH la priorité #3.
avec nos priorités assignées, nous regardons ensuite le groupe de priorité #4 (l’hydrogène) et voyons qu’il est pointé loin de nous, dans le plan de la page – ainsi l’étape 4a de la procédure ci-dessus s’applique., Ensuite, nous traçons un cercle défini par les groupes prioritaires #1, #2 et #3, dans l’ordre croissant. Le cercle est dans le sens des aiguilles d’une montre, ce qui par l’étape 4a nous indique que ce carbone a la configuration « R », et que cette molécule est (R)-glycéraldéhyde. Son énantiomère, par définition, doit être (s) – glycéraldéhyde.
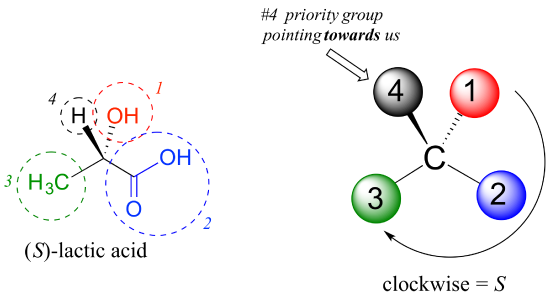
ensuite, examinons l’un des énantiomères de l’acide lactique et déterminons la configuration du centre chiral. De toute évidence, H est le substituant # 4 et OH est #1. En raison de ses trois liaisons à l’oxygène, le carbone sur le groupe acide prend la priorité #2, et le groupe méthyle prend #3., Le groupe # 4, hydrogène, se trouve être dessiné pointant vers nous (hors du plan de la page) dans cette figure, nous utilisons donc l’étape 4b: le cercle tracé de #1 à #2 à #3 est dans le sens des aiguilles d’une montre, ce qui signifie que le centre chiral a la configuration S.
Le thalidomide est un intéressant – mais tragique – l’étude de cas de l’importance de la stéréochimie dans la conception de médicaments., D’abord fabriqué par une société pharmaceutique allemande et prescrit largement en Europe et en Australie à la fin des années 1950 comme sédatif et remède contre les nausées matinales chez les femmes enceintes, la thalidomide a rapidement été impliquée comme cause de malformations congénitales dévastatrices chez les bébés nés de femmes qui l’avaient pris. La Thalidomide contient un centre chiral et existe donc sous deux formes énantiomériques. Il a été commercialisé comme un mélange racémique: en d’autres termes, un mélange 50:50 de deux énantiomères.
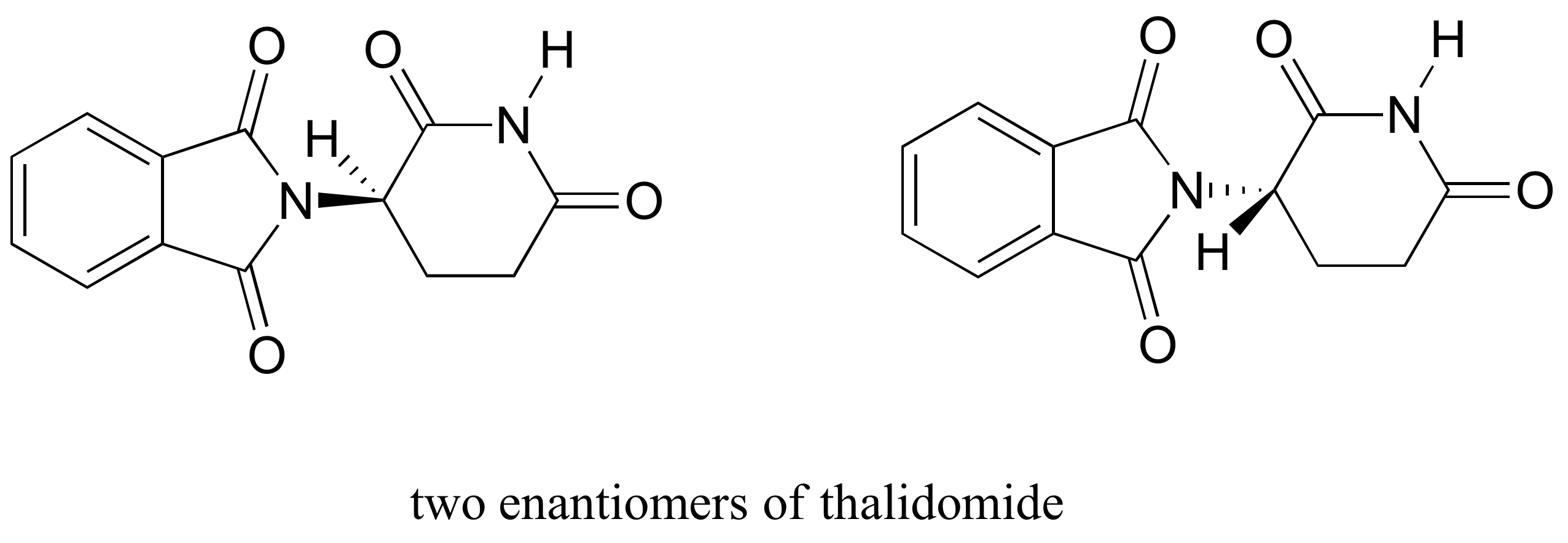
nous allons essayer de déterminer la configuration stéréochimique de l’énantiomère sur la gauche., Des quatre liaisons au centre chiral, la priorité # 4 est l’hydrogène. Le groupe azote est #1, le côté carbonyle du cycle est #2 et le côté –CH2 du cycle est #3.
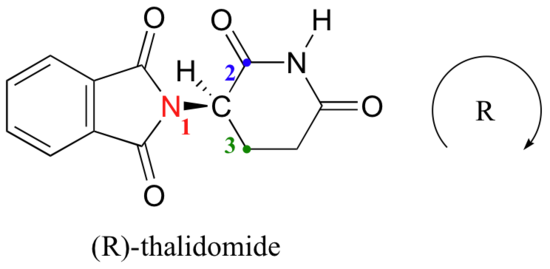
l’hydrogène est montré en pointant loin de nous, et les substituants prioritaires tracent un cercle dans le sens des aiguilles d’une montre: c’est l’énantiomère R de la thalidomide. L’autre énantiomère, bien sûr, doit avoir la configuration S.,
bien que les scientifiques ne sachent toujours pas aujourd’hui comment fonctionne la thalidomide, des preuves expérimentales suggèrent que c’est en fait L’énantiomère R qui a eu les effets médicaux souhaités, tandis que L’énantiomère S a causé les malformations congénitales. Même avec cette connaissance, cependant, le (R)-thalidomide pur n’est pas sûr, car les enzymes dans le corps se convertissent rapidement entre les deux énantiomères – nous verrons comment cela se produit au chapitre 12.
à titre historique, l’utilisation de la thalidomide n’a jamais été approuvée aux États-Unis. C’était en grande partie grâce aux efforts du Dr, Frances Kelsey, un agent des aliments et des drogues qui, au péril de sa carrière, bloqué son approbation en raison de ses préoccupations au sujet de l »absence d » études de sécurité adéquates, en particulier en ce qui concerne la capacité du médicament à entrer dans la circulation sanguine d » un fœtus en développement. Malheureusement, à cette époque, les essais cliniques de nouveaux médicaments impliquaient une distribution généralisée et non réglementée aux médecins et à leurs patients à travers le pays, de sorte que les familles aux États-Unis n’étaient pas épargnées par les dommages causés.,
très récemment, un dérivé proche de la thalidomide est devenu légal aux États-Unis, avec des mesures de sécurité strictes appliquées, pour le traitement d’une forme de cancer du sang appelé myélome multiple. Au Brésil, la thalidomide est utilisée dans le traitement de la lèpre – mais malgré les mesures de sécurité, les enfants naissent toujours avec des défauts liés à la thalidomide.
l’Exercice 1.: Déterminer les configurations stéréochimiques des centres chiraux dans les biomolécules indiquées ci-dessous.
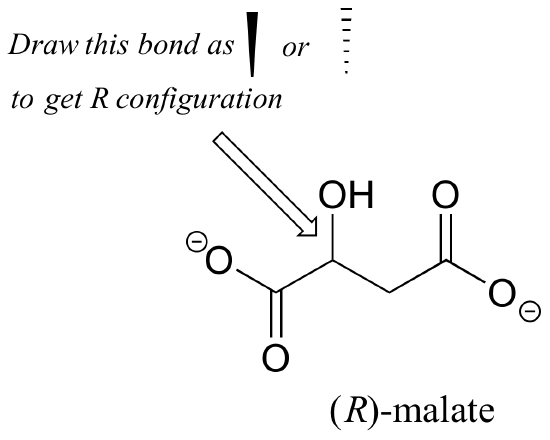
l’Exercice 2.,: L’énantiomère (R) du malate devrait-il avoir un coin solide ou en pointillés pour la liaison C-O dans la figure ci-dessous?
l’Exercice 3.: En utilisant des coins solides ou en pointillés pour montrer la stéréochimie, dessiner l’énantiomère (R) de l’ibuprofène et l’énantiomère (S) du 2-méthylérythritol-4-phosphate (les structures sont présentées plus haut dans ce chapitre sans stéréochimie).
Solutions aux exercices
Configurations absolues des Projections de Fischer
pour déterminer la configuration absolue d’un centre chiral dans une projection de Fisher, utilisez la procédure en deux étapes suivante.,
Étape 1
attribuez des numéros de priorité aux quatre ligands (groupes) liés au centre chiral à l’aide du système de priorité CIP.
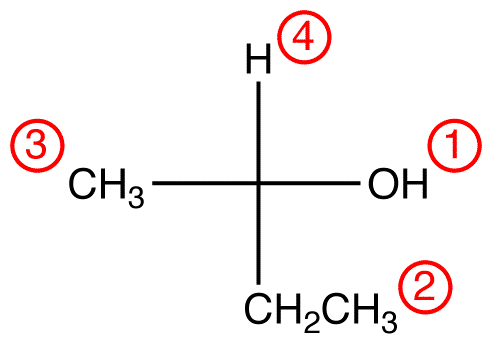
Étape 2 – option verticale
Si le ligand de priorité la plus basse est sur une liaison verticale, alors il pointe loin de la visionneuse.
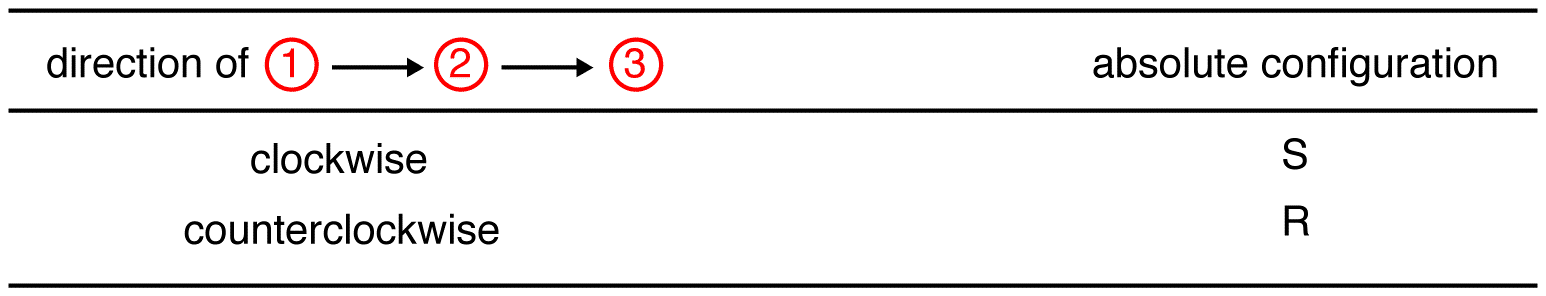
tracez les trois ligands de la plus haute priorité en commençant par le ligand de la plus haute priorité (① → ② → ③) dans la direction qui donnera une réponse très correcte.

dans le composé ci-dessous, le mouvement est dans le sens horaire indiquant une configuration R., Le nom IUPAC complet pour ce composé est (R)-butan-2-ol.

Étape 2 – option horizontale
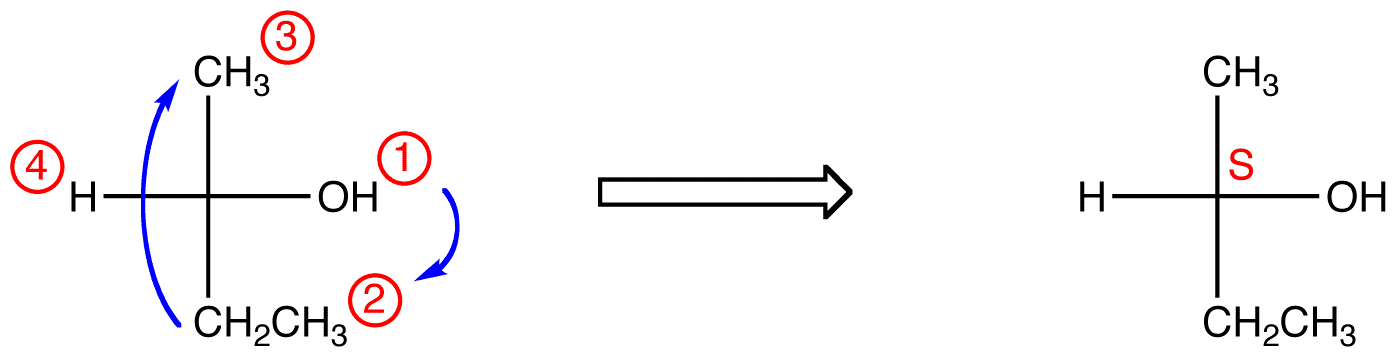
Si le ligand de priorité la plus basse est sur une liaison horizontale, alors il pointe vers la visionneuse.
tracez les trois ligands de la plus haute priorité en commençant par le ligand de la plus haute priorité (① → ② → ③) dans la direction qui donnera une réponse horriblement fausse. Notez dans le tableau ci-dessous que les configurations sont inversées par rapport au premier exemple.,
dans le composé ci-dessous, le mouvement est dans le sens horaire (R) Ce qui est horriblement faux, donc la configuration réelle est S. Le nom IUPAC complet pour ce composé est (s)-butan-2-ol.
manipulation des Projections de Fischer sans modification de la Configuration
Une projection de Fischer restreint une molécule tridimensionnelle en deux dimensions. Par conséquent, il existe des limites quant aux opérations qui peuvent être effectuées sur une projection de Fischer sans changer la configuration absolue aux centres chiraux., Les opérations qui ne modifient pas la configuration absolue à un centre chiral dans une projection de Fischer peuvent être résumées comme deux règles.
Règle 1: la Rotation de la projection de Fischer de 180º dans les deux sens sans la soulever du Plan du papier ne change pas la configuration absolue au centre chiral.
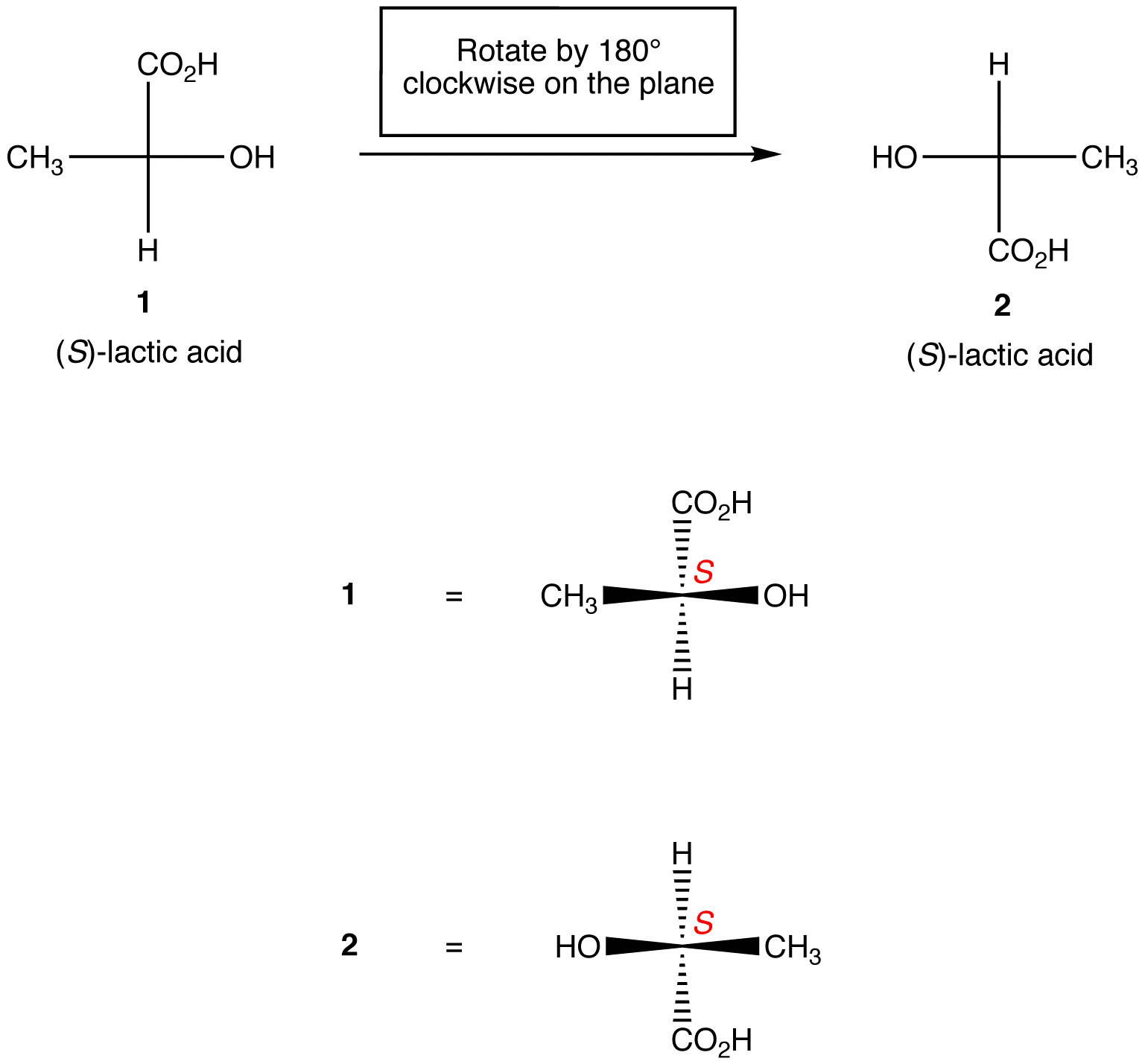
règle 2: la Rotation de trois ligands sur le centre chiral dans les deux sens, en maintenant le ligand restant en place, ne change pas la configuration absolue au centre chiral.,
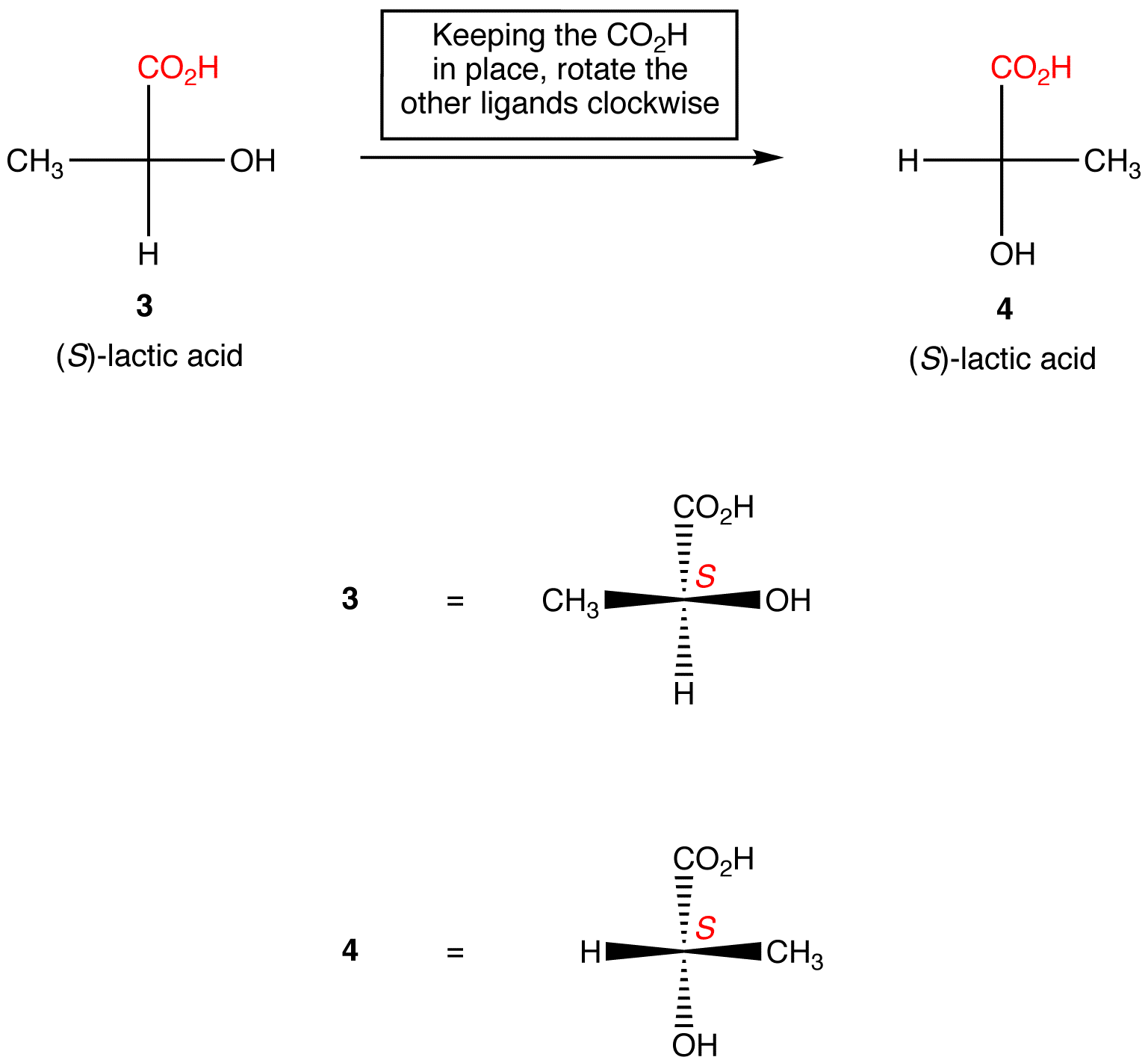
manipulation des Projections de Fischer avec changement de Configuration
Les opérations qui modifient la configuration absolue à un centre chiral dans une projection de Fischer peuvent être résumées en deux règles.
Règle 1: la Rotation de la projection de Fischer de 90º dans les deux sens modifie la configuration absolue au centre chiral.
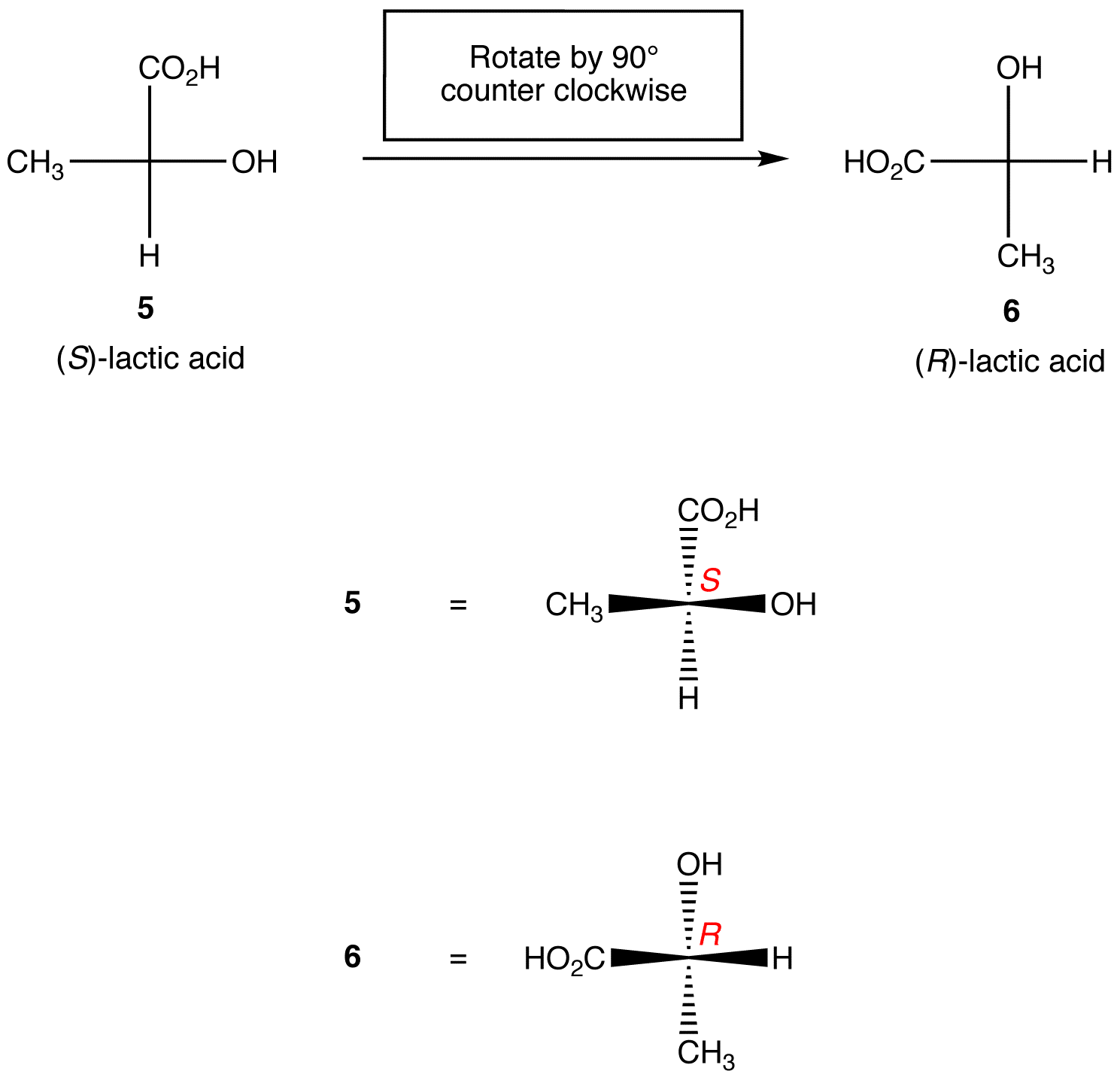
règle 2: L’échange de deux ligands quelconques sur le centre chiral modifie la configuration absolue au centre chiral.,
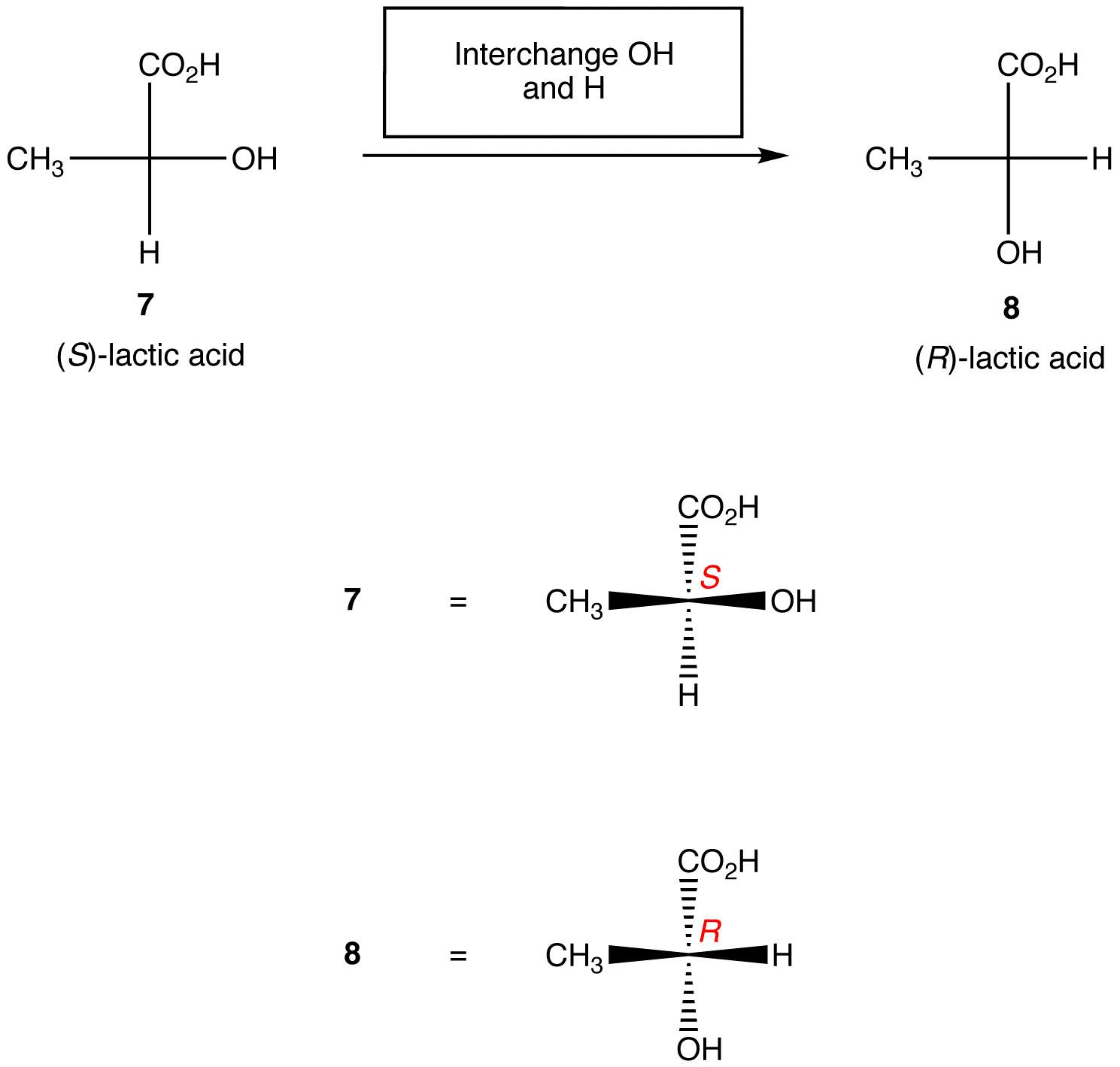
Les règles ci-dessus supposent que la projection de Fischer sous examen ne contient qu’un seul centre chiral. Cependant, avec soin, ils peuvent être appliqués aux projections de Fischer contenant n’importe quel nombre de centres chiraux.
Exercice 1
Classer les composés suivants comme R ou S?
la Solution
- S: I > Br > F > H. la priorité La plus faible substituant, H, est déjà en allant vers l’arrière., Il tourne à gauche en allant de I à Br à F, donc c’est un S.
- R: Br > Cl > CH3 > H. vous devez changer le H et le Br afin de placer le H, la priorité la plus basse, à l’arrière. Ensuite, en passant de Br à Cl, CH3 tourne à droite, vous donnant un R.
- ni R ni S: cette molécule est achirale. Seules les molécules chirales peut être nommé R ou S.
- R: OH > CN > CH2NH2 > H. Le H, la priorité la plus faible, doit être basculé vers l’arrière., Ensuite, à partir de OH, CN, à CH2NH2, vous tournez à droite, vous donnant un R.
- (5) S: \(\ce{-COOH}\) > \(\ce{-CH_2OH}\) > \(\ce{C#CH}\) > \(\ce{H}\). Ensuite, en passant de \(\ce{-COOH}\) à \(\ce{-CH_2OH}\) à \(\ce {- C#CH}\), vous tournez à gauche, vous donnant une configuration S.
Exercices
6. Orientez ce qui suit de sorte que l’atome le moins prioritaire (4) soit rythmé derrière, puis assignez la stéréochimie (R ou S).

7. Tirage (R)-2-bromobutan-2-ol.
8., Assigner R / S à la molécule suivante.
.png?revision=1)
Solutions

A = S; B = R
8. Le centre stéréo est R.
Autres Ressources
Kahn Academy didacticiel vidéo sur la R-S système de nommage
- Schore et Vollhardt. Structure et fonction de chimie organique. Il est le père de la famille Freeman et de la compagnie W. H. Freeman, 2007.
- McMurry, John et Simanek, Eric. Principes fondamentaux de la chimie organique. 6e Ed. Brooks Cole, 2006.,
contributeurs et Attributions
- Ekta Patel (UCD), Ifemayowa Aworanti (University of Maryland Baltimore County)
- Chimie Organique avec un accent Biologique par Tim Soderberg (University of Minnesota, Morris)