Combined therapy in neonatal hypoxic-ischaemic encephalopathy | Anales de Pediatría (édition anglaise)
Introduction
avec une incidence de 1 à 3 Cas pour 1000 naissances à terme,1 l’encéphalopathie hypoxique-ischémique (HIE) est l’une des causes les plus fréquentes de lésions cérébrales chez les nouveau-nés. Compte tenu du nombre croissant de naissances à haut risque dû à l’augmentation de l’âge de la mère et de la fréquence des grossesses multiples, entre autres facteurs, L’EIS continue d’être un problème pertinent en milieu hospitalier pour lequel il n’y a pas encore de solution définitive.,
la recherche sur la physiopathologie de l’asphyxie périnatale nous a permis de comprendre le processus complexe qui se déroule au niveau cellulaire et tissulaire lorsque les lésions cérébrales se développent en raison d’un manque d’oxygène. Bon nombre des mécanismes impliqués de la blessure sont regroupés en fonction du moment écoulé pour leur développement, et 4 phases principales ont été décrites (Fig. 1): phase primaire, ou épisode aigu d’ischémie hypoxique (HI), phase latente, phase secondaire et phase tertiaire., Dans la phase primaire, les dommages découlent d’une réduction de l’apport d’oxygène aux cellules et aux tissus, ce qui entraîne une défaillance de l’énergie primaire. Ceci est suivi d’une récupération apparente des niveaux de composés phosphorylés à haute énergie, connus sous le nom de phase latente., Cependant, cette amélioration n’est que temporaire et cède la place à la phase secondaire, lorsque de nombreux mécanismes physiopathologiques impliqués dans le développement des lésions cérébrales chez les nouveau-nés entrent en jeu, dont l’excitotoxicité, un afflux massif d’ions calcium dans les cellules, le stress oxydatif, l’inflammation et, dans la plupart des cas, la mort cellulaire due à Enfin, la phase tertiaire est caractérisée par la persistance de lésions cérébrales des semaines, des mois, voire des années après l’atteinte initiale hypoxique-ischémique.,
la compréhension de la physiopathologie sous-jacente de HIE a permis d’identifier des cibles thérapeutiques potentielles qui pourraient aider à réduire les lésions cérébrales causées par l’asphyxie et le développement de nombreuses stratégies de traitement. Certains de ces traitements, actuellement en cours d’essai, sont destinés à fonctionner en synergie avec l’hypothermie thérapeutique, le seul traitement contre L’éh qui a été généralement adopté dans le cadre des soins intensifs néonatals.,
hypothermie
L’hypothermie a commencé à être utilisée comme stratégie neuroprotectrice chez les nourrissons après la découverte d’un mécanisme de refroidissement endogène qui s’est manifesté chez les nourrissons ayant subi un type de blessure à la naissance.2 ses effets neuroprotecteurs sont principalement liés à la diminution de l’activité métabolique du cerveau, de 5% à chaque baisse de température de 1°C, 3 qui module certaines des voies métaboliques nocives déclenchées par l’asphyxie, qui sont résumées à la Fig. 2.
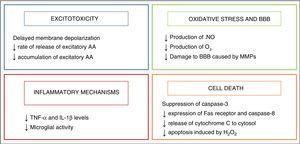
effet de l’hypothermie sur les mécanismes des lésions cérébrales.
thérapie combinée
étant donné que les preuves suggèrent que les protocoles d’hypothermie actuels sont optimaux4 mais sont d’une efficacité limitée dans la pratique clinique5,nous devons élargir notre arsenal thérapeutique pour la prise en charge de L’EIE.,6 des recherches récentes ont porté sur le développement et la mise en œuvre de traitements pouvant être utilisés en combinaison avec l’hypothermie, conçus pour agir à différents niveaux de la cascade physiopathologique et pour favoriser la synergie des deux thérapies (Fig. 3).

cibles thérapeutiques possibles et principales stratégies neuroprotectrices faisant actuellement l’objet d’essais pour la prise en charge de l’EIE néonatale.
Mélatonine
la Mélatonine (N-acétyl-5-metoxitriptamina) est une neurohormone synthétisée par la glande pinéale, dont la sécrétion suit un cycle jour/nuit et dont le principal rôle dans la régulation du rythme circadien. Les principaux aspects qui permettent son utilisation dans la gestion de L’HIE sont sa puissante activité antioxydante et anti-inflammatoire7 et sa capacité à franchir la barrière hémato–encéphalique et à atteindre le système nerveux central.,8
avant d’être essayée chez les nouveau-nés, il a été prouvé que la mélatonine augmentait le niveau de protection offert par l’hypothermie grâce à l’optimisation du métabolisme énergétique cérébral dans un modèle d’asphyxie de porcelet.9 dans le cadre clinique, une étude publiée par Aly et al.10 attribué la moitié des nouveau-nés asphyxiés à l’hypothermie et 5 doses de 10 mg/kg/jour de mélatonine délivrées par voie orale., Les auteurs ont constaté une réduction des taux sériques de superoxyde dismutase et d’oxyde nitrique chez les patients traités par association par rapport à ceux traités par refroidissement seul, démontrant ainsi les effets bénéfiques de la combinaison des deux stratégies contre le stress oxydatif.
Une étude récente menée par Balduini et coll., pour évaluer l’innocuité, la pharmacocinétique, la posologie et l’efficacité de la mélatonine utilisée en combinaison avec l’hypothermie, on a constaté que le refroidissement n’affectait pas la pharmacocinétique de la mélatonine11 et qu’il était possible d’obtenir des taux sériques élevés de l’hormone en administrant des doses inférieures à celles utilisées dans les modèles animaux expérimentaux. À l’heure actuelle, L’essai clinique MELPRO (NCT03806816) recrute des patients, visant un échantillon de 100 nouveau-nés., Cette étude et d’autres études similaires sont indispensables pour le développement futur d’essais cliniques de phase III et l’utilisation ultérieure de la mélatonine dans la pratique clinique quotidienne.
Allopurinol
la raison d’être de l’utilisation de l’allopurinol dans la gestion de L’IEH est son effet inhibiteur sur la xanthine oxydase, une enzyme impliquée dans le stress oxydatif. En outre, ce médicament agit comme un chélateur de fer libre et séquestre les radicaux hydroxyles.,12,13 une étude préclinique chez des chiots de rats où les animaux ont été répartis dans 1 des 5 groupes (groupe témoin, groupe HI, groupe traité par hypothermie, groupe traité par allopurinol et groupe traité par association) a révélé que 72h après L’insulte HI, le groupe de thérapie combinée présentait le volume d’infarctus le plus faible.,14
en ce qui concerne ses caractéristiques pharmacologiques, l’allopurinol peut rapidement traverser le placenta et atteindre des concentrations thérapeutiques chez les nouveau-nés, comme l’a démontré une étude menée sur des femmes enceintes ayant reçu 500 mg d’allopurinol par voie intraveineuse, avec des preuves de niveaux optimaux d’allopurinol 5min plus tard dans des échantillons de sang de cordon ombilical.15 Une étude menée par van Bel et coll., en 1998, qui a analysé son effet antioxydant potentiel chez les nouveau-nés asphyxiés avec HIE sévère a constaté que l’administration intraveineuse de 40 mg/kg d’allopurinol a obtenu une réduction de la formation de radicaux libres.13 cependant, une étude menée plus tard par Benders et al. en 2006 n’a pas trouvé de différences entre le groupe traité par allopurinol et le groupe témoin.16 dans les conclusions, ces auteurs ont identifié l’extrême gravité de L’éh chez les nouveau-nés inclus dans l’échantillon comme une explication possible de l’absence de différences significatives., Ils ont également émis l’hypothèse que la période écoulée jusqu’à l’administration d’allopurinol (3–4H après la reperfusion) aurait pu être trop longue pour obtenir des résultats favorables. Concernant ce dernier point, Gunes et coll. administré la même dose d’allopurinol donnée dans les 2 études précédentes, mais dans les 2h suivant la naissance, et trouvé des améliorations dans les résultats neurodéveloppementaux dans le groupe de traitement.,17 dans le même ordre d’idées, l’administration d’allopurinol intraveineux aux mères lors de l’accouchement de fœtus atteints d’hypoxie ou d’hypoxie naissante a augmenté l’efficacité du traitement, réduisant les taux de protéine S-100β dans le sang du cordon, qui est un marqueur de lésions cérébrales.18 un essai clinique intitulé Effect of Allopurinol for Hypoxic-ischemic Brain Injury on Neurocognitive Outcome (NCT03162653) est actuellement en cours pour évaluer les effets thérapeutiques potentiels de l’administration de cet inhibiteur enzymatique dans les premières minutes suivant la naissance.,
érythropoïétine
L’érythropoïétine (EPO) est une cytokine de 30,4 kDa synthétisée par le foie pendant la vie fœtale et après la naissance par le rein et le cerveau en développement, où elle agit comme facteur de croissance et agent neuroprotecteur.19 l’utilisation de l’EPO et de l’EPO humain recombinant (rhEPO) dans HIE est basée sur son activité, par l’engagement des récepteurs de L’EPO présents dans les neurones et la glie20,en tant qu’agent antiapoptotique puissant (transcription stimulante des gènes ANTIAPOPTOTIQUES BCL-2 et BCL-XL), et en tant qu’anti-inflammatoire et antioxydant.,19,21 en plus de son effet neuroprotecteur, L’EPO peut favoriser des processus de réparation à long terme, tels que l’angiogenèse, l’oligodendrogenèse et la neurogenèse.22,23
Les études précliniques qui ont évalué l’effet synergique de la combinaison de l’administration D’EPO ou de rhEPO avec l’hypothermie ont donné des résultats contradictoires. Dans un modèle similaire de lésions cérébrales hypoxiques-ischémiques chez le rat au 7e jour après la naissance, Fang et al. trouvé aucun effet neuroprotecteur significatif de leur utilisation combinée.24 cependant, dans une autre étude menée par Fan et al.,, 25 Les auteurs ont observé un léger effet bénéfique sur la fonction sensorimotrice chez les petits de rat, bien que cette différence ne se reflète pas dans les caractéristiques histologiques des échantillons de tissus cérébraux.
des études chez les nouveau–nés atteints de HIE ont montré que l’utilisation de rhEPO est sans danger à des doses de 300-2500iu/kg. De faibles doses de rhEPO ont été trouvées efficaces chez les patients présentant des lésions modérées et semblent être associées à une diminution du risque d’invalidité ou de décès.26 doses plus élevées (jusqu’à 2500IU/kg) peuvent réduire l’incidence des crises et des anomalies neurologiques à 6 mois.,27
aujourd’hui, trois essais cliniques de phase III sont en cours avec un recrutement prévu d’un total de 840 nouveau-nés pour évaluer la sécurité et l’efficacité de fortes doses D’EPO (1000iu/kg) associées à l’hypothermie (érythropoïétine pour L’encéphalopathie ischémique hypoxique chez les nouveau-nés, NCT03079167; érythropoïétine à forte dose pour L’asphyxie et L’encéphalopathie, NCT02811263; érythropoïétine encéphalopathie ischémique hypoxique, Nct03163589). L’objectif principal du premier 2 est de réduire la mortalité ou l’invalidité à 2 ans, tandis que le troisième évaluera ces deux résultats après 1 an., Nous attendons les résultats de ces études et d’autres pour déterminer si L’EPO ou l’un de ses dérivés sont efficaces et comment ils doivent être utilisés dans la pratique clinique, en évaluant des facteurs tels que la dose minimale efficace, la voie d’administration, la durée du traitement, etc.
cellules souches
l’utilisation de cellules souches pour le traitement de toutes sortes de maladies, y compris L’éh, est un domaine de recherche qui ne cesse de croître., Cette approche thérapeutique pourrait aider à réparer et régénérer le tissu cérébral endommagé après l’insulte hypoxique-ischémique grâce à l’interaction des cellules souches avec des cellules immunitaires dans des organes éloignés du cerveau, tels que la rate, modifiant ainsi la réponse immunitaire/inflammatoire. De même, la récupération fonctionnelle obtenue avec leur administration peut s’expliquer en partie par l’interaction des cellules transplantées et du tissu cérébral, avec la production subséquente de facteurs de croissance dont l’effet final se traduirait par une augmentation de la neurogenèse et de la prolifération cellulaire.,
bien que nous ayons encore besoin d’approfondir nos connaissances pour pouvoir utiliser les cellules souches comme thérapie efficace, des études expérimentales chez l’animal ont démontré que différents types de cellules souches sont capables de survivre dans le cerveau endommagé, de se différencier en neurones ou en gliales, de s’intégrer dans le tissu cible et de modifier favorablement les résultats28)., Des études récentes ont rapporté que l’administration de cellules souches mésenchymateuses combinée à 24h de refroidissement chez les chiots de rat 7 jours après la naissance a obtenu de meilleurs résultats par rapport à l’un ou l’autre traitement isolément29,et ont également constaté que l’hypothermie élargit la fenêtre de temps thérapeutique pour l’administration de cellules souches mésenchymateuses jusqu’à,30 en outre, les cellules souches peuvent réguler la réponse immunitaire par leurs interactions avec des cellules immunitaires effectrices situées dans des organes éloignés du cerveau, comme la rate, dont la mobilisation est connue pour avoir le potentiel d’exacerber la réponse inflammatoire et les dommages ischémiques dans le cerveau immature, renforçant ainsi leur effet neuroprotecteur.,31,32
la thérapie par cellules souches, seule ou en combinaison avec l’hypothermie thérapeutique, est un domaine de recherche prometteur qui nécessite encore des essais cliniques pour déterminer, entre autres aspects, le type de cellules souches le plus efficace et la posologie et la durée optimales du traitement afin d’obtenir les meilleurs résultats possibles.,28 L’un des projets actuellement en cours dans la phase de recrutement (étude de hCT-MSC chez les nouveau-nés atteints D’EIE modérée ou sévère, NCT03635450) comprendra 6 nourrissons nés à un âge gestationnel de 36 semaines ou plus avec une EIE modérée à sévère à traiter par hypothermie et 2 doses intraveineuses de cellules stromales mésenchymateuses dérivées du tissu du cordon ombilical (hCT-MSC). Les principaux objectifs de cet essai de phase I sont d’évaluer la sécurité de hCT-MSC et d’analyser les résultats de survie et de neurodéveloppement chez les participants à 6 et 16 mois, respectivement., Un autre essai de phase I (NCT00593242) a obtenu des résultats prometteurs avec la transplantation autologue de cellules sanguines de cordon ombilical, avec 74% des nouveau-nés ayant reçu des cellules souches survivant avec des scores de 85 ou plus dans les échelles de Bayley par rapport à 41% des nouveau-nés traités par refroidissement seul.33
N-acétylcystéine
la N-acétylcystéine (NAC) est un précurseur de la cystéine qui récupère les radicaux libres et intervient dans l’entretien du glutathion 34,régulant ainsi le stress oxydatif., Les données provenant de modèles animaux ont montré une plus grande réduction du volume de l’infarctus cérébral chez les animaux traités avec une combinaison de NAC et d’hypothermie par rapport aux animaux traités avec une seule de ces interventions. En outre, les animaux traités par Association ont montré des résultats similaires dans les réflexes et les dommages à la substance blanche à ceux trouvés dans le groupe témoin.35 étant donné que son administration pendant la grossesse n’a pas d’effets tératogènes et qu’il peut traverser le placenta 36,le NAC est devenu considéré comme l’un des agents thérapeutiques les plus prometteurs pour une utilisation future dans les unités de soins intensifs néonatals., Cependant, à notre connaissance, aucun essai clinique n’a été conçu à ce jour pour évaluer son utilisation dans la prise en charge de HIE, et les preuves disponibles se limitent aux essais liés à l’inflammation intra-amniotique, à la chorioamnionite ou au syndrome de détresse respiratoire.
gaz nobles
Les gaz nobles comme le xénon et le radon ont montré des effets neuroprotecteurs dans des modèles animaux d’HI néonatal. De nombreuses études ont analysé la possibilité d’utiliser le xénon comme agent thérapeutique (pour un examen des preuves, voir L’article de Lobo et al.,37) en raison de sa capacité à réduire l’excitotoxicité après une insulte HI grâce à la modulation des récepteurs du glutamate NMDA.38,39
l’essai clinique multicentrique Total Body hypothermia plus Xenon (TOBY-Xe) a utilisé du gaz xénon en combinaison avec l’hypothermie dans un échantillon de 92 nourrissons nés entre 36 et 43 semaines de gestation., Bien qu’il n’ait pas trouvé de différences significatives entre les groupes40,dans le but d’obtenir des informations plus détaillées sur certaines des variables qui ont pu avoir un impact sur les résultats du traitement avec ce gaz noble, comme sa posologie ou sa durée, un essai clinique de phase II est actuellement en cours (étude CoolXenon3, Nct02071394).,
d’autre part, il n’y a eu aucun essai clinique de l’argon à ce jour, mais il a été démontré que l’argon améliore les résultats du refroidissement en termes de niveaux du marqueur N-acétyl-aspartate/lactate, qui a été associé à des augmentations des valeurs moyennes de mort cellulaire et au développement de séquelles neurologiques chez les nouveau-nés atteints.41 ces résultats prometteurs, ainsi que sa biodisponibilité plus élevée et son coût moindre par rapport au xénon, font de l’argon une molécule à fort potentiel de traduction du banc au chevet du patient dans le traitement de L’IEH.,
Conclusions
parvenir à un traitement efficace de L’éh est l’un des grands défis auxquels est confrontée la médecine moderne. Pour cette raison, des efforts importants ont été déployés depuis des années pour analyser les mécanismes conduisant à des lésions des cellules cérébrales après une asphyxie périnatale dans le but de développer des traitements efficaces pour les bloquer. À l’heure actuelle, les pédiatres et les neuroscientifiques tentent de développer de nouveaux composés qui pourraient fonctionner en synergie avec l’hypothermie dans le but de réduire au minimum les séquelles neurologiques de HIE., D’autre part, des études récentes ont commencé à inclure le sexe parmi les variables à prendre en compte dans la prise en charge de HIE, car des différences sexuelles dimorphiques ont été trouvées tant dans les mécanismes de blessure (dans les modèles expérimentaux, les femelles ont présenté des déficits de mémoire plus importants, tandis que les mâles ont montré une plus grande sensibilité au stress oxydatif), que dans les voies des différents traitements envisagés., Malgré les progrès prometteurs réalisés avec l’utilisation de la mélatonine ou de composés tels que L’EPO, des études précliniques sont encore nécessaires pour élucider davantage les mécanismes d’action de ces molécules, et des essais cliniques avec des échantillons plus importants sont nécessaires pour déterminer le dosage optimal et les voies d’administration de ces traitements et d’autres.
Financement
L’étude a été soutenue par une subvention accordée par L’UPV/EHU dans le cadre du programme de financement des groupes de recherche de l’Université (GIU 17/018).
Conflits d’intérêts
Les auteurs n’ont aucun conflit d’intérêts à déclarer.