Diclofénac (Français)
diclofénac
solution injectable et dragées à libération prolongée
analgésique, anti-inflammatoire, antirhumatismal
forme pharmaceutique et formulation:
chaque ampoule contient:
diclofénac sodique……………………………………………………. 75 mg
eau pour injection, 3 ml.
chaque dragée à libération prolongée contient:
diclofénac sodique………………………………………………….., 100 mg
Indications thérapeutiques: le diclofénac sodique est un anti-inflammatoire qui a des propriétés analgésiques et antipyrétiques et est indiqué par voie intramusculaire et orale pour le traitement des maladies rhumatismales arthrite rhumatoïde Aiguë, spondylarthrite ankylosante, arthrose, lumbago, goutte dans la phase aiguë, inflammation, coliques rénales et biliaires post-traumatiques et postopératoires, migraines, et comme prophylaxie pour la douleur postopératoire et la dysménorrhée.,
contre-indications: le diclofénac sodique est contre-indiqué en présence d’ulcère gastrique ou intestinal, d’hypersensibilité connue à la substance active, au métabisulfite et à d’autres excipients.
est contre-indiqué chez les patients souffrant d’asthme, d’urticaire ou de rhinite aiguë après administration d’acide acétylsalicylique ou d’autres médicaments inhibant la prostaglandine synthétase. En présence d’hypertension artérielle sévère, d’insuffisance cardiaque, rénale et hépatique, de cytopénies.,
précautions générales: les effets gastro-intestinaux sont les plus fréquents lors de l’utilisation de la voie orale. Des saignements, un ulcère ou une perforation de la paroi intestinale sont observés.
des précautions doivent être prises chez les patients présentant une insuffisance hépatique et rénale. Après un apport chronique pendant plus de 8 semaines, les effets de l’aminotransférase doivent être évalués et le médicament arrêté s’il existe des chiffres anormaux de l’aminotransférase.,
restrictions d’utilisation pendant la grossesse et l’allaitement:
Catégorie de risque B: à ce jour, les données disponibles sur l’utilisation du diclofénac pendant la grossesse et l’allaitement sont insuffisantes; il n’est donc pas recommandé pendant la grossesse et l’allaitement.
effets secondaires et indésirables: en termes généraux, les effets indésirables fréquents sont pris en compte lorsque leur incidence est supérieure à 10%, occasionnelle entre 1 et 10%; effets indésirables entre 0,001 et 1%, dans des cas isolés moins de 0,001%.,
Les effets indésirables sont répertoriés en fonction du site de l’état.
tractus gastro-intestinal: douleurs épigastriques, d’autres troubles gastro-intestinaux tels que nausées, vomissements, diarrhée, crampes abdominales, dyspepsie, flatulences et l’anorexie. Rarement: saignement gastro-intestinal (hématémèse, méléna, diarrhée sanglante), ulcère gastrique ou intestinal avec ou sans saignement ou perforation., Cas isolés: stomatite aphteuse, glossite, lésions œsophagiennes, sténose intestinale due à la déformation des « diaphragmes”, troubles intestinaux faibles tels que colite hémorragique non spécifique et exacerbation de la colite ulcéreuse ou de la maladie de Crohn, constipation et pancréatite.
système nerveux central: parfois: maux de tête, vertiges ou vertiges. Rarement: somnolence., Cas isolés: troubles de la sensibilité, y compris paresthésie, troubles de la mémoire, désorientation, insomnie, irritabilité, convulsions, dépression, anxiété, cauchemars, tremblements, réactions psychotiques, méningite aseptique.
sens particuliers: cas isolés: troubles de la vision (vision floue, diplopie), perte auditive, acouphènes, troubles du goût.
peau: parfois: érythème ou éruption cutanée. Rarement: urticaire., Cas isolés: éruptions bulleuses, eczéma, érythème polymorphe, syndrome de Stevens-Johnson, syndrome de Lyell (épidermolyse toxique aiguë), érythrodermie (dermatite exfoliative), perte de cheveux, réaction de photosensibilité; violet, y compris violet allergique.
hématologique: cas isolés: thrombocytopénie, leucopénie, anémie (hémolytique, aplasique), agranulocytose.
reins: cas isolés: insuffisance rénale aiguë, troubles urinaires tels que hématurie, protéinurie, néphrite interstitielle, syndrome néphrotique et nécrose papillaire.,
foie: occasionnellement: augmentation des taux sériques d’aminotransférase. Rarement: hépatite avec ou sans ictère. Cas isolés: hépatite fulminante.
hypersensibilité: rarement: réactions d’hypersensibilité telles que asthme, réactions anaphylactiques / anaphylactoïdes systémiques, y compris hypotension. Cas isolés: vascularite, pneumonite.
système cardiovasculaire: cas isolés: palpitations, douleurs thoraciques, hypertension et insuffisance cardiaque congestive.,
autres systèmes d’organes: occasionnels: réactions au point d’injection intramusculaire telles que douleur locale et durcissement. Cas isolés-abcès locaux et nécrose au point d’injection intramusculaire.
interactions médicamenteuses et autres: l’administration concomitante de diclofénac sodique et d’agents préparés à base de lithium ou de digoxine peut augmenter le taux plasmatique de these.it est possible que divers agents anti-inflammatoires non stéroïdiens inhibent l’effet des diurétiques.,
un traitement concomitant par des diurétiques épargneurs de potassium peut être lié à une hyperkaliémie, nécessitant une surveillance des taux sériques de potassium. L’administration concomitante avec des anti-inflammatoires systémiques non stéroïdiens peut favoriser l’apparition d’effets secondaires.
dans les études cliniques, il semble que le diclofénac sodique n’influence pas l’effet des anti-inflammatoires; cependant, il existe des rapports selon lesquels il augmente le risque de saignement avec une utilisation combinée avec des anticoagulants.,
des études cliniques ont montré que le diclofénac sodique peut être administré de manière concomitante avec des antidiabétiques oraux sans altérer l’effet clinique. Cependant, certains cas ont été rapportés dans lesquels une hypoglycémie et une hyperglycémie se produisent avec le diclofénac sodique, il est donc nécessaire de modifier la posologie de l’hypoglycémie.,
avec l’administration de méthotrexate, il faut faire preuve de prudence lorsque des anti-inflammatoires non stéroïdiens sont utilisés dans des périodes inférieures à 24 heures avant ou après le traitement, car la concentration sanguine de méthotrexate peut être augmentée et augmenter ainsi sa toxicité. Les effets des AINS sur les prostaglandines peuvent augmenter la néphrotoxicité de la cyclosporine.
Il y a des rapports isolés de crises peut-être dues à l’utilisation concomitante de quinolones et de médicaments anti-inflammatoires non stéroïdiens.,
précautions relatives aux effets de la carcinogenèse, de la mutagenèse, de la tératogenèse et de la fertilité: dans des études sur des rats expérimentaux, le diclofénac n’a pas influencé la fertilité des parents, ni le développement pré, péri et postnatal de la progéniture.
aucun effet tératogène n’a été détecté dans les études expérimentales chez l’animal. Dans les expériences in vitro et in vivo, des études prolongées sur des rats et des souris n’ont pas été en mesure de démontrer des effets mutagènes ou un potentiel cancérigène.,
dose et voie D’Administration:
perfusion orale, intramusculaire et intraveineuse.
la dose orale varie de 100 à 200 mg par jour.
adultes: n’appliquez les ampoules que pendant deux jours, et si nécessaire, vous pouvez continuer avec des dragées au diclofénac.
intramusculaire: en général, la dose est une ampoule quotidienne de 75 mg par voie intraglutanée profondément dans le quadrant supérieur externe. Ce n’est qu’exceptionnellement, dans les cas graves, que deux injections quotidiennes de 75 mg peuvent être administrées avec un intervalle de plusieurs heures.,
dans les crises de migraine, l’utilisation initiale est une ampoule de 75 mg administrée dès que possible. La dose totale ne doit pas dépasser 175 mg le premier jour.
les enfants: l’administration intraveineuse est réalisée par perfusion lente. Pour le traitement de la douleur postopératoire modérée à sévère, infuser 75 mg En Continu sur une période de 30 minutes à deux heures. Si nécessaire, il peut être retiré après quelques heures, mais la dose ne doit pas dépasser 150 mg en 24 heures.,
pour la Prévention de la douleur postopératoire, administrer par perfusion de 25 à 50 mg après la chirurgie, sur une période de 15 minutes à 1 heure, suivie d’une perfusion continue d’environ 5 mg par heure, jusqu’à une dose maximale de 150 mg par 24 heures.
des perfusions intraveineuses doivent être effectuées immédiatement après la préparation des solutions de perfusion. Les Solutions préparées pour la perfusion ne doivent pas être conservées. Seules des solutions claires doivent être utilisées; si des cristaux ou une précipitation de la solution sont observés, la perfusion ne doit pas être administrée., Le diclofénac sodique solution injectable ne doit pas être administré par perfusion intraveineuse en bolus. L’administration de diclofénac solution injectable chez les enfants n’est pas recommandée.
manifestations et prise en charge du surdosage ou de la prise accidentelle: le traitement de l’intoxication aiguë avec des anti-inflammatoires non stéroïdiens consiste en des mesures de soutien et symptomatiques. Un tableau clinique typique après un surdosage en diclofénac n ‘ est pas connu.,
mesures thérapeutiques en cas de surdosage: mesures de soutien et symptomatiques contre les complications telles que l’hypotension, l’insuffisance rénale, les convulsions, l’irritation gastro-intestinale et la dépression respiratoire. Les traitements spécifiques tels que la diurèse forcée, la dialyse ou l’hémoperfusion, sont probablement peu utiles pour éliminer les anti-inflammatoires non stéroïdiens en raison de leur taux élevé de fixation des protéines et de leur métabolisme étendu.
recommandations de conservation:
conserver à une température ambiante ne dépassant pas 30°C et dans un endroit sec.,
légendes protectrices:
littérature médicale exclusive. Sa vente
ordonnance. Ne le laissez pas à la portée des enfants. Ne pas utiliser pendant la grossesse, l’allaitement ou chez les enfants de moins de 12 ans.
nom et adresse du laboratoire:
Voir présentation (s).
présentation:
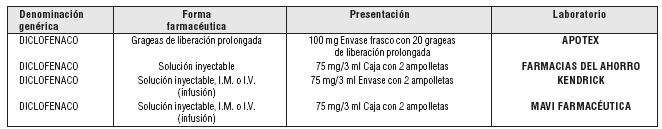

Source: S.A.S. Catalogue des médicaments génériques interchangeables pour les pharmacies et le grand public 3 août 2007.,
afin de démontrer l’interchangeabilité visée à l’Article 75 du Règlement sur les intrants sanitaires, les médicaments qui composent
Le Catalogue des médicaments génériques interchangeables ont été comparés, suivant les lignes directrices indiquées par le NOM-177SSA1-1998,
contre les produits innovants ou de référence énumérés aux pages 11 à 22 où vous pouvez le consulter.