Simple Anatomie de la Rétine par Helga Kolb
Helga Kolb
1. Aperçu.
lorsqu’un ophtalmologiste utilise un ophtalmoscope pour regarder dans votre œil, il voit la vue suivante de la rétine (Fig. 1).

au centre de la rétine se trouve le nerf optique, une zone blanche circulaire à ovale mesurant environ 2 x 1,5 mm de diamètre. Du centre du nerf optique rayonne les principaux vaisseaux sanguins de la rétine. Environ 17 degrés (4.,5-5 mm), ou deux et demi diamètres de disque à gauche du disque, peut être vu la tache rougeâtre légèrement ovale, sans vaisseau sanguin, la fovea, qui est au centre de la zone connue sous le nom de macula par les ophtalmologistes.
Fig. 1. Rétine vue à travers un opthalmoscope
Cliquez ici pour voir une animation (de l’iris à la rétine) (film Quicktime)
un champ circulaire d’environ 6 mm autour de la fovéa est considéré comme la rétine centrale tandis qu’au-delà se trouve la rétine périphérique s’étendant jusqu’à l’Ora serrata, à 21 mm du centre de la rétine (fovéa)., La rétine totale est un disque circulaire de 30 à 40 mm de diamètre (Polyak, 1941; Van Buren, 1963; Kolb, 1991).
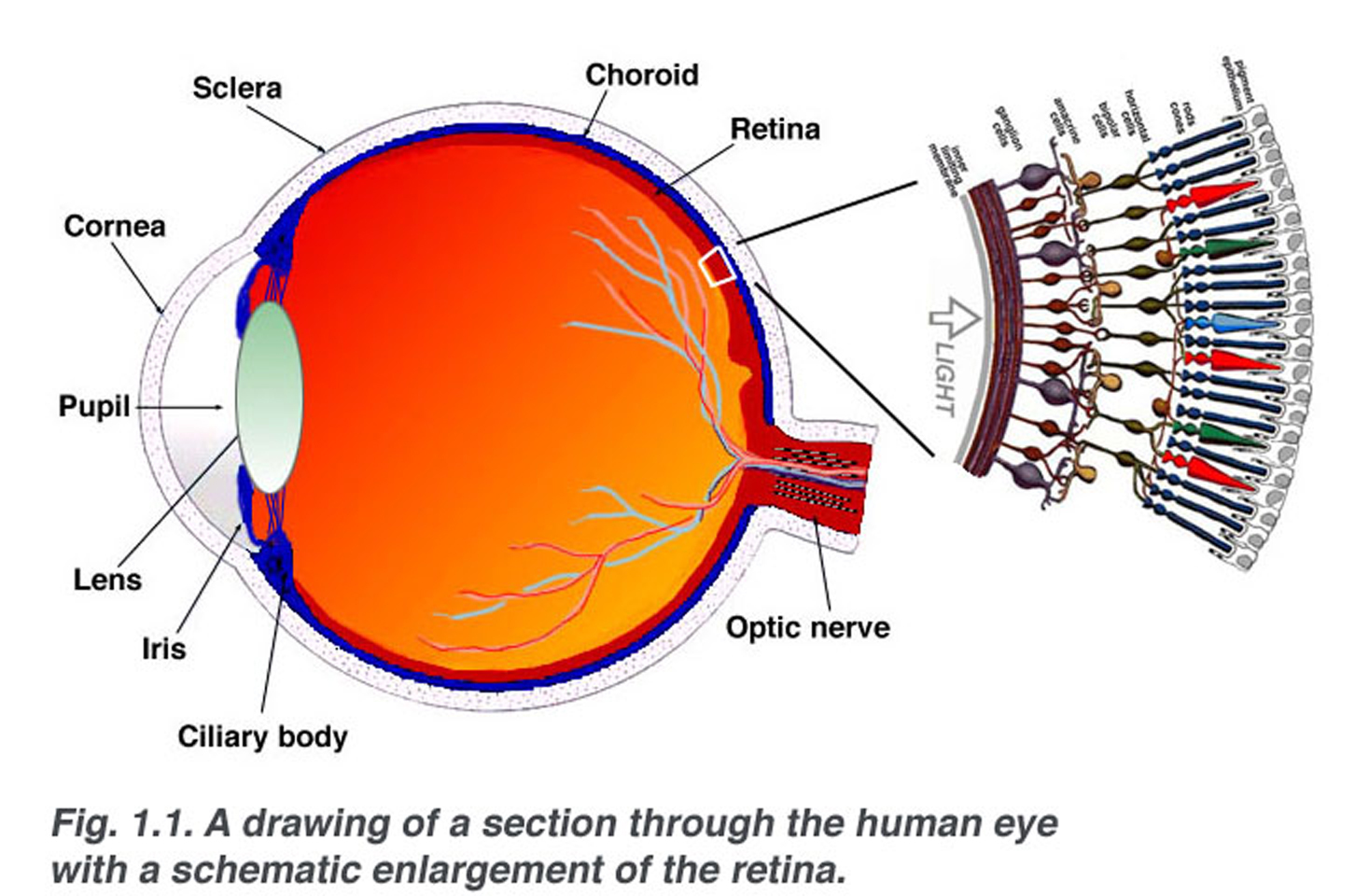
Fig. 1.1. Une section schématique à travers l’œil humain avec un élargissement schématique de la rétine
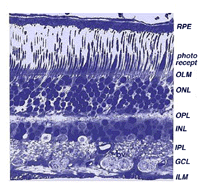
la rétine a une épaisseur d’environ 0,5 mm et tapisse l’arrière de l’œil. Le nerf optique contient les axones des cellules ganglionnaires qui se dirigent vers le cerveau et, en outre, les vaisseaux sanguins entrants qui s’ouvrent dans la rétine pour vasculariser les couches rétiniennes et les neurones (Fig. 1.1)., Une section radiale d’une partie de la rétine révèle que les cellules ganglionnaires (les neurones de sortie de la rétine) se trouvent le plus à l’intérieur de la rétine la plus proche du cristallin et de l’avant de l’œil, et que les photocapteurs (les bâtonnets et les cônes) se trouvent le plus à l’extérieur de la rétine contre La lumière doit donc traverser l’épaisseur de la rétine avant de frapper et d’activer les bâtonnets et les cônes (Fig. 1.1)., Par la suite, l’absorption des photons par le pigment visuel des photorécepteurs se traduit d’abord par un message biochimique puis par un message électrique qui peut stimuler tous les neurones successifs de la rétine. Le message rétinien concernant l’entrée photique et une certaine organisation préliminaire de l’image visuelle en plusieurs formes de sensation sont transmis au cerveau à partir du modèle de décharge de pointe des cellules ganglionnaires.,
un schéma de câblage simpliste de la rétine met l’accent uniquement sur les photorécepteurs sensoriels et les cellules ganglionnaires avec quelques interneurones reliant les deux types de cellules comme on le voit sur la Figure 2.
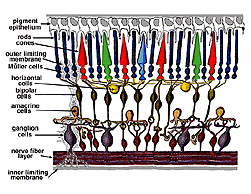
Fig. 2., Organisation Simple de la rétine
Lorsqu’un anatomiste prend une section verticale de la rétine et la traite pour examen microscopique, il devient évident que la rétine est beaucoup plus complexe et contient beaucoup plus de types de cellules nerveuses que le schéma simpliste (ci-dessus) l’avait indiqué. Il est immédiatement évident qu’il existe de nombreux interneurones entassés dans la partie centrale de la section de la rétine intervenant entre les photorécepteurs et les cellules ganglionnaires (Fig 3).,

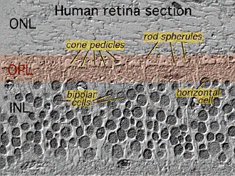
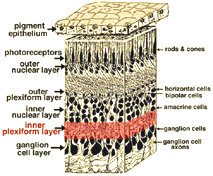
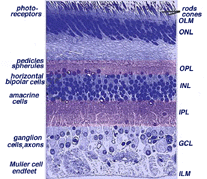
Tous les vertébrés des rétines sont composées de trois couches de cellules nerveuses des organes et deux couches de synapses (Fig. 4). La couche nucléaire externe contient des corps cellulaires des bâtonnets et des cônes, la couche nucléaire interne contient des corps cellulaires des cellules bipolaires, horizontales et amacrines et la couche cellulaire ganglionnaire contient des corps cellulaires de cellules ganglionnaires et de cellules amacrines déplacées. La division de ces couches de cellules nerveuses sont deux neuropils où des contacts synaptiques se produisent (Fig. 4).,
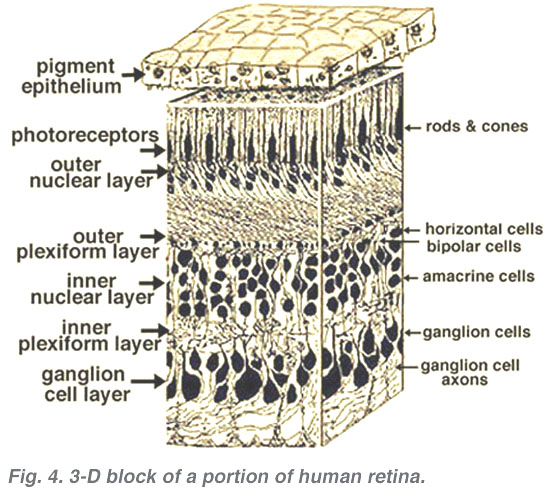
la première zone de neuropil est la couche plexiforme externe (OPL) où les connexions entre la tige et les cônes, et les cellules bipolaires fonctionnant verticalement et les cellules horizontales orientées horizontalement se produisent (fig. 5 et 6).
|
|
|
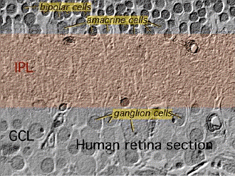
le deuxième neuropile de la rétine, est la couche plexiforme interne (IPL), et il fonctionne comme une station de relais pour les cellules nerveuses porteuses d’informations verticales, les cellules bipolaires, pour se connecter aux cellules ganglionnaires (fig. 7 et 8). En outre, différentes variétés de cellules amacrines orientées horizontalement et verticalement interagissent en quelque sorte dans d’autres réseaux pour influencer et intégrer les signaux des cellules ganglionnaires., C’est au point culminant de tout ce traitement neuronal dans la couche plexiforme interne que le message concernant l’image visuelle est transmis au cerveau le long du nerf optique.
|
|
|
2. Rétine centrale et périphérique comparée.,
la rétine centrale proche de la fovéa est considérablement plus épaisse que la rétine périphérique (voir fig. 9 et 10). Ceci est dû à l’augmentation de la densité d’emballage des photorécepteurs, en particulier des cônes, et de leurs cellules bipolaires et ganglionnaires associées dans la rétine centrale par rapport à la rétine périphérique.
|
|
|
- la rétine centrale est dominée par des cônes alors que la rétine périphérique est dominée par des bâtonnets. Ainsi, dans la rétine centrale, les cônes sont étroitement espacés et les bâtonnets moins nombreux entre les cônes(Fig. 9 et 10).
- la couche nucléaire externe (ONL), composée des corps cellulaires des bâtonnets et des cônes, a à peu près la même épaisseur dans la rétine centrale et périphérique., Cependant, dans le périphérique, les corps de cellules de tige sont plus nombreux que les corps de cellules de cône, tandis que l’inverse est vrai pour la rétine centrale. Dans la rétine centrale, les cônes ont des axones obliques déplaçant leurs corps cellulaires de leurs pédicules synaptiques dans la couche plexiforme externe (BPO). Ces axones obliques, associés aux processus cellulaires de Muller, forment une zone d’aspect fibreux à coloration pâle connue sous le nom de couche de fibres de Henle. Cette dernière couche est absente dans la rétine périphérique.,
- la couche nucléaire interne (INL) est plus épaisse dans la zone centrale de la rétine par rapport à la rétine périphérique, en raison d’une plus grande densité de neurones de second ordre coniques (cellules bipolaires à cône) et de cellules horizontales à plus petit champ et plus rapprochées et de cellules amacrines concernées par les voies du cône (Fig. 9). Comme nous le verrons plus tard, les circuits de neurones connectés aux cônes sont moins convergents en ce sens que moins de cônes empiètent sur les neurones du second ordre que les bâtonnets dans les voies connectées aux bâtonnets.,
- une différence remarquable entre la rétine centrale et la rétine périphérique peut être observée dans les épaisseurs relatives des couches plexiformes internes( IPL), des couches de cellules ganglionnaires (GCL) et de la couche de fibres nerveuses (NFL) (Figs. 9 et 10). Ceci est encore dû au plus grand nombre et à l’augmentation de la densité d’emballage des cellules ganglionnaires nécessaires pour les voies de cône dans la rétine fovéale à dominante conique par rapport à la rétine périphérique à dominante bâtonnière., Le plus grand nombre de cellules ganglionnaires signifie plus d’interaction synaptique dans un IPL plus épais et un plus grand nombre d’axones de cellules ganglionnaires se dirigeant vers le nerf optique dans la couche de fibres nerveuses (Fig. 9).
3. Cellules gliales de Muller.
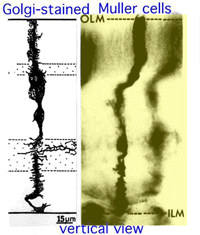
Fig. 11. Vue verticale des cellules gliales de Muller colorées par Golgi
les cellules de Muller sont les cellules gliales radiales de la rétine (Fig. 11). La membrane limitante externe (OLM) de la rétine est formée de jonctions d’adherens entre les cellules de Muller et les segments internes des cellules photoréceptrices., La membrane limitante interne (ILM) de la rétine est également composée de pieds d’extrémité de la cellule de Muller en contact latéral et de constituants membranaires basaux associés.
L’OLM forme une barrière entre l’espace sous-rétinien, dans lequel les segments interne et externe des photorécepteurs projettent d’être en étroite association avec la couche épithéliale pigmentaire derrière la rétine, et la rétine neurale proprement dite. L’ILM est la surface interne de la rétine bordant l’humeur vitrée et formant ainsi une barrière de diffusion entre la rétine neurale et l’humeur vitrée (Fig. 11).,
dans toute la rétine, les principaux vaisseaux sanguins de la rétine alimentent les capillaires qui pénètrent dans le tissu neural. Les capillaires traversent toutes les parties de la rétine, de la couche de fibres nerveuses à la couche plexiforme externe et même parfois aussi haut que dans la couche nucléaire externe. Les nutriments provenant du système vasculaire du choriocapillaris (cc) derrière la couche d’épithélium pigmentaire fournissent la délicate couche de photorécepteur.
4. Fovéale de la structure.,
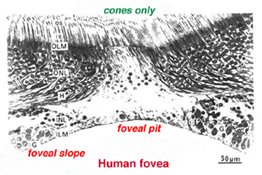
le centre de la fovéa est connu sous le nom de fosse fovéale (Polyak, 1941) et est une région hautement spécialisée de la rétine différente encore une fois de la rétine centrale et périphérique que nous avons considérée jusqu’à présent. Les sections radiales de cette petite région circulaire de la rétine mesurant moins d’un quart de millimètre (200 microns) sont présentées ci-dessous pour l’homme (Fig. 12a) et pour le singe (fig.12b).
|
|
|
fovéa se trouve au milieu de la région maculaire de la rétine à l’aspect temporel de la tête du nerf optique (Fig. 13, a, A, B)., C’est une zone où les photorécepteurs coniques sont concentrés à la densité maximale, à l’exclusion des tiges, et disposés à leur densité d’emballage la plus efficace qui est dans une mosaïque hexagonale. Ceci est plus clairement visible dans une section tangentielle à travers les segments internes du cône fovéal (Fig. 13b).
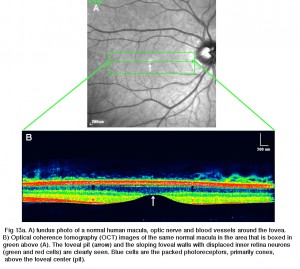
Fig 13a. a) photo du fond d’œil d’une macula humaine normale, d’un nerf optique et de vaisseaux sanguins autour de la fovéa. B) tomographie par cohérence optique (OCT) images de la même maculaire normale dans la zone qui est en Vert ci-dessus (A)., La fosse fovéale (flèche) et les parois fovéales inclinées avec des neurones de la rétine interne dissipés (cellules vertes et rouges) sont clairement visibles. Les cellules bleues sont les photorécepteurs emballés, principalement des cônes, au-dessus du centre fovéal (fosse).

Fig. 13. Section tangentielle à travers la fovéa humaine
en dessous de cette fosse fovéale centrale de 200 microns de diamètre, les autres couches de la rétine sont déplacées de manière concentrique ne laissant que la plus fine feuille de rétine constituée des cellules du cône et de certains de leurs corps cellulaires (côtés droit et gauche des Figs., 12a et 12b). Ceci est particulièrement bien vu dans les images de tomographie par cohérence optique (OCT) de l’œil vivant et de la rétine (Fig. 13a, B). La stratification radialement déformée mais complète de la rétine apparaît alors progressivement le long de la pente fovéale jusqu’à ce que le bord de la fovée soit constitué des neurones déplacés du deuxième et du troisième ordre liés aux cônes centraux. Ici, les cellules ganglionnaires sont empilées en six couches, ce qui fait de cette zone, appelée jante fovéale ou parafovée (Polyak, 1941), la partie la plus épaisse de toute la rétine.
5. Macula lutea.,
toute la zone fovéale, y compris la fosse fovéale, la pente fovéale, la parafovée et la périfovée, est considérée comme la macula de l’œil humain. Familier aux ophtalmologistes est une pigmentation jaune à la zone maculaire connue sous le nom de macula lutea (Fig. 14).
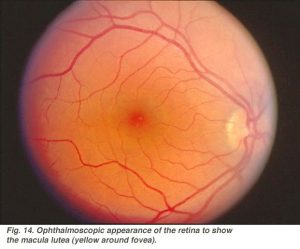 cette pigmentation est le reflet de pigments de criblage jaunes, les caroténoïdes xanthophylles zéaxanthine et lutéine (Balashov et Bernstein, 1998), présents dans les axones coniques de la couche de fibres de Henle. On pense que la macula lutea agit comme un filtre à courte longueur d’onde, en plus de celui fourni par la lentille (Rodieck, 1973)., Comme la fovéa est la partie la plus essentielle de la rétine pour la vision humaine, des mécanismes de protection pour éviter la lumière vive et en particulier les dommages causés par l’irradiation ultraviolette sont essentiels. Car, si les cônes délicats de notre fovéa sont détruits, nous devenons aveugles.
cette pigmentation est le reflet de pigments de criblage jaunes, les caroténoïdes xanthophylles zéaxanthine et lutéine (Balashov et Bernstein, 1998), présents dans les axones coniques de la couche de fibres de Henle. On pense que la macula lutea agit comme un filtre à courte longueur d’onde, en plus de celui fourni par la lentille (Rodieck, 1973)., Comme la fovéa est la partie la plus essentielle de la rétine pour la vision humaine, des mécanismes de protection pour éviter la lumière vive et en particulier les dommages causés par l’irradiation ultraviolette sont essentiels. Car, si les cônes délicats de notre fovéa sont détruits, nous devenons aveugles.
Fig. 14. Ophtalmoscopiques apparence de la rétine pour montrer macula lutea

Fig. 15. Section verticale à travers la fovea de singe pour montrer la distribution de la macula lutea. De Snodderly et al.,, 1984
le pigment jaune qui forme la macula lutea dans la fovea peut être clairement démontré en regardant une section de la fovea au microscope avec de la lumière bleue (Fig. 15). Le motif sombre dans la fosse fovéale s’étendant jusqu’au bord de la pente fovéale est causé par la distribution du pigment maculaire (Snodderly et al., 1984).

Fig. 16., Apparence de la mosaïque de cônes dans la fovéa avec et sans macula lutea
Si l’on visualisait la mosaïque de photorécepteurs fovéaux comme si les pigments visuels des cônes individuels n’étaient pas blanchis, on verrait l’image présentée à la Figure 16 (cadre inférieur) (image de Lall et Cone, 1996). Les cônes sensibles à courte longueur d’onde sur la pente fovéale semblent vert jaune pâle, les cônes de longueur d’onde moyenne, roses et les cônes sensibles à longue longueur d’onde, violets., Si nous ajoutons maintenant l’effet du pigment de criblage jaune de la macula lutea, nous voyons l’apparition de la mosaïque du cône sur la Figure 16 (cadre supérieur). La macula lutea aide à améliorer la résolution achromatique des cônes fovéaux et bloque l’irradiation nocive de la lumière UV (Fig. 16 d’Abner Lall et Richard Cone, données non publiées).
6. Couche de fibres de cellules ganglionnaires.
les axones des cellules ganglionnaires courent dans la couche de fibres nerveuses au-dessus de la membrane limitante interne vers la tête du nerf optique sous une forme arquée (Fig. 00, flux de fibres roses)., La fovéa est, bien sûr, exempt d’une couche de fibres nerveuses que la rétine interne et les cellules ganglionnaires sont repoussés à la pente fovéale. Les fibres des cellules ganglionnaires centrales courent autour de la pente fovéale et balaient dans la direction du nerf optique. Les axones des cellules ganglionnaires périphériques poursuivent ce parcours en arc jusqu’au nerf optique avec une Division dorso / ventrale le long du méridien horizontal (Fig. 00). La topographie rétinienne est maintenue dans le nerf optique, à travers le géniculé latéral au cortex visuel.
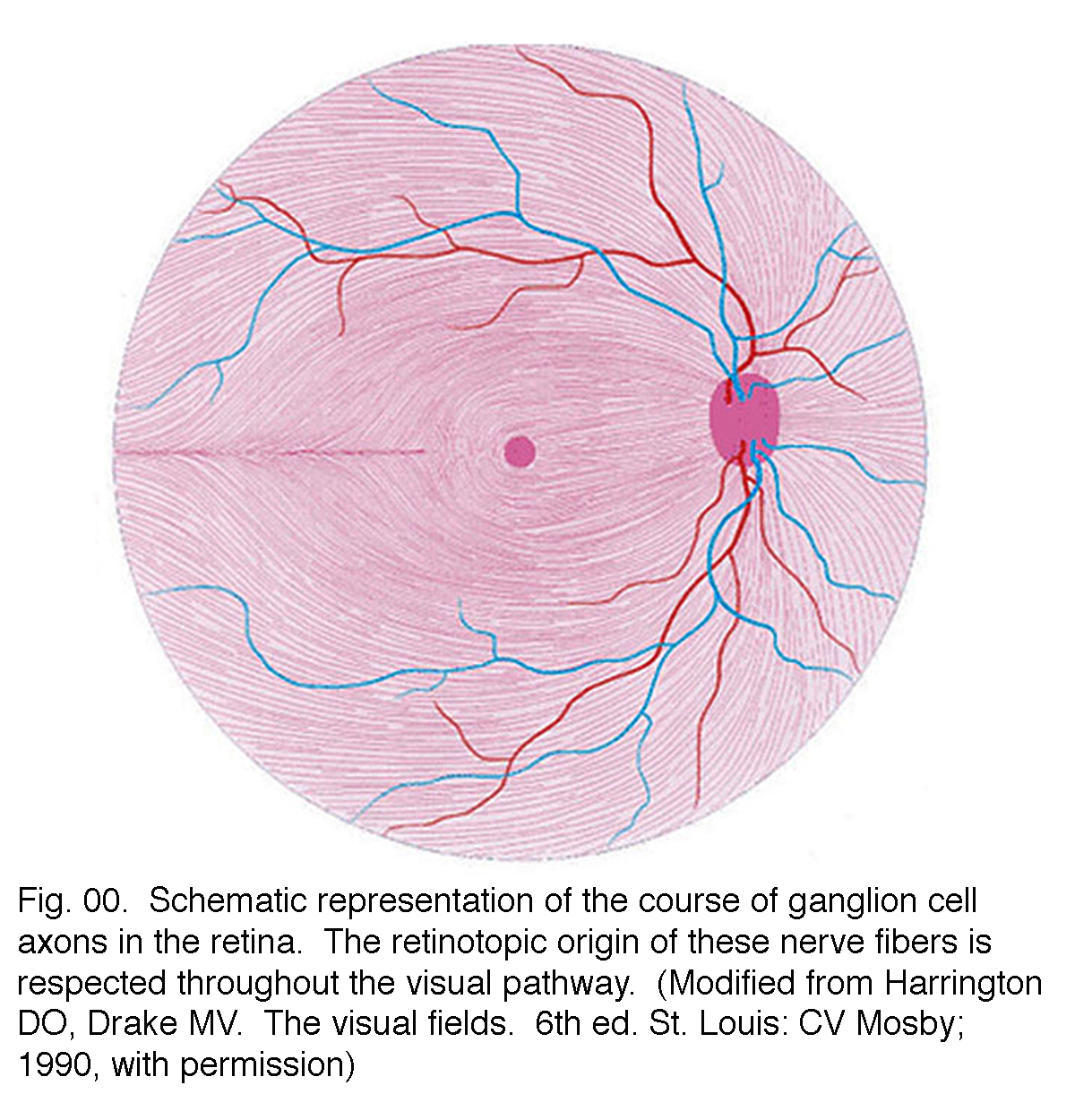
Fig. 00., Représentation schématique du cours des axones des cellules ganglionnaires dans la rétine. L’origine rétinotopique de ces fibres nerveuses est respectée tout au long de la voie visuelle. (Modifié de Harrington DO, Drake MV. Les champs visuels. 6e ed. Saint-Louis: CV Mosby; 1990, avec la permission)
7. L’approvisionnement en sang vers la rétine.
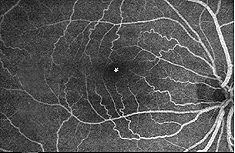
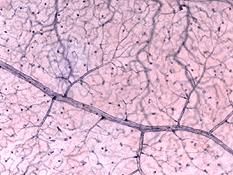
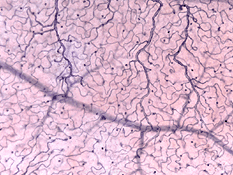
Il existe deux sources d’approvisionnement en sang de la rétine des mammifères: l’artère rétinienne centrale et les vaisseaux sanguins choroïdiens. La choroïde reçoit le plus grand flux sanguin (65-85%) (Henkind et al.,, 1979) et est vital pour le maintien de la rétine externe (en particulier les photorécepteurs) et les 20-30% restants s’écoulent vers la rétine à travers l’artère rétinienne centrale de la tête du nerf optique pour nourrir les couches rétiniennes internes. L’artère rétinienne centrale a 4 branches principales dans la rétine humaine (Fig. 17).
Fig. 17. Photographie du fond d’œil montrant l’imagerie flourescein des principales artères et veines dans une rétine normale de l’œil droit humain., Les vaisseaux émergent de la tête du nerf optique et courent de manière radiale en se courbant vers et autour de la fovéa (astérisque sur la photo) (Image reproduite avec L’aimable autorisation D’Isabel Pinilla, Espagne)
les branches intra-rétiniennes artérielles fournissent alors trois couches de réseaux capillaires à savoir 1) les capillaires péripapillaires radiaux (RPC) et 2) une couche interne et 3) une couche externe de capillaires (Fig. 18a). Les veinules précapillaires s’écoulent en veinules et à travers le système veineux correspondant jusqu’à la veine rétinienne centrale (Fig. 18b).,
|
|
|
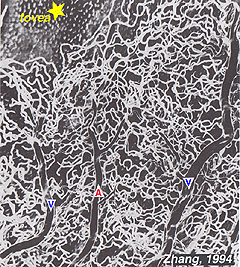
Les capillaires péripapillaires radiaux (RPC) sont la couche la plus superficielle de capillaires se trouvant dans la partie interne de la couche de fibres nerveuses, et courent le long des vaisseaux inférotemporaux à 4-5 mm du disque optique (Zhang, 1994). Les RPC s’anatomosent les uns avec les autres et les capillaires plus profonds. Les capillaires internes se trouvent dans les couches de cellules ganglionnaires sous et parallèlement aux RPC., Le réseau capillaire externe va de la couche plexiforme interne à la couche plexiforme externe pensée la couche nucléaire interne (Zhang, 1974).
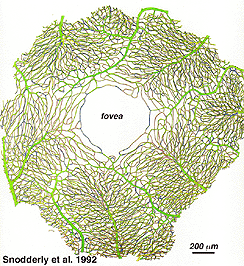
comme on le remarquera à partir de l’angiographie flourescein de la Figure 17, Il y a un anneau de vaisseaux sanguins dans la région maculaire autour d’une zone sans vaisseaux sanguins et capillaire de 450-600 um de diamètre, indiquant la fovea. Les vaisseaux maculaires proviennent de branches des artères temporales supérieures et inférotemporales. À la frontière de la zone avasculaire, les capillaires deviennent deux couches et se rejoignent finalement comme un anneau monocouche., Les veinules collectrices sont plus profondes (postérieures) aux artérioles et drainent le flux sanguin vers les veines principales (Fig. 19, de Zhang, 1974). Chez le singe rhésus, cette fovéa sans anneau périmaculaire et sans vaisseau sanguin est clairement visible dans les beaux dessins réalisés par le groupe de Max Snodderly (fig. 20, Sodderly et coll., 1992.)
|
|
|
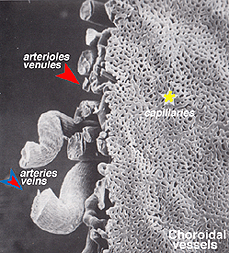
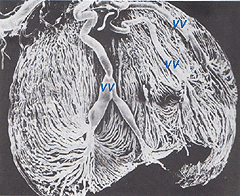
les artères choroïdiennes proviennent des artères ciliaires postérieures longues et courtes et des branches du cercle de Zinn (autour du disque optique)., Chacune des artères ciliaires postérieures se décompose en lobules capillaires en forme d’éventail qui alimentent des régions localisées de la choroïde (Hayreh, 1975). La zone maculaire des vaisseaux choroïdiens n’est pas spécialisée comme l’est l’apport sanguin rétinien (Zhang, 1994). Les artères percent la sclérotique autour du nerf optique et s’étirent pour former les trois couches vasculaires de la choroïde: les couches externes (la plus sclérale), médiales et internes (la membrane de Bruchs la plus proche de l’épithélium pigmentaire) des vaisseaux sanguins. Ceci est clairement montré dans le moulage par corrosion d’une face coupée de la choroïde humaine sur la Figure 21a (Zhang, 1974)., Les lobules veineux correspondants s’écoulent dans les veinules et les veines antérieures vers l’Équateur du globe oculaire pour entrer dans les veines vortex (Fig. 21b). Une ou deux veines vortex drainent chacun des 4 quadrants du globe oculaire. Les veines vortex pénètrent dans la sclérotique et se fondent dans la veine ophtalmique comme le montre le moulage par corrosion de la Figure 21b (Zhang. 1994).
|
|
|
8., Maladies dégénératives de la rétine humaine.
la rétine humaine est une organisation délicate des neurones, des gliales et des vaisseaux sanguins nourrissants. Dans certaines maladies oculaires, la rétine est endommagée ou compromise, et des changements dégénératifs se produisent qui entraînent de graves dommages aux cellules nerveuses qui transportent les mésages vitaux de l’image visuelle vers le cerveau. Nous indiquons quatre conditions différentes où la rétine est malade et la cécité peut être le résultat final. Beaucoup plus d’informations concernant la pathologie de l’œil entier et de la rétine peuvent être trouvées dans un site web créé par le pathologiste oculaire Dr., Nick Mamalis, Centre Des Yeux Moran.
|
|
|
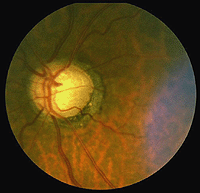
La dégénérescence maculaire liée à l’âge est un problème rétinien courant de l’œil vieillissant et l’une des principales causes de cécité dans le monde. La zone maculaire et la fovéa deviennent compromises en raison de la dégénérescence de l’épithélium pigmentaire derrière la rétine et de la formation de drusen (taches blanches, Fig. 22) et permettant une fuite de fluide derrière la fovéa. Les cônes de la fovéa meurent causant une perte visuelle centrale, de sorte que nous ne pouvons pas lire ou voir les détails fins.
le Glaucome (Fig., 23) est également un problème courant dans le vieillissement, où la pression dans l’œil devient élevée. La pression augmente parce que la chambre antérieure de l’œil ne peut pas échanger correctement le liquide par les méthodes normales d’écoulement aqueux. La pression dans la chambre Vitréenne augmente et compromet les vaisseaux sanguins de la tête du nerf optique et éventuellement les axones des cellules ganglionnaires, de sorte que ces cellules vitales meurent. Traitement pour réduire la pression intraoculaire est essentiel dans le glaucome.
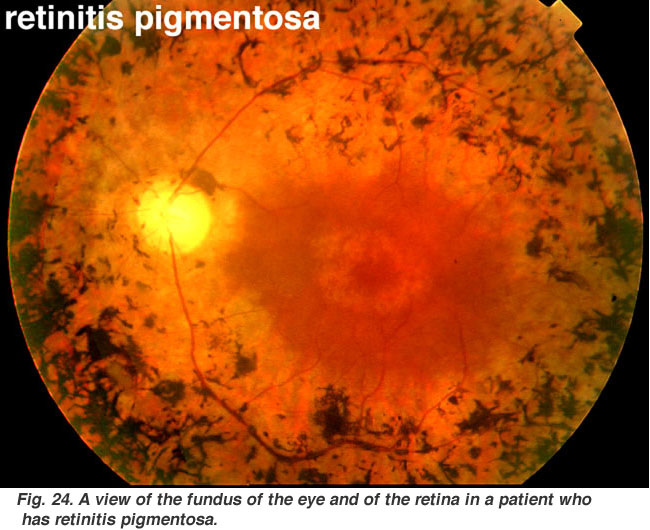
Fig. 24., Vue du fond de l’œil et de la rétine chez un patient qui a une rétinite pigmentaire |
|
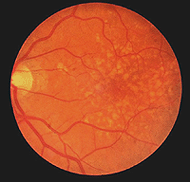
rétinites pigmentaires (Fig. 24) est une maladie héréditaire désagréable de la rétine pour laquelle il n’y a pas de remède à l’heure actuelle. Il se présente sous de nombreuses formes et se compose d’un grand nombre de mutations génétiques actuellement analysées., La plupart des gènes défectueux qui ont été découverts concernent les photorécepteurs de la tige. Les bâtonnets de la rétine périphérique commencent à dégénérer dans les premiers stades de la maladie. Les Patients deviennent aveugles de nuit progressivement à mesure que de plus en plus de la rétine périphérique (où résident les bâtonnets) est endommagée. En fin de compte, les patients sont réduits à une vision tunnel, seule la fovéa étant épargnée par le processus de la maladie. La pathologie caractéristique est l’apparition de pigment noir dans la rétine périphérique et de vaisseaux sanguins amincis au niveau de la tête du nerf optique (Fig. 24).,
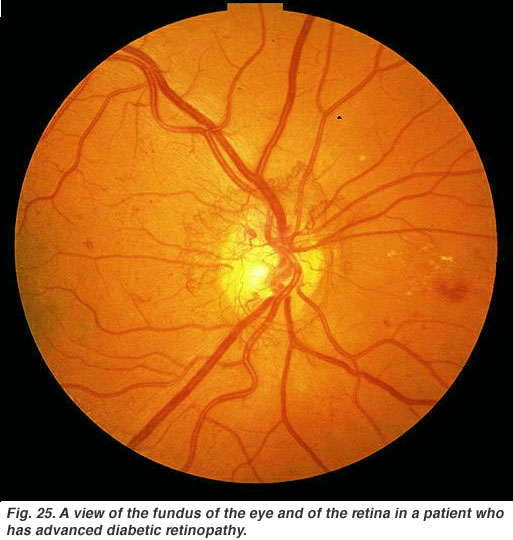
La rétinopathie diabétique est un effet secondaire du diabète qui affecte la rétine et peut provoquer la cécité (Fig. 25). Les vaisseaux sanguins vitaux nourrissants de l’œil deviennent compromis, déformés et se multiplient de manière incontrôlable. Le traitement au Laser pour arrêter la prolifération des vaisseaux sanguins et la fuite de liquide dans la rétine est le traitement le plus courant à l’heure actuelle.
9. Référence.
Balashov NA, Bernstein PS. Purification et identification des composants des voies du métabolisme caroténoïde maculaire humain. Investir Ophthal Vis Sci.1998; 39: s38.
Hageman GS, Johnson LV., L’interface épithélium pigmenté photorécepteur-rétinien. Dans: HECKENLIVELY JR, Arden GB, éditeurs. Principes et pratique de l’électrophysiologie clinique de la vision. Saint-Louis: Annuaire Mosby; 1991. p. 53-68.
Harrington, D. O. et Drake, M. V. (1990) les champs visuels, 6e éd. Mosby. De Saint-Louis.
Hayreh SS. Nature segmentaire du système vasculaire choroïdien. Br J Ophthal. 1975;59:631–648.
Kolb H. l’organisation neuronale de la rétine humaine. Dans: HECKENLIVELY JR, Arden GB, éditeurs. Principes et pratiques de l’électrophysiologie clinique de la vision. Saint-Louis: Annuaire Mosby Inc.; 1991., p. 25-52.
Polyak SL. Rétine. Chicago: University of Chicago Press, 1941.
Rodieck RW. La rétine des vertébrés: principes de structure et de fonction. San Francisco: W. H. Freeman et de l’Entreprise; 1973.
Snodderly DM, Auran JD, DELORI FC. Le pigment maculaire. II. distribution spatiale dans la rétine des primates. Investir Ophthal Vis Sci. 1984;25:674–685.
Snodderly DM, Weinhaus RS, Choi JC. La neuro-vasculaire relations dans le centre de la rétine de singes Macaques (Macaca fascicularis). J Neurosci. 1992;12:1169–1193.
Van Buren JM. La couche cellulaire ganglionnaire rétinienne., Il est le fils de Charles C. Thomas (1963).
Yamada E. Certaines caractéristiques structurelles de la fovea centralis dans la rétine humaine. Arch Ophthal. 1969;82:151–159.
Zhang RH. Scanning electron microscope étude de la corrosion projette sur la rétine et de la choroïde angioarchitecture l’homme et les animaux. Prog Ret Œil Rés. 1994;13:243-270.