Újszülöttkori hipoxiás-ischaemiás encephalopathia | Anales de Pediatría kombinált terápiája (angol kiadás)
Bevezetés
1000 teljes születésenként 1-3 eset előfordulásával az 1 hipoxiás-ischaemiás encephalopathia (HIE) az újszülöttek agykárosodásának egyik leggyakoribb oka. Figyelembe véve a magas kockázatú születések növekvő számát az anyai életkor növekvő tendenciái és a többes terhesség gyakorisága miatt, a HIE továbbra is releváns probléma a kórházi környezetben, amelyre még nincs végleges megoldás.,
A perinatális asphyxia patofiziológiájával kapcsolatos kutatások lehetővé tették számunkra, hogy megértsük azt a komplex folyamatot, amely a sejtek és a szövetek szintjén zajlik, mivel az agykárosodás oxigénhiány miatt alakul ki. A sérülések számos érintett mechanizmusát a fejlődésükhöz eltelt idő alapján csoportosítják, és 4 fő fázist írtak le (ábra. 1): a hypoxiás ischaemia (HI) primer fázisa vagy akut epizódja, látens fázis, másodlagos fázis és harmadlagos fázis., Az elsődleges fázisban a károsodás a sejtek és szövetek oxigénellátásának csökkenéséből ered, ami primer energiahiányhoz vezet. Ezt követi a nagy energiájú foszforilált vegyületek, a látens fázis néven ismert szintjének nyilvánvaló helyreállítása., Azonban ez a javulás csak átmeneti, illetve adja, így a másodlagos szakasz, amikor sok a pathophysiological mechanizmusok kidolgozásában részt vevő agyi károsodás újszülött jön a képbe, főnök, amelyek excitotoxicity, a tömeges beáramlása a kalcium ionok a sejtek oxidatív stressz, gyulladás, illetve a legtöbb esetben, a sejt halála miatt elhalás, vagy apoptózis. Végül is a harmadlagos fázist az agykárosodás hetekkel, hónapokkal vagy akár évekkel a kezdeti hipoxiás-ischaemiás inzultus után is fennállása jellemzi.,
a HIE alapvető patofiziológiájának megértése lehetővé tette olyan potenciális terápiás célok azonosítását, amelyek segíthetnek csökkenteni az asphyxia által okozott agykárosodást, valamint számos kezelési stratégia kidolgozását. Ezeknek a kezeléseknek egy része, jelenleg a vizsgálatokban, szinergikusan működik a terápiás hipotermiával, az egyetlen HIE elleni kezeléssel, amelyet általában az újszülött intenzív ellátásban fogadtak el.,
hipotermia
a hipotermiát neuroprotektív stratégiaként kezdték használni csecsemőknél, miután felfedezték az endogén hűtési mechanizmust, amely olyan csecsemőknél jelentkezik, akik születéskor valamilyen sérülést szenvedtek.2 neuroprotektív hatásai elsősorban az agy metabolikus aktivitásának csökkenésével kapcsolatosak, 5% – kal minden 1°C-os hőmérséklet-csökkenéssel, 3 amely modulálja az asphyxia által kiváltott káros anyagcsere-útvonalakat, amelyeket az ábra foglal össze. 2.
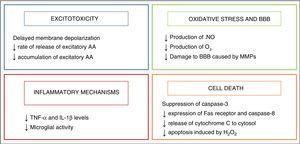
a hipotermia hatása az agykárosodás mechanizmusaira.
Kombinációs terápia
Mivel a bizonyítékok arra utalnak, hogy a jelenlegi hypothermia protokoll optimal4 még korlátozott hatékonyságát klinikai gyakorlatban,5 ki kell terjesztenünk vagy terápiás armamentarium a menedzsment GYORSAN.,6 a legújabb kutatások a hipotermiával kombinációban alkalmazható kezelések kifejlesztésére és végrehajtására összpontosítottak, amelyek célja a patofiziológiai kaszkád különböző szintjein való fellépés, valamint mindkét terápia szinergiájának előmozdítása (ábra. 3).

lehetséges terápiás célok és fő neuroprotektív stratégiák, amelyek jelenleg az újszülöttkori HIE kezelésére irányuló kísérletek tárgyát képezik.
Melatonin
Melatonin (N-acetil-5-metoxitriptamina) a tobozmirigy által szintetizált neurohormon, amelynek szekréciója éjszakai / napos ciklust követ, és amelynek fő szerepe a cirkadián ritmus szabályozásában van. A HIE kezelésében való alkalmazását lehetővé tevő kulcsfontosságú szempontok az erős antioxidáns és gyulladáscsökkentő hatása7, valamint a vér–agy gáton való átjutás és a központi idegrendszer elérése.,8
mielőtt újszülötteknél kipróbálták volna, a melatonin bizonyítottan növeli a hipotermia által nyújtott védelem szintjét az agy energia metabolizmusának optimalizálása révén az asphyxia malacmodelljében.9 a klinikai környezetben, a tanulmány által közzétett Aly et al.10 a megfulladt újszülöttek felét hipotermiára, 5 adag 10 mg/kg/nap melatonint pedig orális úton juttatták el., A szerzők a kombinált terápiával kezelt betegeknél a szuperoxid-diszmutáz és a nitrogén-monoxid szérumszintjének csökkenését tapasztalták az önmagában hűtéssel kezelt betegekhez képest, ezáltal bizonyítva mindkét stratégia oxidatív stressz elleni kombinációjának kedvező hatásait.
a Balduini et al., hogy értékelje a biztonsági, farmakokinetika, adagolás, illetve hatékonyságát melatonin kombinálva használják hypothermia megállapította, hogy a hűtő nem volt hatással a farmakokinetika melatonin11 meg, hogy lehetséges, hogy szerezzen magas szérum hormon beadása adag, ami alacsonyabb volt, mint azok, használt kísérleti modellek. Jelenleg a MELPRO (NCT03806816) klinikai vizsgálat a betegeket toborozza, amelynek célja 100 újszülött mintája., Ez és más hasonló vizsgálatok elengedhetetlenek a III. fázisú klinikai vizsgálatok jövőbeli fejlődéséhez, valamint a melatonin későbbi alkalmazásához a mindennapi klinikai gyakorlatban.
Allopurinol
az allopurinol HIE kezelésében történő alkalmazásának indoka a xantin-oxidázra, az oxidatív stresszben részt vevő enzimre gyakorolt gátló hatása. Ezen túlmenően, ez a gyógyszer működik, mint egy szabad – vas kelátképző és sequesters hidroxil gyökök.,12,13 A preklinikai tanulmány a patkány kölykök, ahol az állatok elkülönített 1 5 csoportban (kontroll csoport, HI-csoport, csoport kezelt hypothermia, csoport kezelt allopurinol, illetve kezelt csoport a kombinált kezelés) megállapította, hogy 72h után a HI sértés, a kombinációs terápia csoportos kiállításra a legalacsonyabb infarktus kötet.,14
Amikor a farmakológiai jellemzők, allopurinol gyorsan át a placentán elérni a terápiás koncentráció újszülött, amint azt a tanulmány szerint a terhes nők, akik megkapták 500mg allopurinol intravénásan, a bizonyíték, hogy optimális szinten allopurinol 5perc később a köldökzsinór vér minták.15 A van Bel et al., 1998-ban, hogy elemezte a potenciális antioxidáns hatása fulladásos újszülöttek súlyos HIE megállapította, hogy az intravénás beadása 40mg / kg allopurinol elérte a kialakulását a szabad gyökök.13 azonban egy tanulmány, amelyet később a Benders et al. 2006-ban nem találtak különbséget az allopurinollal kezelt csoport és a kontrollcsoport között.16 a következtetésekben ezek a szerzők a mintában szereplő újszülöttekben a HIE szélsőséges súlyosságát azonosították a jelentős különbségek hiányának lehetséges magyarázataként., Feltételezték azt is, hogy az allopurinol (3–4h a reperfúzió után) alkalmazásához eltelt idő túl hosszú lehetett ahhoz, hogy kedvező eredményeket érjen el. Az utóbbi ponttal kapcsolatban, Gunes et al. ugyanazt az allopurinol adagot adta be a 2 korábbi vizsgálatban, de a születéstől számított 2 órán belül, és javulást talált a neurodevelopmentális eredményekben a kezelési csoportban.,17 ugyanezen vonalak mentén az intravénás allopurinol beadása az anyáknak a hypoxia vagy a kezdeti hipoxia esetén a magzatok szállítása során növelte a kezelés hatékonyságát, csökkentve az S-100β fehérje vérszintjét, ami az agykárosodás markere.18 jelenleg folyamatban van egy klinikai vizsgálat az Allopurinol hypoxiás-ischaemiás agyi sérülés neurokognitív kimenetelre gyakorolt hatására (NCT03162653), hogy felmérjék ennek az enzimgátlónak a lehetséges terápiás hatásait a születés utáni első percekben.,
eritropoetin
az eritropoetin (EPO) egy 30, 4 kDa-t mérő citokin, amelyet a máj szintetizál a magzati életben és születés után a vese és a fejlődő agy, ahol növekedési faktorként és neuroprotektív szerként hat.19 mind az EPO, mind a rekombináns humán EPO (rhEPO) alkalmazása a HIE-ben a neuronokban és a glia-ban jelen lévő EPO receptorok aktivitásán alapul, 20 erős antiapoptotikus szerként (a Bcl-2 és BCL-XL antiapoptotikus gének transzkripciójának stimulálása), valamint gyulladásgátló és antioxidáns.,19,21 a neuroprotektív hatás mellett az EPO elősegítheti a hosszú távú javítási folyamatokat, például az angiogenezist, az oligodendrogenezist és a neurogenezist.22,23
preklinikai vizsgálatok, amelyek az EPO vagy rhEPO hipotermiával történő kombinálásának szinergikus hatását értékelték, ellentmondásos eredményeket hoztak. A hypoxiás-ischaemiás agykárosodás hasonló patkánymodelljében a születés utáni 7. napon, Fang et al. nem találtak szignifikáns neuroprotektív hatásokat kombinált alkalmazásuk során.24 azonban egy másik tanulmány szerint Fan et al.,, 25 a szerzők enyhe jótékony hatást figyeltek meg a patkány kölykök szenzomotoros funkciójára, bár ez a különbség nem tükröződött az agyszövetminták szövettani jellemzőiben.
HIE-vel kezelt újszülötteken végzett vizsgálatok kimutatták, hogy a rhEPO alkalmazása 300–2500iu/ttkg dózisban biztonságos. A rhepo alacsony dózisai hatásosnak bizonyultak mérsékelt károsodásban szenvedő betegeknél, és úgy tűnik, hogy a fogyatékosság vagy a halál kockázatának csökkenésével járnak.26 nagyobb adag (legfeljebb 2500iu/kg) 6 hónap alatt csökkentheti a görcsrohamok és neurológiai rendellenességek előfordulását.,27
ma három, III.fázisú klinikai vizsgálat folyik összesen 840 újszülött bevonásával, hogy felmérjék az EPO (1000iu/kg) és hypothermia (eritropoetin hipoxiás ischaemiás encephalopathia esetén újszülötteknél, NCT03079167; nagy dózisú eritropoetin Asphyxia és encephalopathia esetén, NCT02811263; eritropoetin újszülött hypoxiás ischaemiás encephalopathia kezelésében, nct03163589). Az első 2 fő célja a 2 éves halálozás vagy fogyatékosság csökkentése, míg a harmadik 1 év után értékeli ezt a két eredményt., Várjuk ezeknek és más vizsgálatoknak az eredményeit annak megállapítására, hogy az EPO vagy annak bármely származéka hatékony-e, és hogyan kell azokat alkalmazni a klinikai gyakorlatban, olyan tényezőket értékelve, mint a minimális hatékony dózis, az alkalmazás módja, a kezelés időtartama stb.
őssejtek
az őssejtek használata mindenféle betegség kezelésére, beleértve a HIE-t is, olyan kutatási terület, amely tovább növekszik., Ez a terápiás megközelítés segítheti a sérült agyszövet helyreállítását és regenerálódását a hipoxiás-ischaemiás inzultus után, az őssejteknek az agytól távol eső szervekben, például a lépben lévő immunsejtekkel való kölcsönhatása révén, ezáltal megváltoztatva az immunválaszt / gyulladásos választ. Hasonlóképpen, a funkcionális helyreállítás elérni a kormányzat részben magyarázható a kölcsönhatás az átültetett sejtek, illetve agyszövet, az azt követő termelés növekedési tényező, amelynek végső hatás tükröződik fokozott neurogenezis, valamint a sejtek proliferációját.,
Bár még mindig össze kell elmélyíteni a tudást, hogy képes legyen használni az őssejtek, mint egy hatékony terápia, kísérleti állatokon végzett vizsgálatok kimutatták, hogy a különböző típusú őssejtek képesek túlélni a sérült agy, differenciálódnak neuronok vagy glia, integrálni a cél szövetekben, kedvezően módosítsa viselkedési eredmények (felül Bennet et al.28)., Újabb tanulmányok arról számolt be, hogy a kormány a mesenchymalis őssejtek kombinálva 24 órás hűtés a patkány kölykök követő 7 napig, születési elért jobb eredmények képest, vagy a kezelés önmagában,29, meg is találta, hogy hypothermia bővül a terápiás idő, ablak, adminisztráció, a mesenchymalis őssejtek, hogy akár 2 nap után a hipoxiás-iszkémiás esemény.,30 emellett őssejtek képesek szabályozni az immunválasz a kölcsönhatások effektor immunsejtek található szervek távol az agy, mint például a lépben, akinek a mozgósítás ismert, hogy a potenciális fokozza a gyulladásos válasz iszkémiás károsodás, az éretlen agy, ezzel is fokozva a neuroprotektív hatása.,31,32
Az őssejt terápia önmagában vagy terápiás hipotermiával kombinálva ígéretes kutatási terület, amely még mindig klinikai vizsgálatokat igényel, többek között az őssejtek leghatékonyabb típusának, valamint a kezelés optimális dózisának és időtartamának meghatározására a lehető legjobb kezelési eredmények elérése érdekében.,28 az Egyik a projektek jelenleg folyamatban van a toborzási fázisban (Tanulmány hCT-MSC Újszülött Csecsemők, akiknél Közepes fokú vagy Súlyos GYORSAN, NCT03635450) tartalmazza 6 csecsemők születnek a terhességi kor, 36 vagy több hét, közepes, súlyos, GYORSAN kell kezelni, a hypothermia, 2, intravénásan mesenchymalis stroma sejtek származó köldökzsinór szövet (hCT-MSC). Az I. fázisú vizsgálat fő célkitűzései a hCT-MSC biztonságosságának értékelése, valamint a résztvevők túlélési és neurodevelopmentális eredményeinek elemzése 6, illetve 16 hónap alatt., Egy másik fázis i. vizsgálat (NCT00593242) kapott ígéretes eredményeket az autológ transzplantáció a köldökzsinór vér sejtek, a 74% – át az újszülöttek, hogy kapott őssejtek túlélő pontszámok 85 vagy nagyobb az Bayley mérleg képest 41% – a az újszülöttek kezelt hűtés egyedül.33
N-acetilcisztein
N-acetilcisztein (NAC) a cisztein prekurzora,amely szabad gyököket szed, és részt vesz a glutation fenntartásában, 34 így szabályozza az oxidatív stresszt., Állatmodellekből származó bizonyítékok azt mutatták, hogy a NAC és a hipotermia kombinációjával kezelt állatoknál nagyobb mértékben csökkent az agyi infarktus térfogata, mint az ilyen beavatkozások közül csak egyet kezelt állatoknál. Továbbá a kombinációs terápiával kezelt állatok hasonló eredményeket mutattak a reflexekben és a fehérállomány károsodásában a kontroll csoportban.35 mivel a terhesség alatt történő alkalmazásnak nincs teratogén hatása, és átjuthat a placentán, a 36 NAC az újszülött intenzív osztályon történő későbbi felhasználás egyik legígéretesebb terápiás ágensének tekinthető., Tudomásunk szerint azonban eddig egyetlen klinikai vizsgálatot sem terveztek a HIE kezelésében való alkalmazásának értékelésére, és a rendelkezésre álló bizonyítékok az intra-amniotikus gyulladással, chorioamnionitissel vagy légzési distressz szindrómával kapcsolatos vizsgálatokra korlátozódnak.
nemesgázok
az olyan nemesgázok, mint a xenon és a radon, neuroprotektív hatást mutattak az újszülött HI állatmodellekben. Számos tanulmány elemezte a xenon terápiás szerként való alkalmazásának lehetőségét (a bizonyítékok felülvizsgálatához lásd Lobo et al.,37) mivel képes csökkenteni az excitotoxicitást HI inzultus után az NMDA glutamát receptorok modulációján keresztül.38,39
a multicentrikus klinikai vizsgálat Total Body hypothermia plus Xenon (TOBY-Xe)a xenon gázt hipotermiával kombinálva 92, a terhesség 36-43 hete között született csecsemőből álló mintában alkalmazta., Bár nem talált szignifikáns különbséget a csoportok között,40 azzal a céllal, egyre részletesebb információt néhány változót, ami hatással lehetett az eredmények a kezelés ezt a nemes gáz, például az adagolás időtartama vagy, egy fázis II klinikai vizsgálat folyamatban van (CoolXenon3 Tanulmány, NCT02071394).,
ezzel szemben az argonnal eddig nem végeztek klinikai vizsgálatokat, de kimutatták, hogy az argon javítja a hűtés kimenetelét az N-acetil-aszpartát/Laktát marker szintje tekintetében, amely az átlagos sejthalálértékek növekedésével és az érintett újszülöttek neurológiai következményeinek kialakulásával járt.41 ezek az ígéretes eredmények, valamint a xenonhoz képest magasabb biológiai hozzáférhetősége és alacsonyabb költsége miatt az argon egy olyan molekula, amely nagy potenciállal rendelkezik a HIE kezelésében.,
következtetések
A HIE hatékony kezelésének elérése a modern orvostudomány egyik nagy kihívása. Ezért évek óta jelentős erőfeszítéseket tettek a perinatális asphyxia utáni agysejtkárosodáshoz vezető mechanizmusok elemzésére annak érdekében, hogy hatékony kezeléseket fejlesszenek ki azok blokkolására. Jelenleg a gyermekorvosok és az idegtudósok olyan új vegyületeket próbálnak kifejleszteni, amelyek a hipotermiával szinergiában működhetnek azzal a céllal, hogy minimálisra csökkentsék a HIE neurológiai következményeit., Másrészt a legújabb kutatások kezdődött, hogy tartalmazza a szex között a változók figyelembe véve a menedzsment GYORSAN, mint dimorf nemi különbségeket találtak mind a mechanizmusok a kár (a kísérleti modellek, a nőstény állatok esetében nagyobb memória hiány, míg a hím állatok mutatott nagyobb fogékonyság, hogy az oxidatív stressz), valamint az utak a különböző kezelések alatt figyelembe kell venni., Annak ellenére, hogy a melatonin vagy vegyületek, például az EPO alkalmazásával ígéretes előrelépések történtek, preklinikai vizsgálatokra van szükség ezen molekulák hatásmechanizmusainak további tisztázásához, és nagyobb mintákkal végzett klinikai vizsgálatokra van szükség ezen és más kezelések optimális dózisának és beadási módjának meghatározásához.
finanszírozás
a tanulmányt az UPV/EHU által az egyetem kutatócsoport finanszírozási programjának részeként nyújtott támogatás támogatta (GIU 17/018).
összeférhetetlenség
a szerzőknek nincs érdekellentétük.