10.6: Strutture reticolari nei solidi cristallini
Celle unitarie di metalli
La struttura di un solido cristallino, sia esso un metallo o meno, è meglio descritta considerando la sua unità ripetitiva più semplice, che viene indicata come la sua cella unitaria. La cella unitaria è costituita da punti reticolari che rappresentano le posizioni di atomi o ioni. L’intera struttura consiste quindi in questa cella unitaria che si ripete in tre dimensioni, come illustrato nella figura \(\PageIndex{1}\).,
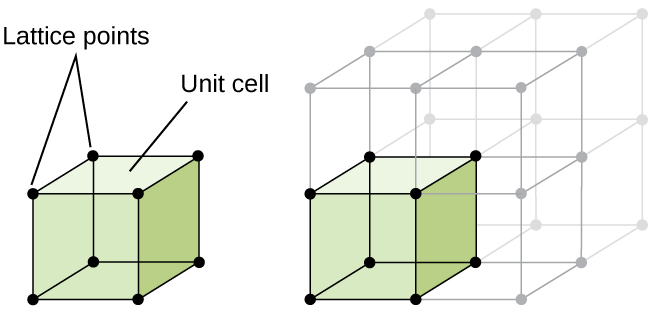
Iniziamo la nostra indagine sulla struttura del reticolo cristallino e sulle celle unitarie con la struttura più semplice e la cella unitaria più elementare. Per visualizzare questo, immagina di prendere un gran numero di sfere identiche, come palle da tennis, e disporle uniformemente in un contenitore., Il modo più semplice per farlo sarebbe creare livelli in cui le sfere di un livello siano direttamente sopra quelle del livello sottostante, come illustrato nella Figura \(\PageIndex{2}\). Questa disposizione è chiamata struttura cubica semplice e la cella unitaria è chiamata cella cubica semplice o cella cubica primitiva.
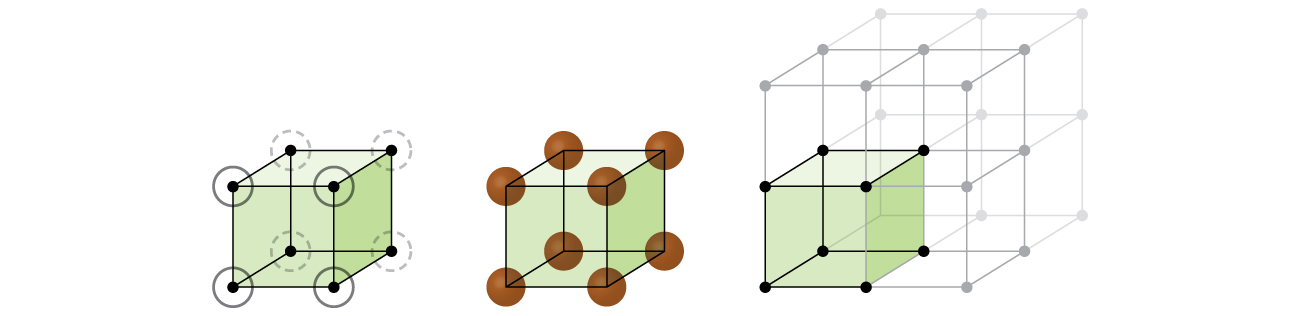
In una semplice struttura cubica, le sfere non sono imballate il più vicino possibile e “riempiono” solo circa il 52% del volume del contenitore. Questa è una disposizione relativamente inefficiente e solo un metallo (polonio, Po) cristallizza in una semplice struttura cubica. Come mostrato in Figura \(\PageIndex{3}\), un solido con questo tipo di disposizione è costituito da piani (o livelli) in cui ogni atomo contatta solo i quattro vicini più vicini nel suo livello; un atomo direttamente sopra di esso nel livello sopra; e un atomo direttamente sotto di esso nel livello sottostante., Il numero di altre particelle che ogni particella in un solido cristallino contatti è noto come il suo numero di coordinazione. Per un atomo di polonio in una semplice matrice cubica, il numero di coordinazione è, quindi, sei.

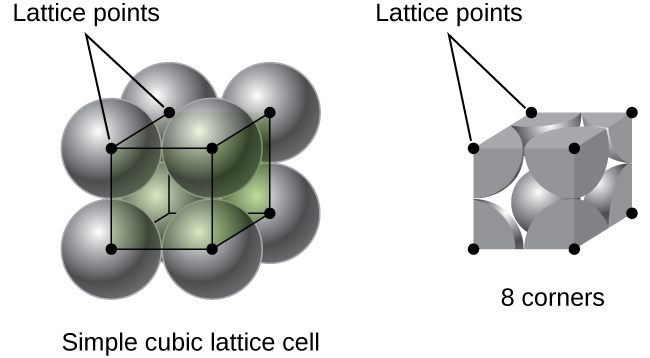
In un semplice reticolo cubico, la cella unitaria che si ripete in tutte le direzioni è un cubo definito dai centri di otto atomi, come mostrato nella figura \(\PageIndex{4}\). Gli atomi agli angoli adiacenti di questa cella unitaria si contattano l’un l’altro, quindi la lunghezza del bordo di questa cella è uguale a due raggi atomici o un diametro atomico. Una cella unitaria cubica contiene solo le parti di questi atomi che si trovano al suo interno. Poiché un atomo in un angolo di una semplice cella unitaria cubica è contenuto da un totale di otto celle unitarie, solo un ottavo di quell’atomo si trova all’interno di una cella unitaria specifica., E poiché ogni semplice cella cubica ha un atomo in ciascuno dei suoi otto “angoli”, c’è \(8× \ dfrac{1}{8}=1\) atomo all’interno di una semplice cella unità cubica.
La maggior parte dei cristalli metallici sono uno dei quattro principali tipi di celle unitarie., Per ora, ci concentreremo sulle tre celle di unità cubiche: cubiche semplici (che abbiamo già visto), cubiche centrate sul corpo e cubiche centrate sul viso-tutte illustrate nella Figura \(\PageIndex{5}\). (Si noti che ci sono in realtà sette diversi sistemi reticolari, alcuni dei quali hanno più di un tipo di reticolo, per un totale di 14 diversi tipi di celle unitarie. Lasciamo le geometrie più complicate per più avanti in questo modulo.,)
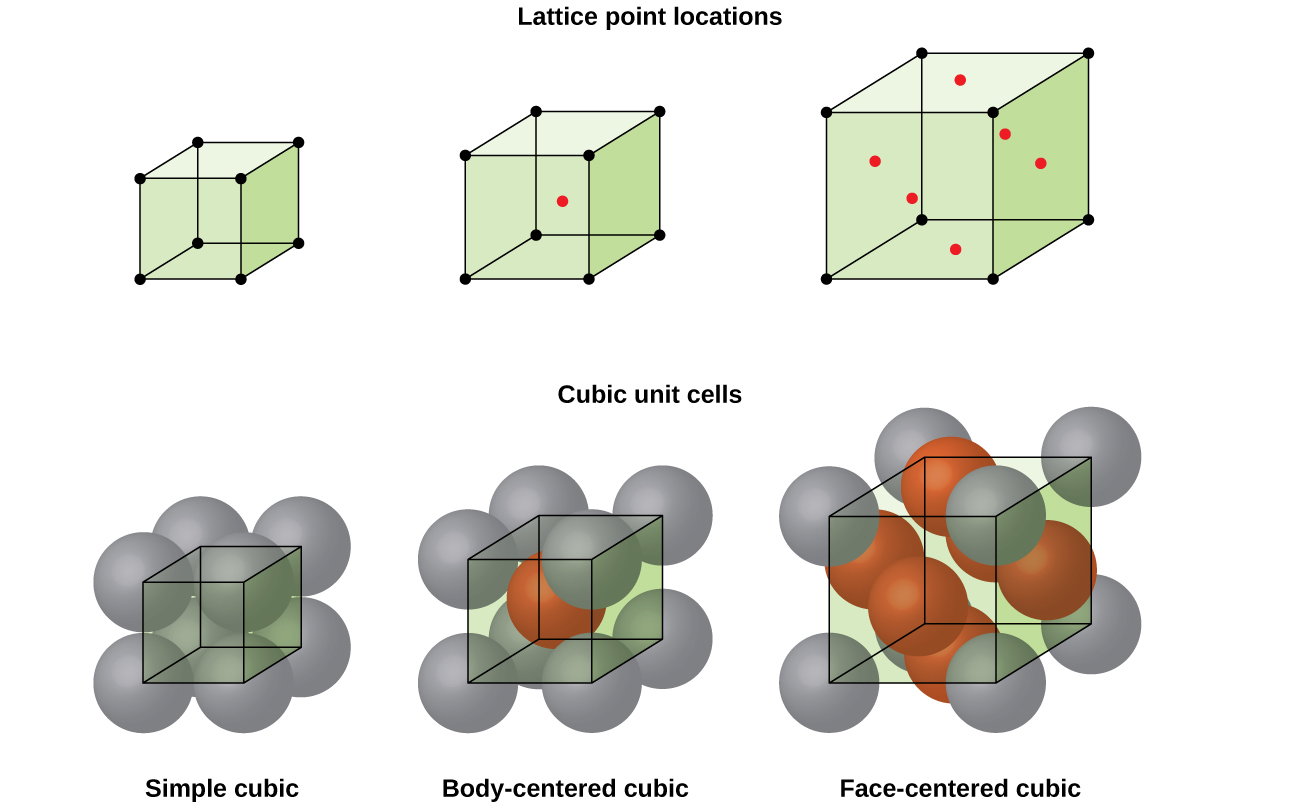
Alcuni metalli cristallizzano in una disposizione che ha una cella unitaria cubica con atomi in tutti gli angoli e un atomo al centro, come mostrato in Figura \(\PageIndex{6}\). Questo è chiamato un solido cubico centrato sul corpo (BCC)., Gli atomi negli angoli di una cella di unità BCC non si contattano l’un l’altro ma contattano l’atomo al centro. Una cella di unità CCN contiene due atomi: un ottavo di un atomo in ciascuno degli otto angoli (\(8× \ dfrac{1}{8}=1\) atomo dagli angoli) più un atomo dal centro. Qualsiasi atomo in questa struttura tocca quattro atomi nello strato sopra di esso e quattro atomi nello strato sotto di esso. Pertanto, un atomo in una struttura BCC ha un numero di coordinazione di otto.,
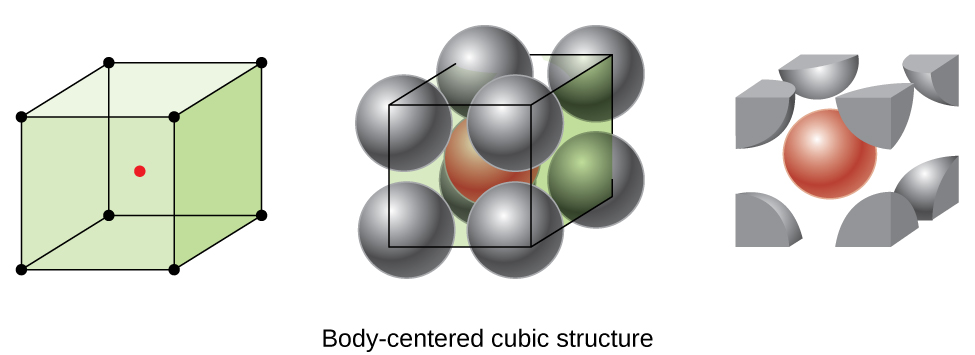
Gli atomi in accordi BCC sono imballati in modo molto più efficiente rispetto a una semplice struttura cubica, occupando circa il 68% del volume totale. I metalli isomorfi con una struttura BCC includono K, Ba, Cr, Mo, W e Fe a temperatura ambiente., (Elementi o composti che cristallizzano con la stessa struttura sono detti isomorfi.)
Molti altri metalli, come alluminio, rame e piombo, cristallizzano in una disposizione che ha una cella unitaria cubica con atomi in tutti gli angoli e ai centri di ogni faccia, come illustrato nella Figura \(\PageIndex{7}\). Questa disposizione è chiamata un solido cubico (FCC) centrato sulla faccia., Una cella di unità FCC contiene quattro atomi: un ottavo di un atomo in ciascuno degli otto angoli (\(8× \ dfrac{1}{8}=1\) atomo dagli angoli) e la metà di un atomo su ciascuna delle sei facce (\(6× \ dfrac{1}{2}=3\) atomi dalle facce). Gli atomi agli angoli toccano gli atomi nei centri delle facce adiacenti lungo le diagonali del cubo. Poiché gli atomi sono su punti di reticolo identici, hanno ambienti identici.
Gli atomi in una disposizione FCC sono imballati il più strettamente possibile, con atomi che occupano il 74% del volume., Questa struttura è anche chiamata imballaggio cubico più vicino (CCP). Nel PCC, ci sono tre strati ripetuti di atomi disposti esagonalmente. Ogni atomo contatta sei atomi nel proprio strato, tre nello strato sopra e tre nello strato sotto. In questa disposizione, ogni atomo tocca 12 vicino ai vicini, e quindi ha un numero di coordinazione di 12. Il fatto che gli accordi FCC e CCP siano equivalenti potrebbe non essere immediatamente ovvio, ma il motivo per cui in realtà sono la stessa struttura è illustrato nella Figura \(\PageIndex{8}\).,
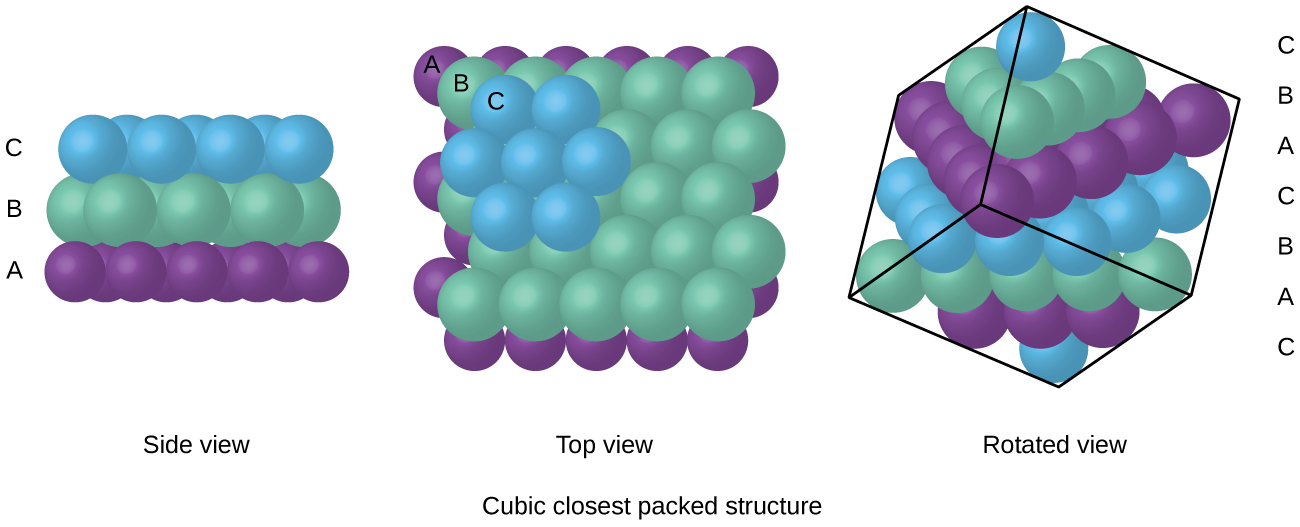
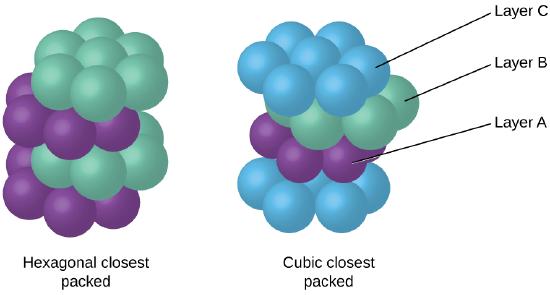
Poiché l’imballaggio più vicino massimizza le attrazioni complessive tra gli atomi e minimizza l’energia intermolecolare totale, gli atomi nella maggior parte dei metalli imballano in questo modo., Troviamo due tipi di imballaggio più vicino in semplici strutture cristalline metalliche: CCP, che abbiamo già incontrato, e imballaggio più vicino esagonale (HCP) mostrato in Figura \(\PageIndex{9}\). Entrambi sono costituiti da strati ripetuti di atomi disposti esagonalmente. In entrambi i tipi, un secondo strato (B) è posto sul primo strato (A) in modo che ogni atomo nel secondo strato sia in contatto con tre atomi nel primo strato. Il terzo strato è posizionato in uno dei due modi. In HCP, gli atomi nel terzo strato sono direttamente sopra gli atomi nel primo strato (cioè,, il terzo strato è anche di tipo A), e l’impilamento consiste in strati alternati di tipo A e tipo B (cioè, ABABAB⋯). Nel PCC, gli atomi nel terzo strato non sono al di sopra degli atomi in uno dei primi due strati (cioè, il terzo strato è di tipo C) e l’impilamento consiste in strati alternati di tipo A, tipo B e tipo C (cioè, ABCABCABC⋯). Circa due terzi di tutti i metalli cristallizzano in matrici più vicine con numeri di coordinazione di 12., I metalli che cristallizzano in una struttura HCP includono Cd, Co, Li, Mg, Na e Zn e i metalli che cristallizzano in una struttura CCP includono Ag, Al, Ca, Cu, Ni, Pb e Pt.
Esercizio \(\PageIndex{2}\)
L’argento cristallizza in una struttura FCC. La lunghezza del bordo della sua cella unitaria è 409 pm.
- Qual è il raggio atomico di Ag in questa struttura?
- Calcolare la densità di Ag.
Risposta a
144 pm
Risposta b
10,5 g/cm3
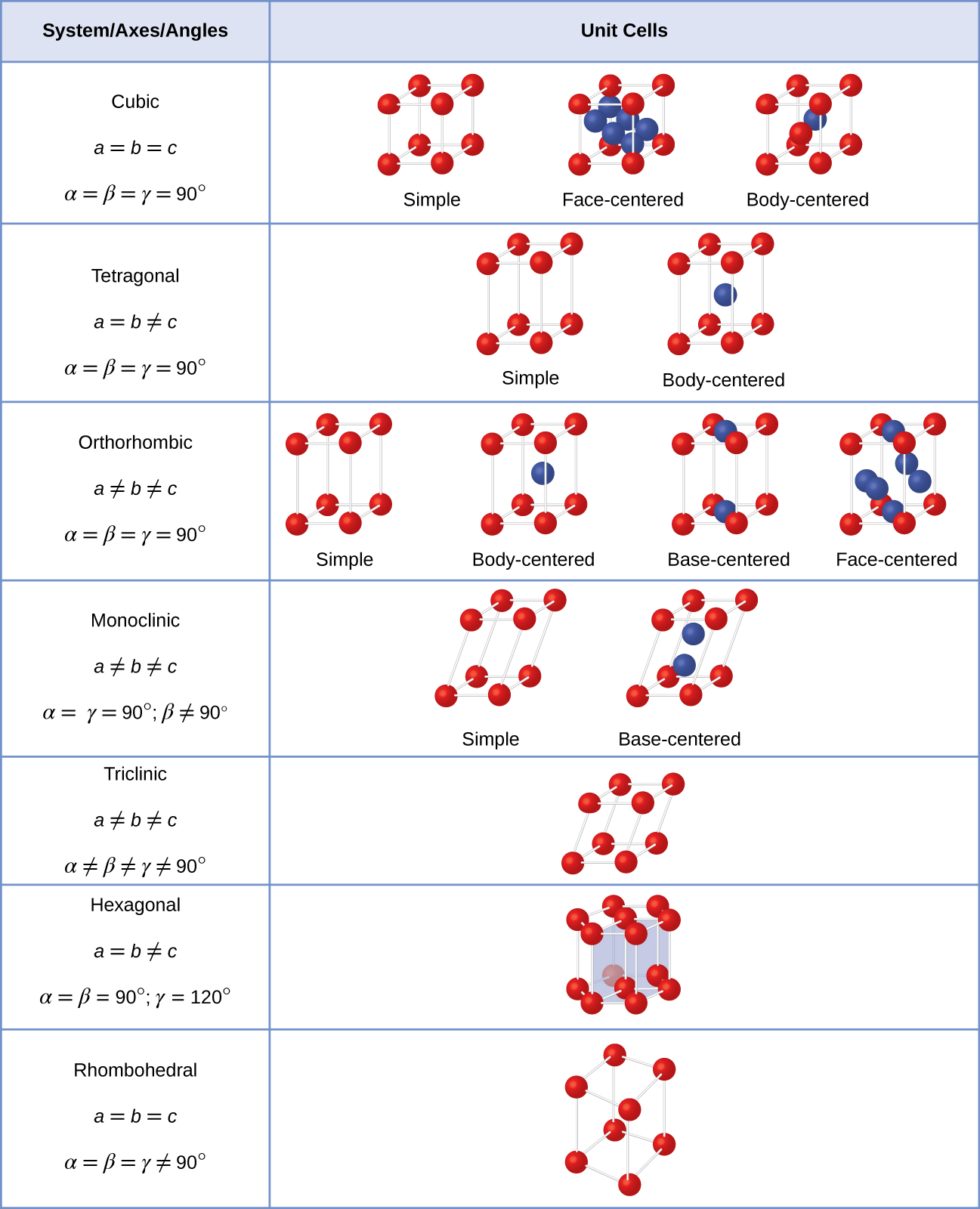
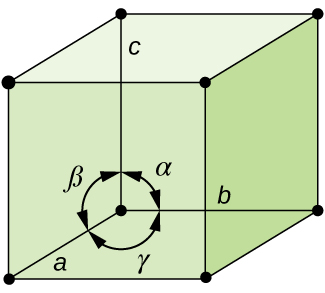
In generale, una cella unitaria è definita dalle lunghezze di tre assi (a, b e c) e dagli angoli (α, β e γ) tra di loro, come illustrato nella Figura \(\PageIndex{10}\)., Gli assi sono definiti come le lunghezze tra i punti nel reticolo spaziale. Di conseguenza, gli assi delle celle unitarie uniscono punti con ambienti identici.
Esistono sette diversi sistemi di reticolo, alcuni dei quali hanno più di un tipo di reticolo, per un totale di quattordici celle di unità diverse, che hanno le forme mostrate nella figura \(\PageIndex{11}\).