6.3: Configurazione assoluta e (R) e (S) System
Configurazioni assolute di formule prospettiche
I chimici hanno bisogno di un modo conveniente per distinguere uno stereoisomero da un altro. Il sistema Cahn-Ingold-Prelog è un insieme di regole che ci consente di definire in modo inequivocabile la configurazione stereochimica di qualsiasi stereocentro, utilizzando le designazioni “R ’ (dal latino rectus, che significa destrorso) o” S ’ (dal latino sinister, che significa mancino).,
Le regole per questo sistema di nomenclatura stereochimica sono, in superficie, abbastanza semplici.
Regole per assegnare una designazione R / S a un centro chirale
1: Assegnare priorità ai quattro sostituenti, con #1 che è la priorità più alta e #4 la più bassa. Le priorità si basano sul numero atomico.
2: Traccia un cerchio da #1 a # 2 a #3.
3: Determinare l’orientamento del gruppo di priorità #4. Se è orientato verso il piano della pagina (lontano da te), vai al passaggio 4a. Se è orientato verso il piano della pagina (verso di te) vai al passaggio 4b.,
4a: (#4 gruppo che punta lontano da te): un cerchio in senso orario nella parte 2 corrisponde alla configurazione R, mentre un cerchio in senso antiorario corrisponde alla configurazione S.
4b: (#4 gruppo che punta verso di te): un cerchio in senso orario nella parte 2 corrisponde alla configurazione S, mentre un cerchio in senso antiorario corrisponde alla configurazione R.
Useremo la gliceraldeide a 3 atomi di carbonio come primo esempio. La prima cosa che dobbiamo fare è assegnare una priorità a ciascuno dei quattro sostituenti legati al centro chirale., Per prima cosa guardiamo gli atomi che sono direttamente legati al centro chirale: questi sono H, O (nell’idrossile), C (nell’aldeide) e C (nel gruppo CH2OH).
Assegnare la configurazione R / S alla gliceraldeide:

Due priorità sono facili: l’idrogeno, con un numero atomico di 1, è la priorità più bassa (#4) e l’ossigeno idrossile, con numero atomico 8, è la priorità #1. Il carbonio ha un numero atomico di 6. Quale dei due gruppi ” C ” è la priorità # 2, l’aldeide o il CH2OH?, Per determinare questo, spostiamo un altro legame dal centro chirale: per l’aldeide abbiamo un doppio legame con un ossigeno, mentre sul gruppo CH2OH abbiamo un singolo legame con un ossigeno. Se l’atomo è lo stesso, i doppi legami hanno una priorità più alta rispetto ai singoli legami. Pertanto, al gruppo aldeidico viene assegnata la priorità # 2 e al gruppo CH2OH la priorità #3.
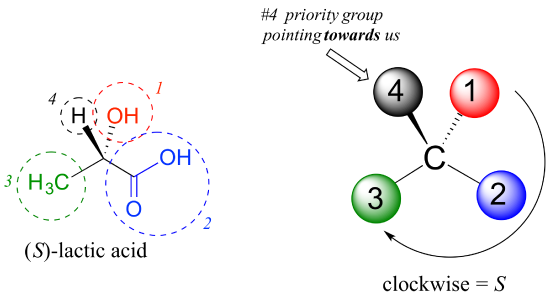
Con le nostre priorità assegnate, guardiamo avanti il gruppo di priorità #4 (l’idrogeno) e vediamo che è puntato indietro da noi, nel piano della pagina – quindi si applica il passaggio 4a dalla procedura sopra., Quindi, tracciamo un cerchio definito dai gruppi di priorità #1, #2 e #3, in ordine crescente. Il cerchio è in senso orario, che al passaggio 4a ci dice che questo carbonio ha la configurazione ‘ R ‘ e che questa molecola è (R)-gliceraldeide. Il suo enantiomero, per definizione, deve essere (S) – gliceraldeide.
Quindi, diamo un’occhiata a uno degli enantiomeri dell’acido lattico e determiniamo la configurazione del centro chirale. Chiaramente, H è il sostituente # 4 e OH è # 1. A causa dei suoi tre legami con l’ossigeno, il carbonio sul gruppo acido ha la priorità #2 e il gruppo metilico prende #3., Il gruppo # 4, idrogeno, sembra essere disegnato puntando verso di noi (fuori dal piano della pagina) in questa figura, quindi usiamo il passaggio 4b: Il cerchio tracciato da #1 a #2 a #3 è in senso orario, il che significa che il centro chirale ha la configurazione S.
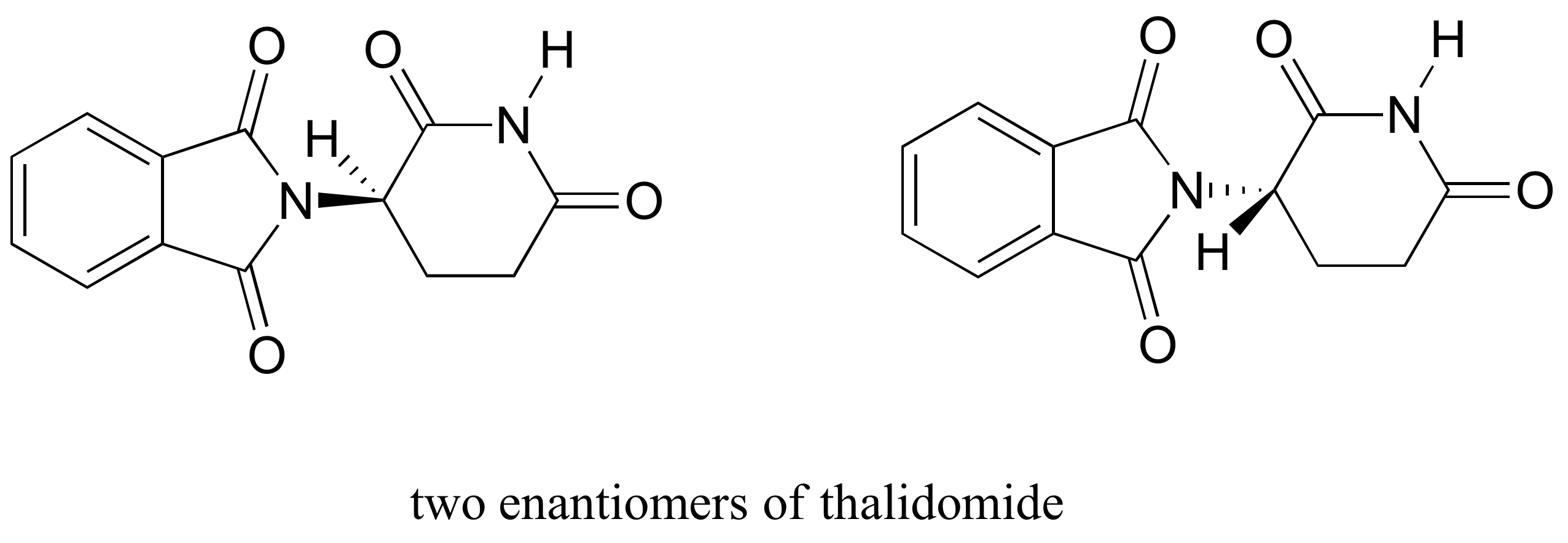
Il farmaco talidomide è un caso di studio interessante, ma tragico, sull’importanza della stereochimica nella progettazione di farmaci., Prodotto per la prima volta da un’azienda farmaceutica tedesca e ampiamente prescritto in Europa e in Australia alla fine degli anni ‘ 50 come sedativo e rimedio per la malattia mattutina nelle donne in gravidanza, la talidomide fu presto implicata come causa di devastanti difetti alla nascita nei bambini nati da donne che l’avevano presa. La talidomide contiene un centro chirale e quindi esiste in due forme enantiomeriche. È stato commercializzato come miscela racemica:in altre parole, una miscela 50: 50 di entrambi gli enantiomeri.
Proviamo a determinare la configurazione stereochimica dell’enantiomero a sinistra., Dei quattro legami al centro chirale, la priorità # 4 è l’idrogeno. Il gruppo di azoto è #1, il lato carbonilico dell’anello è #2 e il lato-CH2 dell’anello è #3.
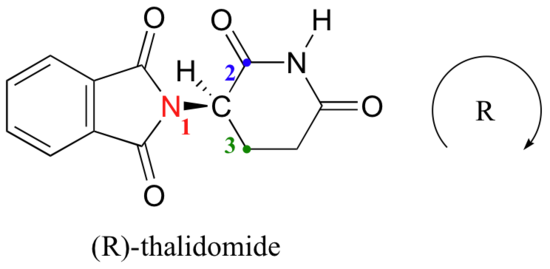
L’idrogeno è mostrato che punta lontano da noi e i sostituenti prioritari tracciano un cerchio in senso orario: questo è l’enantiomero R della talidomide. L’altro enantiomero, ovviamente, deve avere la configurazione S.,
Sebbene gli scienziati non siano ancora sicuri di come funzioni la talidomide, le prove sperimentali suggeriscono che in realtà era l’enantiomero R ad avere gli effetti medici desiderati, mentre l’enantiomero S ha causato i difetti alla nascita. Anche con questa conoscenza, tuttavia, puro (R)-talidomide non è sicuro, perché gli enzimi nel corpo si convertono rapidamente tra i due enantiomeri – vedremo come ciò accade nel capitolo 12.
Come nota storica, la talidomide non è mai stata approvata per l’uso negli Stati Uniti. Questo grazie in gran parte agli sforzi del Dott., Frances Kelsey, un ufficiale di cibo e droga che, a rischio per la sua carriera, bloccato la sua approvazione a causa delle sue preoccupazioni per la mancanza di studi di sicurezza adeguati, in particolare per quanto riguarda la capacità del farmaco di entrare nel flusso sanguigno di un feto in via di sviluppo. Sfortunatamente, però, a quel tempo gli studi clinici per nuovi farmaci coinvolgevano una distribuzione diffusa e non regolamentata ai medici e ai loro pazienti in tutto il paese, quindi le famiglie negli Stati Uniti non furono risparmiate dai danni causati.,
Molto recentemente uno stretto derivato della talidomide è diventato legale prescrivere nuovamente negli Stati Uniti, con severe misure di sicurezza applicate, per il trattamento di una forma di cancro del sangue chiamato mieloma multiplo. In Brasile, la talidomide viene utilizzata nel trattamento della lebbra, ma nonostante le misure di sicurezza, i bambini stanno ancora nascendo con difetti correlati alla talidomide.
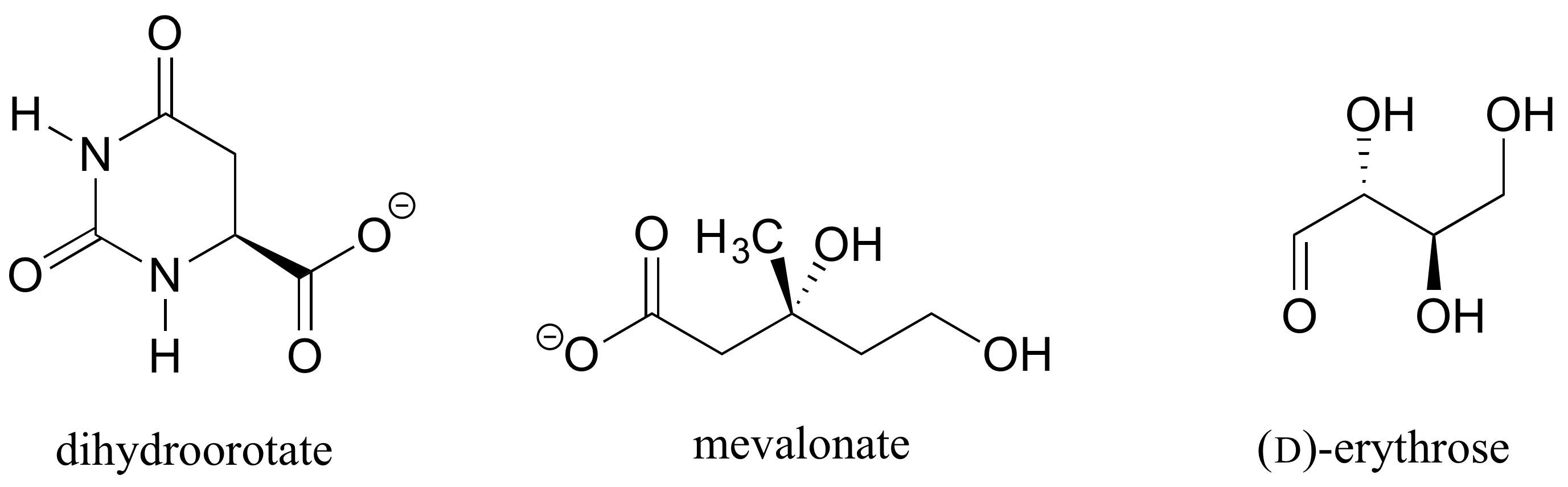
Esercizio 1.: Determinare le configurazioni stereochimiche dei centri chirali nelle biomolecole mostrate di seguito.
Esercizio 2.,: L’enantiomero (R) del malato dovrebbe avere un cuneo solido o tratteggiato per il legame C-O nella figura seguente?
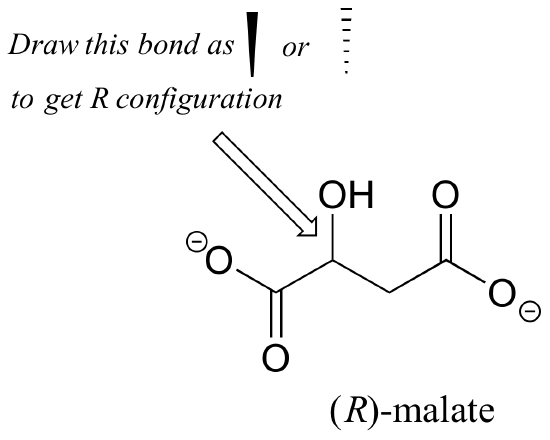
Esercizio 3.: Usando cunei solidi o tratteggiati per mostrare la stereochimica, disegnare l’enantiomero (R) di iprofene e l’enantiomero (S) di 2-metileritritolo-4-fosfato (le strutture sono mostrate in precedenza in questo capitolo senza stereochimica).
Soluzioni agli esercizi
Configurazioni assolute delle proiezioni Fischer
Per determinare la configurazione assoluta di un centro chirale in una proiezione Fisher, utilizzare la seguente procedura in due fasi.,
Passo 1
Assegnare numeri di priorità ai quattro ligandi (gruppi) legati al centro chirale utilizzando il sistema di priorità CIP.
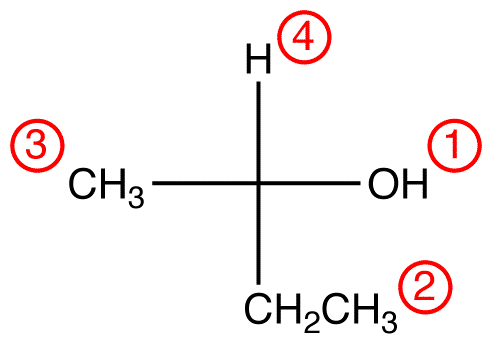
Passo 2 – opzione verticale
Se il ligando a priorità più bassa si trova su un legame verticale, allora punta lontano dal visualizzatore.
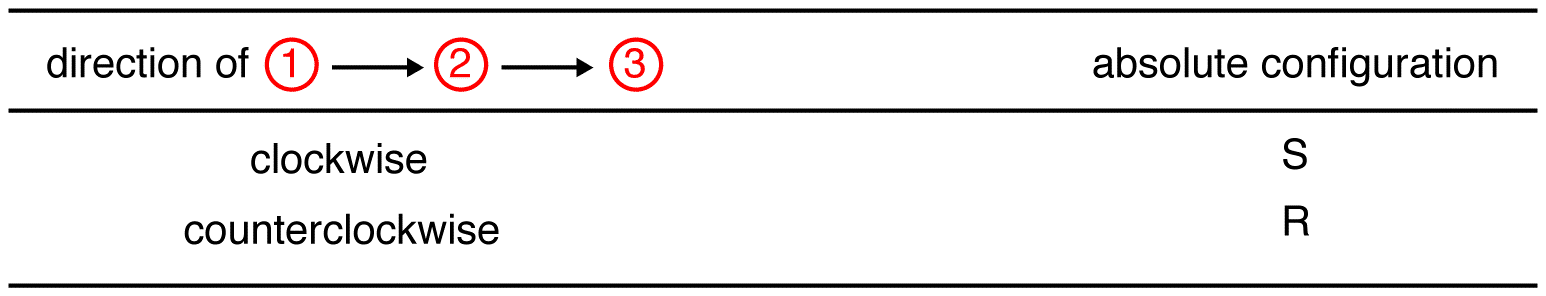
Traccia i tre ligandi a priorità più alta a partire dal ligando a priorità più alta (① → ② → ③) nella direzione che darà una risposta molto corretta.

Nel composto sottostante, il movimento è in senso orario che indica una configurazione R., Il nome completo IUPAC per questo composto è (R)-butan-2-ol.

Passo 2 – opzione orizzontale
Se il ligando a priorità più bassa si trova su un legame orizzontale, punta verso il visualizzatore.
Traccia i tre ligandi a priorità più alta a partire dal ligando a priorità più alta (① → ② → ③) nella direzione che darà una risposta terribilmente sbagliata. Si noti nella tabella seguente che le configurazioni sono invertite rispetto al primo esempio.,
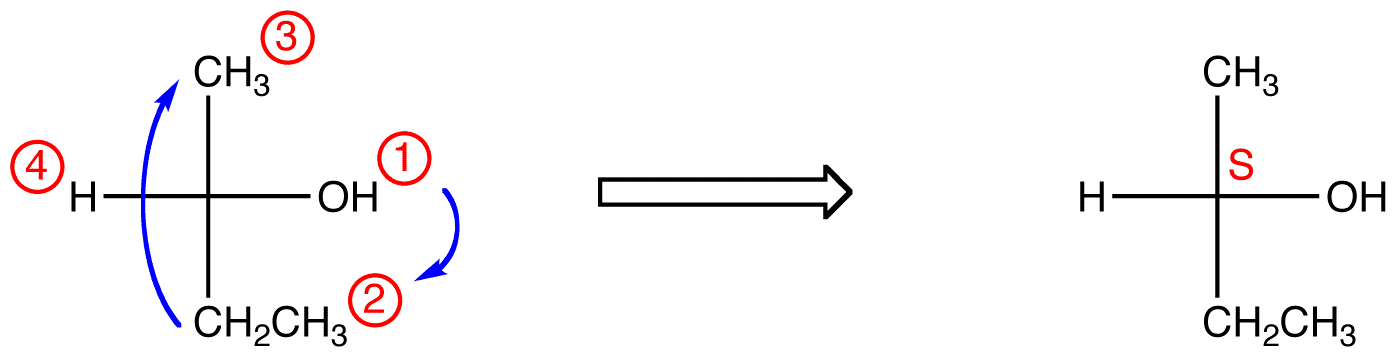
Nel composto sottostante, il movimento è in senso orario (R) che è terribilmente sbagliato, quindi la configurazione effettiva è S. Il nome IUPAC completo per questo composto è (S)-butan-2-ol.
Manipolare le proiezioni di Fischer senza modificare la configurazione
Una proiezione di Fischer limita una molecola tridimensionale in due dimensioni. Di conseguenza, ci sono limitazioni per quanto riguarda le operazioni che possono essere eseguite su una proiezione di Fischer senza modificare la configurazione assoluta nei centri chirali., Le operazioni che non cambiano la configurazione assoluta in un centro chirale in una proiezione di Fischer possono essere riassunte come due regole.
Regola 1: La rotazione della proiezione di Fischer di 180º in entrambe le direzioni senza sollevarla dal piano della carta non modifica la configurazione assoluta al centro chirale.
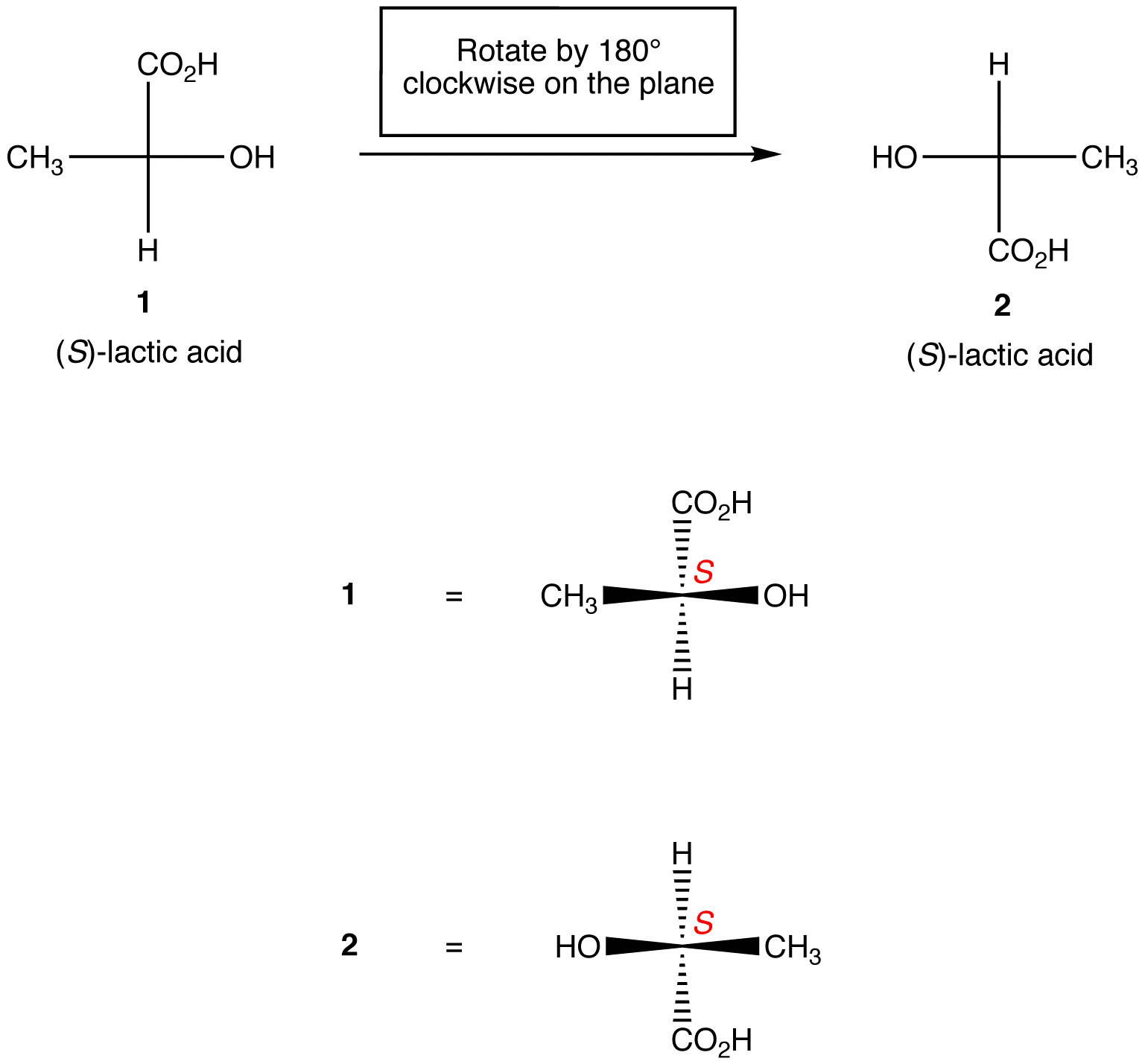
Regola 2: la rotazione di tre ligandi sul centro chirale in entrambe le direzioni, mantenendo il ligando rimanente in posizione, non modifica la configurazione assoluta al centro chirale.,
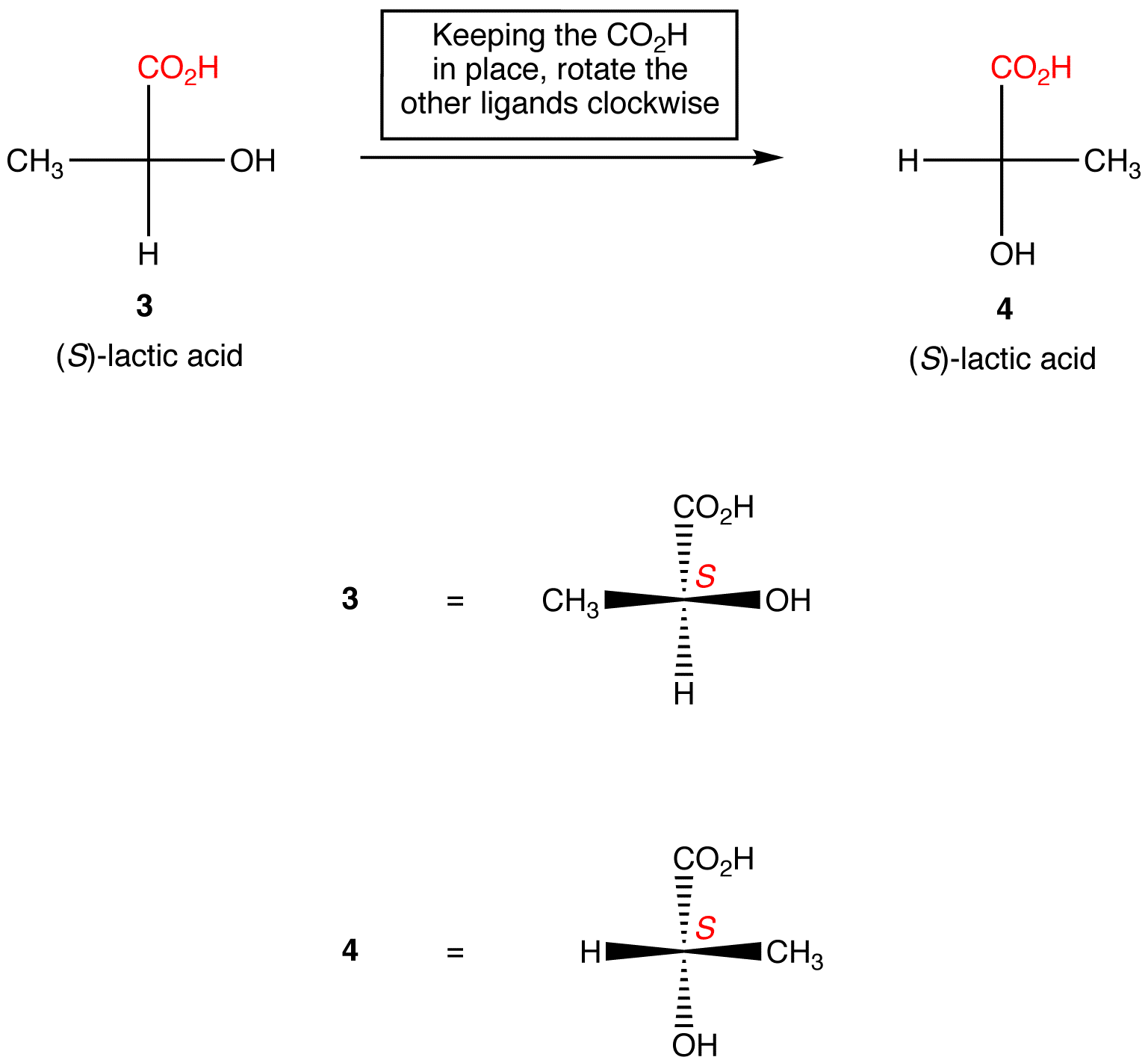
Manipolare le proiezioni di Fischer con la modifica alla configurazione
Le operazioni che modificano la configurazione assoluta in un centro chirale in una proiezione di Fischer possono essere riassunte come due regole.
Regola 1: La rotazione della proiezione di Fischer di 90º in entrambe le direzioni cambia la configurazione assoluta al centro chirale.
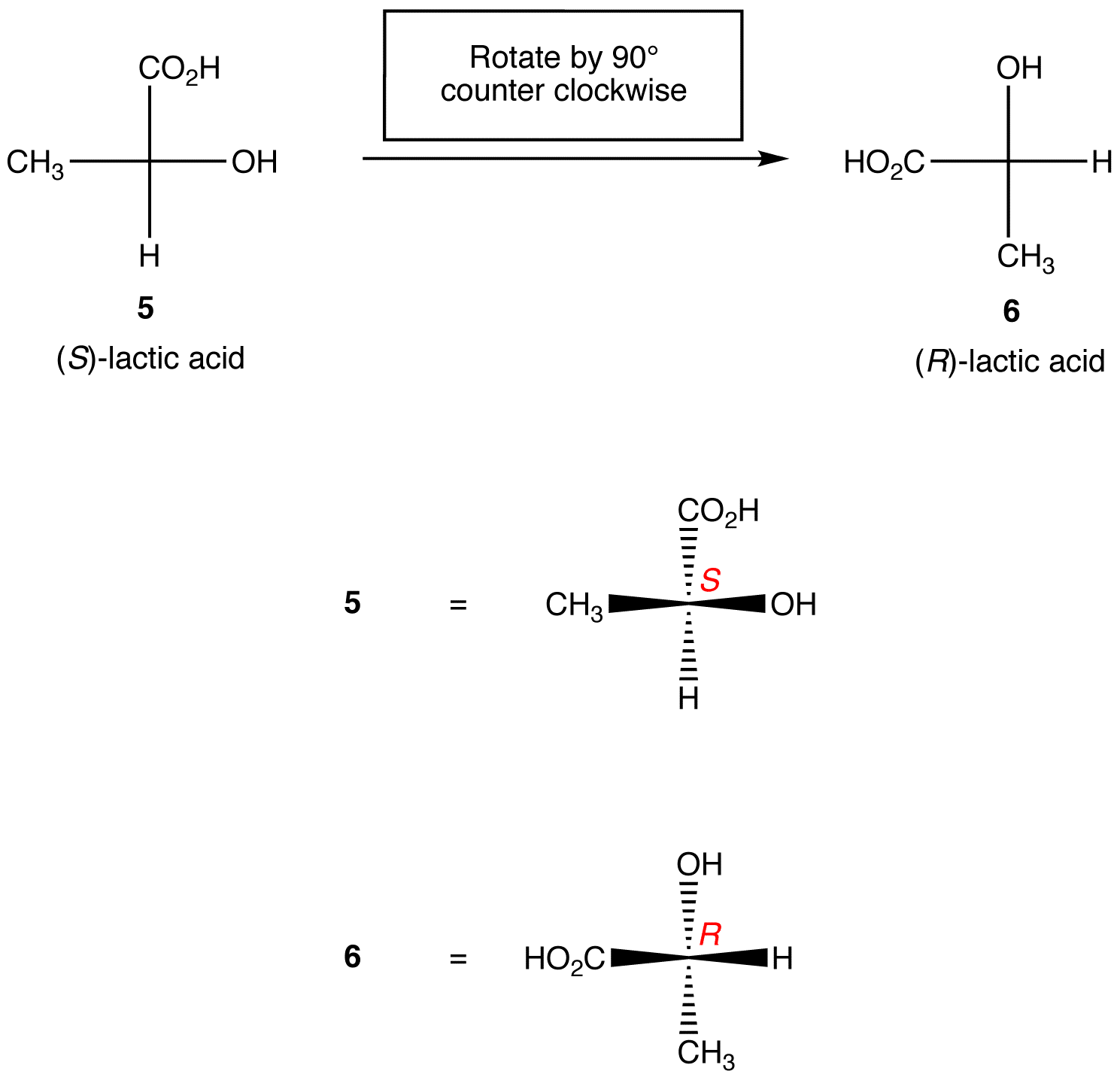
Regola 2: l’interscambio di due ligandi sul centro chirale cambia la configurazione assoluta al centro chirale.,
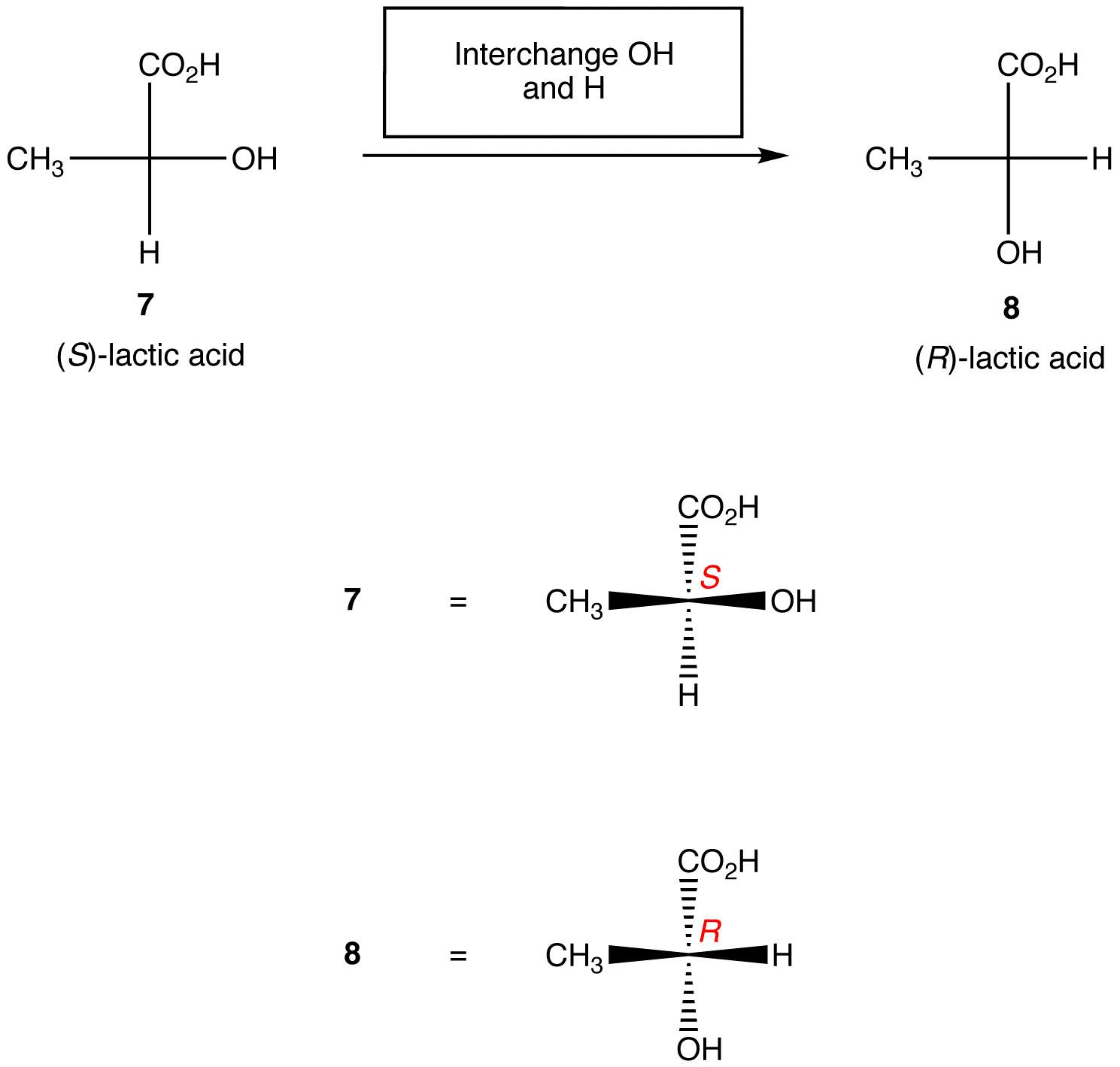
Le regole di cui sopra presuppongono che la proiezione di Fischer in esame contenga un solo centro chirale. Tuttavia, con cura, possono essere applicati a proiezioni di Fischer contenenti un numero qualsiasi di centri chirali.
Esercizio 1
Classificare i seguenti composti come R o S?
Soluzione
- S: > Br > F > H. La priorità più bassa sostituente, H, sta già andando verso il retro., Gira a sinistra passando da I a Br a F, quindi è un S.
- R: Br> Cl> CH3> H. Devi cambiare H e Br per posizionare l’H, la priorità più bassa, nella parte posteriore. Quindi, passando da Br a Cl, CH3 sta girando a destra, dandoti una R.
- Né R né S: Questa molecola è achirale. Solo le molecole chirali possono essere denominate R o S.
- R: OH> CN> CH2NH2> H. L’H, la priorità più bassa, deve essere spostata sul retro., Quindi, passando da OH a CN a CH2NH2, stai girando a destra, dandoti una R.
- (5) S: \(\ce{-COOH}\) > \(\ce{-CH_2OH}\) > \(\ce{C#CH}\) > \(\ce{H}\). Quindi, passando da \(\ce {- COOH}\) a \(\ce {- CH_2OH}\) a \(\ce{-C#CH}\) stai girando a sinistra, dandoti una configurazione S.
Esercizi
6. Orientare quanto segue in modo che l’atomo meno prioritario (4) sia percorso dietro, quindi assegnare la stereochimica (R o S).

7. Disegnare (R)-2-bromobutan-2-ol.
8., Assegna R / S alla seguente molecola.
.png?revision=1)
Soluzioni

A = S; B = R
8. Il centro stereo è R.
Altre risorse
Kahn Academy video tutorial sul sistema di denominazione R-S
- Schore e Vollhardt. Chimica Organica Struttura e funzione. New York: W. H. Freeman and Company, 2007.e ‘ il primo album in studio del gruppo. Fondamenti di Chimica Organica. 6a Ed. Brooks Cole, 2006.,
Contributori e attribuzioni
- Ekta Patel (UCD), Ifemayowa Aworanti (University of Maryland Baltimore County)
- Chimica organica con enfasi biologica di Tim Soderberg (Università del Minnesota, Morris)