La terapia combinata nell’encefalopatia ipossico-ischemica neonatale / Anales de Pediatría (Edizione inglese)
Introduzione
Con un’incidenza di 1-3 casi ogni 1000 nascite a termine,1 encefalopatia ipossico-ischemica (HIE) è una delle cause più frequenti di danno cerebrale nei neonati. Tenendo conto del crescente numero di nascite ad alto rischio a causa delle crescenti tendenze nell’età materna e nella frequenza di gravidanze multiple, tra gli altri fattori, l’HIE continua ad essere un problema rilevante in ambito ospedaliero per il quale non esiste ancora una soluzione definitiva.,
La ricerca sulla fisiopatologia dell’asfissia perinatale ha permesso di comprendere il complesso processo che avviene a livello cellulare e tissutale man mano che il danno cerebrale si sviluppa a causa della mancanza di ossigeno. Molti dei meccanismi coinvolti della lesione sono raggruppati in base ai tempi trascorsi al loro sviluppo e sono state descritte 4 fasi principali (Fig. 1): fase primaria, o episodio acuto di ischemia ipossica (HI), fase latente, fase secondaria e fase terziaria., Nella fase primaria, il danno deriva da una riduzione della consegna di ossigeno alle cellule e ai tessuti, che si traduce in un guasto di energia primaria. Questo è seguito da un apparente recupero dei livelli di composti fosforilati ad alta energia, noto come fase latente., Tuttavia, questo miglioramento è solo temporaneo e dà il via alla seconda fase, quando molti dei meccanismi fisiopatologici coinvolti nello sviluppo di danno cerebrale nei neonati che entrano in gioco, il principale dei quali sono eccitotossicità, un massiccio afflusso di ioni calcio nelle cellule, stress ossidativo, infiammazione e, nella maggior parte dei casi, la morte cellulare dovuta a necrosi o apoptosi. Infine, la fase terziaria è caratterizzata dalla persistenza del danno cerebrale settimane, mesi o addirittura anni dopo l’insulto ipossico-ischemico iniziale.,
La comprensione della fisiopatologia sottostante di HIE ha permesso l’identificazione di potenziali bersagli terapeutici che potrebbero aiutare a ridurre i danni cerebrali causati dall’asfissia e lo sviluppo di numerose strategie di trattamento. Alcuni di questi trattamenti, attualmente in sperimentazione, hanno lo scopo di lavorare in sinergia con ipotermia terapeutica, l’unico trattamento contro HIE che è stato generalmente adottato in ambito di terapia intensiva neonatale.,
Ipotermia
L’ipotermia ha iniziato ad essere utilizzata come strategia neuroprotettiva nei neonati dopo la scoperta di un meccanismo di raffreddamento endogeno che si manifestava nei neonati che avevano subito un qualche tipo di lesione durante la nascita.2 I suoi effetti neuroprotettivi sono principalmente legati alla diminuzione dell’attività metabolica del cervello, del 5% con ogni diminuzione di 1°C della temperatura,3 che modula alcune delle vie metaboliche dannose innescate dall’asfissia, che sono riassunte in Fig. 2.
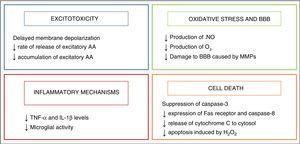
Effetto dell’ipotermia sui meccanismi di danno cerebrale.
Terapia di combinazione
Poiché l’evidenza suggerisce che gli attuali protocolli di ipotermia sono ottimali4 ma sono di efficacia limitata nella pratica clinica,5 abbiamo bisogno di espandere sono armamentario terapeutico per la gestione di HIE.,6 Recenti ricerche si sono concentrate sullo sviluppo e l’implementazione di trattamenti che possono essere utilizzati in combinazione con l’ipotermia, progettati per agire a diversi livelli della cascata fisiopatologica e per promuovere la sinergia di entrambe le terapie (Fig. 3).
Possibili target terapeutici e principali strategie neuroprotettive attualmente oggetto di sperimentazione per la gestione dell’HIE neonatale.
Melatonina
la Melatonina (N-acetil-5-metoxitriptamina) è un neurormone sintetizzato dalla ghiandola pineale, la cui secrezione segue un ciclo notte/giorno e il cui ruolo principale è nella regolazione del ritmo circadiano. Gli aspetti chiave che ne consentono l’utilizzo nella gestione di HIE sono la sua potente attività antiossidante e antinfiammatoria7 e la sua capacità di attraversare la barriera emato-encefalica e raggiungere il sistema nervoso centrale.,8
Prima di essere provato nei neonati, la melatonina ha dimostrato di aumentare il livello di protezione offerto dall’ipotermia attraverso l’ottimizzazione del metabolismo energetico cerebrale in un modello di maialino di asfissia.9 In ambito clinico, uno studio pubblicato da Aly et al.10 ha assegnato la metà dei neonati asfissiati all’ipotermia e 5 dosi di 10 mg/kg/die di melatonina erogate per via orale., Gli autori hanno riscontrato una riduzione dei livelli sierici di superossido dismutasi e ossido nitrico nei pazienti trattati con terapia combinata rispetto a quelli trattati con il solo raffreddamento, dimostrando così gli effetti benefici della combinazione di entrambe le strategie contro lo stress ossidativo.
Un recente studio condotto da Balduini et al., per valutare la sicurezza, la farmacocinetica, il dosaggio e l’efficacia della melatonina utilizzata in combinazione con l’ipotermia hanno rilevato che il raffreddamento non ha influenzato la farmacocinetica della melatonina11 e che è stato possibile ottenere livelli sierici elevati dell’ormone che somministrava dosi inferiori rispetto a quelle utilizzate in modelli animali sperimentali. Allo stato attuale, lo studio clinico MELPRO (NCT03806816) sta reclutando pazienti, puntando su un campione di 100 neonati., Questo e altri studi simili sono indispensabili per il futuro sviluppo di studi clinici di fase III e il successivo uso della melatonina nella pratica clinica quotidiana.
Allopurinolo
La logica per l’uso di allopurinolo nella gestione di HIE è il suo effetto inibitorio sulla xantina ossidasi, un enzima coinvolto nello stress ossidativo. Inoltre, questo farmaco agisce come chelante del ferro libero e sequestra i radicali idrossilici.,12,13 Uno studio preclinico su cuccioli di ratto in cui gli animali sono stati assegnati a 1 dei gruppi 5 (gruppo di controllo, gruppo HI, gruppo trattato con ipotermia, gruppo trattato con allopurinolo e gruppo trattato con terapia di combinazione) ha rilevato che 72 ore dopo l’insulto HI, il gruppo di terapia di combinazione mostrava il più basso volume di infarto.,14
Quando si tratta di sua le caratteristiche farmacologiche, l’allopurinolo può rapidamente attraversare la placenta e raggiungere concentrazioni terapeutiche nei neonati, come dimostrato in uno studio condotto su donne in gravidanza che hanno ricevuto 500 mg di allopurinolo per via endovenosa, con evidenza di livelli ottimali di allopurinol 5min dopo, nel cordone ombelicale dei campioni di sangue.15 Uno studio condotto da van Bel et al., nel 1998 che ha analizzato il suo potenziale effetto antiossidante nei neonati asfissiati con grave HIE ha scoperto che la somministrazione endovenosa di 40 mg/kg di allopurinolo ha ottenuto una riduzione della formazione di radicali liberi.13 Tuttavia, uno studio condotto in seguito da Benders et al. nel 2006 non ha trovato differenze tra il gruppo trattato con allopurinolo e il gruppo di controllo.16 Nelle conclusioni, questi autori hanno identificato l’estrema gravità dell’HIE nei neonati inclusi nel campione come possibile spiegazione per la mancanza di differenze significative., Hanno anche ipotizzato che il periodo trascorso alla somministrazione di allopurinolo (3–4h dopo la riperfusione) potrebbe essere stato troppo lungo per ottenere risultati favorevoli. In relazione a quest’ultimo punto, Gunes et al. somministrato la stessa dose di allopurinolo dato nei 2 studi precedenti, ma entro 2 ore dalla nascita, e ha trovato miglioramenti nei risultati dello sviluppo neurologico nel gruppo di trattamento.,Sulla stessa linea, la somministrazione di allopurinolo per via endovenosa alle madri durante il parto di feti con ipossia o ipossia incipiente ha aumentato l’efficacia del trattamento, riducendo i livelli ematici del cordone ombelicale della proteina S-100β, che è un marker di danno cerebrale.18 Uno studio clinico sotto il nome di Effetto di allopurinolo per danno cerebrale ipossico-ischemico su esito neurocognitivo (NCT03162653) è attualmente in corso per valutare i potenziali effetti terapeutici della somministrazione di questo inibitore enzimatico nei primi minuti dopo la nascita.,
Eritropoietina
L ‘ eritropoietina (EPO) è una citochina di 30,4 kDa sintetizzata dal fegato durante la vita fetale e dopo la nascita dai reni e dal cervello in via di sviluppo, dove agisce come fattore di crescita e agente neuroprotettivo.19 L’uso sia dell’EPO che dell’EPO umano ricombinante (rhEPO) in HIE si basa sulla sua attività, attraverso l’impegno dei recettori EPO presenti nei neuroni e nella glia,20 come potente agente antiapoptotico (stimolando la trascrizione dei geni antiapoptotici BCL-2 e BCL-XL) e come antinfiammatorio e antiossidante.,19,21 Oltre al suo effetto neuroprotettivo, l’EPO può promuovere processi di riparazione a lungo termine, come angiogenesi, oligodendrogenesi e neurogenesi.22,23
Studi preclinici che hanno valutato l’effetto sinergico della combinazione della somministrazione di EPO o rhEPO con ipotermia hanno dato risultati contraddittori. In un modello simile di ratto di danno cerebrale ipossico-ischemico al giorno 7 dopo la nascita, Fang et al. non ha trovato effetti neuroprotettivi significativi del loro uso combinato.24 Tuttavia, in un altro studio condotto da Fan et al.,, 25 gli autori hanno osservato un lieve effetto benefico sulla funzione sensomotoria nei cuccioli di ratto, sebbene questa differenza non si riflettesse nelle caratteristiche istologiche dei campioni di tessuto cerebrale.
Gli studi nei neonati con HIE hanno dimostrato che l’uso di rhEPO è sicuro a dosi di 300–2500IU/kg. Basse dosi di rhEPO sono state trovate efficaci in pazienti con danni moderati e sembrano essere associate a un ridotto rischio di disabilità o morte.26 Dosi più elevate (fino a 2500IU / kg) possono ridurre l’incidenza di convulsioni e anomalie neurologiche a 6 mesi.,27
Oggi, tre studi clinici di fase III sono in corso previsto il reclutamento di un totale di 840 neonati per valutare la sicurezza e l’efficacia di alte dosi di EPO (1000IU/kg) combinato con l’ipotermia (Eritropoietina per Ipossico Ischemica Encefalopatia nei Neonati, NCT03079167; Alte dosi di Eritropoietina per Asfissia e di Encefalopatia, NCT02811263; Eritropoietina nella Gestione dei Neonatale Ipossico Ischemica Encefalopatia, NCT03163589). L’obiettivo principale del primo 2 è quello di ridurre la mortalità o la disabilità a 2 anni, mentre il terzo valuterà questi due risultati dopo 1 anno., Attendiamo i risultati di questi e di altri studi per determinare se l’EPO o uno qualsiasi dei suoi derivati sono efficaci e come dovrebbero essere usati nella pratica clinica, valutando fattori come la dose minima efficace, la via di somministrazione, la durata del trattamento, ecc.
Cellule staminali
L’uso di cellule staminali per il trattamento di tutti i tipi di malattie, tra cui HIE, è un campo di ricerca che continua a crescere., Questo approccio terapeutico potrebbe aiutare a riparare e rigenerare il tessuto cerebrale danneggiato dopo l’insulto ipossico-ischemico attraverso l’interazione di cellule staminali con cellule immunitarie in organi distanti dal cervello, come la milza, alterando così la risposta immunitaria/infiammatoria. Allo stesso modo, il recupero funzionale ottenuto con la loro somministrazione può essere in parte spiegato dall’interazione delle cellule trapiantate e del tessuto cerebrale, con la conseguente produzione di fattori di crescita il cui effetto finale si rifletterebbe nell’aumento della neurogenesi e della proliferazione cellulare.,
anche se abbiamo ancora bisogno di approfondire la nostra conoscenza per essere in grado di utilizzare le cellule staminali come terapia efficace, studi sperimentali sugli animali hanno dimostrato che diversi tipi di cellule staminali sono in grado di sopravvivere nel cervello danneggiato, si differenziano in neuroni e glia, integrare nel tessuto bersaglio e favorevolmente modificare comportamentali risultati (rivisto in Bennet et al.28)., Recenti studi hanno riportato che la somministrazione di cellule staminali mesenchimali combinato con 24 ore di raffreddamento in cuccioli di ratto 7 giorni dopo la nascita ottenuto risultati migliori rispetto al trattamento in isolamento,29 e hanno anche scoperto che l’ipotermia si espande la finestra terapeutica per la somministrazione di cellule staminali mesenchimali per fino a 2 giorni dopo il danno ipossico-ischemico evento.,30 Inoltre, le cellule staminali possono regolare la risposta immunitaria attraverso le loro interazioni con cellule immunitarie effettrici situate in organi distanti dal cervello, come la milza, la cui mobilizzazione è nota per avere il potenziale di esacerbare la risposta infiammatoria e il danno ischemico nel cervello immaturo, migliorando così il loro effetto neuroprotettivo.,31,32
La terapia con cellule staminali, da sola o in combinazione con ipotermia terapeutica, è un campo di ricerca promettente che richiede ancora studi clinici per determinare, tra gli altri aspetti, il tipo più efficace di cellule staminali e il dosaggio ottimale e la durata del trattamento per ottenere i migliori risultati possibili del trattamento.,28 Uno dei progetti attualmente in corso nella fase di reclutamento (Studio di hCT-MSC in neonati con HIE moderata o grave, NCT03635450) includerà 6 neonati nati in età gestazionale di 36 o più settimane con HIE da moderata a grave da trattare con ipotermia e 2 dosi endovenose di cellule stromali mesenchimali derivate dal tessuto del cordone ombelicale (hCT-MSC). Gli obiettivi principali di questo studio di fase I sono valutare la sicurezza dell’hCT-MSC e analizzare i risultati di sopravvivenza e sviluppo neurologico nei partecipanti rispettivamente a 6 e 16 mesi., Un altro studio di fase I (NCT00593242) ha ottenuto risultati promettenti con il trapianto autologo di cellule del sangue del cordone ombelicale, con il 74% dei neonati che hanno ricevuto cellule staminali sopravvissute con punteggi di 85 o superiori nelle scale di Bayley rispetto al 41% dei neonati trattati con il solo raffreddamento.33
N-acetilcisteina
La n-acetilcisteina (NAC) è un precursore della cisteina che elimina i radicali liberi e partecipa al mantenimento del glutatione,34 regolando così lo stress ossidativo., Evidenze da modelli animali hanno mostrato una maggiore riduzione del volume dell’infarto cerebrale negli animali trattati con una combinazione di NAC e ipotermia rispetto agli animali trattati con uno solo di questi interventi. Inoltre, gli animali trattati con terapia di associazione hanno mostrato risultati simili nei riflessi e nel danno alla sostanza bianca a quelli riscontrati nel gruppo di controllo.35 Poiché la sua somministrazione durante la gravidanza non ha effetti teratogeni e può attraversare la placenta,36 NAC è diventato considerato uno degli agenti terapeutici più promettenti per un uso futuro nelle unità di terapia intensiva neonatale., Tuttavia, a nostra conoscenza non sono stati progettati studi clinici fino ad oggi per valutare il suo uso nella gestione di HIE, e le prove disponibili sono limitate a studi relativi all’infiammazione intra-amniotica, alla corioamnionite o alla sindrome da distress respiratorio.
Gas nobili
Gas nobili come xenon e radon hanno mostrato effetti neuroprotettivi in modelli animali di HI neonatale. Numerosi studi hanno analizzato la possibilità di utilizzare lo xeno come agente terapeutico (per una revisione delle prove, vedere l’articolo di Lobo et al.,37) grazie alla sua capacità di ridurre l’eccitotossicità dopo un insulto HI attraverso la modulazione dei recettori del glutammato NMDA.38,39
Lo studio clinico multicentrico Total Body ipotermia plus Xenon (TOBY-Xe) ha utilizzato gas xeno in combinazione con ipotermia in un campione di 92 bambini nati tra le 36 e le 43 settimane di gestazione., Sebbene non abbia trovato differenze significative tra i gruppi,40 con l’obiettivo di ottenere informazioni più dettagliate su alcune delle variabili che potrebbero aver avuto un impatto sui risultati del trattamento con questo gas nobile, come il suo dosaggio o la durata, è attualmente in corso uno studio clinico di fase II (Studio CoolXenon3, NCT02071394).,
D’altra parte, non ci sono stati studi clinici sull’argon fino ad oggi, ma l’argon ha dimostrato di migliorare i risultati del raffreddamento in termini di livelli del marcatore N-acetil-aspartato/lattato, che è stato associato ad aumenti dei valori medi di morte cellulare e allo sviluppo di sequele neurologiche nei neonati affetti.41 Questi risultati promettenti, insieme alla sua maggiore biodisponibilità e al costo inferiore rispetto allo xeno, rendono l’argon una molecola con un alto potenziale di traduzione da banco a letto nel trattamento dell’HIE.,
Conclusioni
Raggiungere un trattamento efficace per HIE è una delle grandi sfide che la medicina moderna deve affrontare. Per questo motivo, da anni sono stati fatti notevoli sforzi per analizzare i meccanismi che portano al danno delle cellule cerebrali dopo l’asfissia perinatale con l’obiettivo di sviluppare trattamenti efficaci per bloccarle. Attualmente, pediatri e neuroscienziati stanno tentando di sviluppare nuovi composti che potrebbero lavorare in sinergia con l’ipotermia con l’obiettivo di ridurre al minimo le sequele neurologiche di HIE., D’altra parte, recenti studi hanno iniziato a includere il sesso tra le variabili da tenere in considerazione nella gestione dell’HIE, poiché sono state riscontrate differenze sessuali dimorfiche sia nei meccanismi di lesione (nei modelli sperimentali, le femmine hanno mostrato maggiori deficit di memoria, mentre gli animali maschi hanno mostrato maggiore suscettibilità allo stress ossidativo), sia nei percorsi dei diversi trattamenti in esame., Nonostante i promettenti progressi fatti con l’uso di melatonina o composti come l’EPO, sono ancora necessari studi preclinici per chiarire ulteriormente i meccanismi di azione di queste molecole e sono necessari studi clinici con campioni più grandi per determinare il dosaggio ottimale e le vie di somministrazione di questi e altri trattamenti.
Finanziamento
Lo studio è stato sostenuto da una sovvenzione concessa dall’UPV/EHU nell’ambito del programma di finanziamento del gruppo di ricerca dell’università (GIU 17/018).
Conflitti di interesse
Gli autori non hanno conflitti di interesse da dichiarare.