Semplice Anatomia della retina di Helga Kolb
Helga Kolb
1. Panoramica.
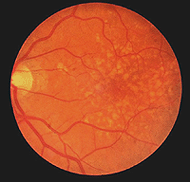
Quando un oftalmologo usa un oftalmoscopio per guardare negli occhi, vede la seguente vista della retina (Fig. 1).

Al centro della retina c’è il nervo ottico, un’area bianca da circolare a ovale che misura circa 2 x 1,5 mm. Dal centro del nervo ottico irradia i principali vasi sanguigni della retina. Circa 17 gradi (4.,5-5 mm), o due diametri e mezzo del disco a sinistra del disco, si può vedere la macchia rossastra leggermente ovale, priva di vasi sanguigni, la fovea, che si trova al centro dell’area nota come macula dagli oftalmologi.
Fig. 1. Retina vista attraverso un oftalmoscopio
CLICCA QUI per vedere un’animazione (dall’iride alla retina) (Quicktime movie)
Un campo circolare di circa 6 mm attorno alla fovea è considerato la retina centrale mentre oltre questa è la retina periferica che si estende fino all’ora serrata, a 21 mm dal centro della retina (fovea)., La retina totale è un disco circolare di diametro compreso tra 30 e 40 mm (Polyak, 1941; Van Buren, 1963; Kolb, 1991).
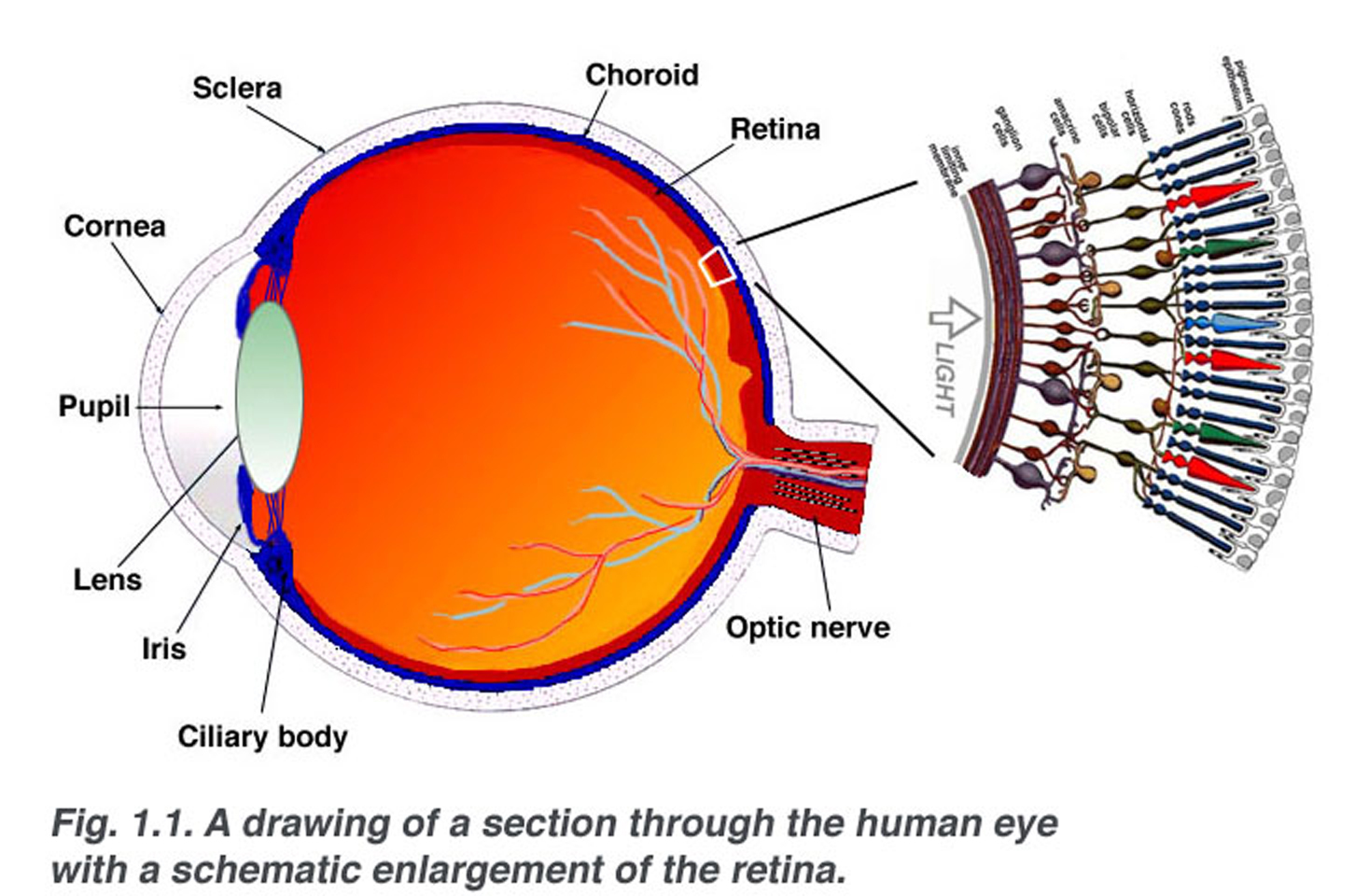
Fig. 1.1. Una sezione schematica attraverso l’occhio umano con un ingrandimento schematico della retina
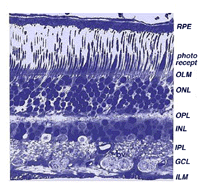
La retina ha uno spessore di circa 0,5 mm e riveste la parte posteriore dell’occhio. Il nervo ottico contiene gli assoni delle cellule gangliari che corrono verso il cervello e, inoltre, i vasi sanguigni in entrata che si aprono nella retina per vascolarizzare gli strati retinici e i neuroni (Fig. 1.1)., Una sezione radiale di una porzione della retina rivela che le cellule gangliari (i neuroni di uscita della retina) si trovano più all’interno della retina più vicina alla lente e alla parte anteriore dell’occhio, ei fotosensori (i bastoncelli e i coni) si trovano più all’esterno della retina contro l’epitelio pigmentato e la coroide. La luce deve quindi attraversare lo spessore della retina prima di colpire e attivare i bastoncelli e i coni (Fig. 1.1)., Successivamente l’assorbimento dei fotoni da parte del pigmento visivo dei fotorecettori viene tradotto prima in un messaggio biochimico e poi in un messaggio elettrico che può stimolare tutti i neuroni successivi della retina. Il messaggio retinico riguardante l’input fotico e una certa organizzazione preliminare dell’immagine visiva in diverse forme di sensazione vengono trasmessi al cervello dal modello di scarica delle cellule gangliari.,
Uno schema elettrico semplicistico della retina enfatizza solo i fotorecettori sensoriali e le cellule gangliari con alcuni interneuroni che collegano i due tipi di cellule come visto in Figura 2.
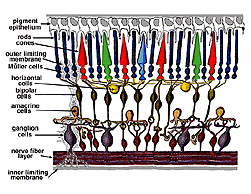
Fig. 2., Organizzazione semplice della retina
Quando un anatomista prende una sezione verticale della retina e la elabora per l’esame microscopico diventa ovvio che la retina è molto più complessa e contiene molti più tipi di cellule nervose rispetto allo schema semplicistico (sopra) aveva indicato. È immediatamente evidente che ci sono molti interneuroni impacchettati nella parte centrale della sezione della retina che intervengono tra i fotorecettori e le cellule gangliari (Fig 3).,

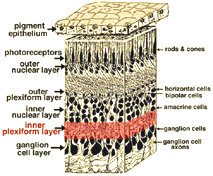
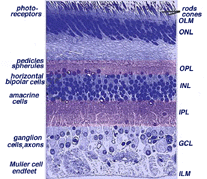
Tutte le retine vertebrate sono composte da tre strati di corpi delle cellule nervose e due strati di sinapsi (Fig. 4). Lo strato nucleare esterno contiene corpi cellulari dei bastoncelli e dei coni, lo strato nucleare interno contiene corpi cellulari delle cellule bipolari, orizzontali e amacrine e lo strato di cellule gangliari contiene corpi cellulari di cellule gangliari e cellule amacrine spostate. Dividendo questi strati di cellule nervose ci sono due neuropili in cui si verificano contatti sinaptici (Fig. 4).,
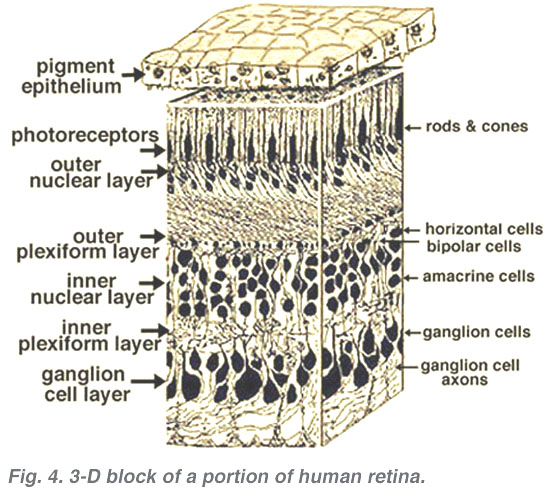
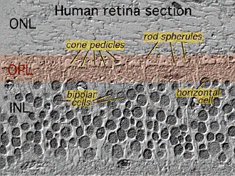
La prima area di neuropil è lo strato plessiforme esterno (OPL) in cui si verificano connessioni tra asta e coni e cellule bipolari in esecuzione verticale e cellule orizzontali orientate orizzontalmente (Fig. 5 e 6).
|
|
|
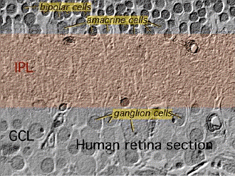
La seconda neuropilo della retina, che è lo strato plessiforme interno (IPL), e funziona come una stazione di rilancio per il verticale-trasporto di informazioni di cellule nervose, cellule bipolari, per la connessione a cellule gangliari (Figg. 7 e 8). Inoltre, diverse varietà di cellule amacrine orientate orizzontalmente e verticalmente, in qualche modo interagiscono in ulteriori reti per influenzare e integrare i segnali delle cellule gangliari., È al culmine di tutta questa elaborazione neurale nello strato plessiforme interno che il messaggio relativo all’immagine visiva viene trasmesso al cervello lungo il nervo ottico.
|
|
|
2. Retina centrale e periferica a confronto.,
La retina centrale vicino alla fovea è considerevolmente più spessa della retina periferica(confronta i fichi. 9 e 10). Ciò è dovuto alla maggiore densità di imballaggio dei fotorecettori, in particolare i coni, e le loro cellule bipolari e gangliari associate nella retina centrale rispetto alla retina periferica.
|
|
|
- La retina centrale è dominata da cono mentre la retina periferica è dominata da bastoncelli. Così nella retina centrale i coni sono strettamente distanziati e le aste meno in numero tra i coni (Fig. 9 e 10).
- Lo strato nucleare esterno (ONL), composto dai corpi cellulari dei bastoncelli e dei coni, ha circa lo stesso spessore nella retina centrale e periferica., Tuttavia nella periferica i corpi delle cellule dell’asta superano i corpi delle cellule del cono mentre il contrario è vero per la retina centrale. Nella retina centrale, i coni hanno assoni obliqui che spostano i loro corpi cellulari dai loro peduncoli sinaptici nello strato plessiforme esterno (OPL). Questi assoni obliqui con accompagnamento dei processi delle cellule di Muller formano un’area fibrosa dall’aspetto pallido nota come strato di fibra di Henle. Quest’ultimo strato è assente nella retina periferica.,
- Lo strato nucleare interno (INL) è più spesso nella zona centrale della retina rispetto alla retina periferica, a causa di una maggiore densità di neuroni del secondo ordine di collegamento conico (cellule bipolari coniche) e cellule orizzontali a campo più piccolo e più distanziate e cellule amacrine interessate alle vie del cono (Fig. 9). Come vedremo più avanti, i circuiti dei neuroni collegati ai coni sono meno convergenti in quanto meno coni interferiscono con i neuroni del secondo ordine, rispetto ai bastoncelli nei percorsi collegati ai bastoncelli.,
- Una notevole differenza tra retina centrale e periferica può essere vista negli spessori relativi degli strati plessiformi interni (IPL), degli strati di cellule gangliari (GCL) e dello strato di fibre nervose (NFL) (Figs. 9 e 10). Ciò è ancora dovuto il maggior numero e la densità aumentata dell’imballaggio delle cellule gangliari state necessarie per le vie del cono nella retina foveale cono-dominante rispetto alla retina periferica asta-dominante., Il maggior numero di cellule gangliari significa una maggiore interazione sinaptica in un IPL più spesso e un numero maggiore di assoni delle cellule gangliari che scorrono verso il nervo ottico nello strato di fibre nervose (Fig. 9).
3. Cellule gliali di Muller.
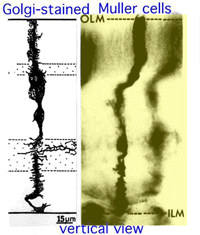
Fig. 11. Vista verticale delle cellule gliali di Muller macchiate di Golgi
Le cellule di Muller sono le cellule gliali radiali della retina (Fig. 11). La membrana limitante esterna (OLM) della retina è formata da giunzioni aderenti tra le cellule di Muller e i segmenti interni delle cellule fotorecettori., La membrana limitante interna (ILM) della retina è similmente composta di piedi laterali dell’estremità delle cellule di Muller di contatto e costituenti associati della membrana basale.
L’OLM forma una barriera tra lo spazio subretinale, in cui i segmenti interno ed esterno dei fotorecettori proiettano per essere in stretta associazione con lo strato epiteliale del pigmento dietro la retina e la retina neurale corretta. L’ILM è la superficie interna della retina che confina con l’umor vitreo e quindi forma una barriera di diffusione tra la retina neurale e l’umor vitreo (Fig. 11).,
In tutta la retina i principali vasi sanguigni del sistema vascolare retinico forniscono i capillari che corrono nel tessuto neurale. Capillari si trovano in esecuzione attraverso tutte le parti della retina dallo strato di fibra nervosa allo strato plexiform esterno e anche occasionalmente alto come nello strato nucleare esterno. I nutrienti dalla vascolarizzazione del coriocapillaris (cc) dietro lo strato di epitelio pigmentato forniscono il delicato strato di fotorecettori.
4. Struttura foveale.,
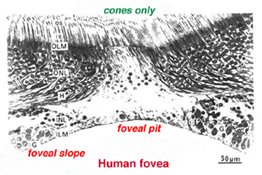
Il centro della fovea è noto come fossa foveale (Polyak, 1941) ed è una regione altamente specializzata della retina diversa di nuovo dalla retina centrale e periferica che abbiamo considerato finora. Le sezioni radiali di questa piccola regione circolare della retina che misura meno di un quarto di millimetro (200 micron) sono mostrate di seguito per l’uomo (Fig. 12a) e per la scimmia (Fig.12 ter).
|
|
|
fovea si trova nel centro della macula, la zona della retina temporale lato della testa del nervo ottico (Fig. 13 bis, lettere A, B)., È un’area in cui i fotorecettori a cono sono concentrati alla massima densità, con esclusione delle aste, e disposti alla loro densità di imballaggio più efficiente che è in un mosaico esagonale. Questo è più chiaramente visto in una sezione tangenziale attraverso i segmenti interni del cono foveale (Fig. 13 ter).
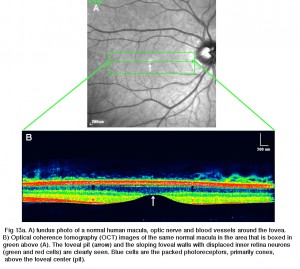
Fig 13a. A) foto del fondo di una normale macula umana, del nervo ottico e dei vasi sanguigni attorno alla fovea. B) Tomografia a coerenza ottica (OCT) immagini dello stesso maculare normale nell’area che è inscatolata in verde sopra (A)., La fossa foveale (freccia) e le pareti foveali inclinate con i neuroni della retina interna dissipati (cellule verdi e rosse) sono chiaramente visibili. Le cellule blu sono i fotorecettori imballati, principalmente coni, sopra il centro foveale (fossa).

Fig. 13. Sezione tangenziale attraverso la fovea umana
Sotto questa fossa foveale centrale del diametro di 200 micron, gli altri strati della retina vengono spostati concentricamente lasciando solo il foglio più sottile della retina costituito dalle cellule del cono e da alcuni dei loro corpi cellulari (lati destro e sinistro dei fichi., 12 bis e 12 ter). Ciò è particolarmente ben visto nelle immagini di tomografia a coerenza ottica (OCT)dell’occhio vivente e della retina (Fig. 13 bis, lettera B). La stratificazione radialmente distorta ma completa della retina appare quindi gradualmente lungo il pendio foveale fino a quando il bordo della fovea è costituito dai neuroni spostati del secondo e del terzo ordine relativi ai coni centrali. Qui le cellule gangliari sono ammucchiate in sei strati rendendo così quest’area, chiamata bordo foveale o parafovea (Polyak, 1941), la porzione più spessa dell’intera retina.
5. Macula lutea.,
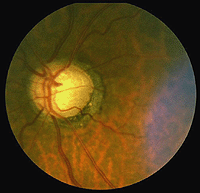
L’intera area foveale compresa fossa foveale, pendenza foveale, parafovea e perifovea è considerata la macula dell’occhio umano. Familiare agli oftalmologi è una pigmentazione gialla nell’area maculare nota come macula lutea(Fig. 14).
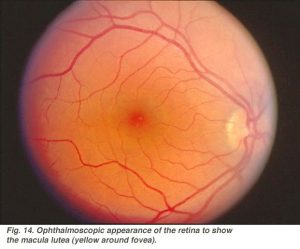 Questa pigmentazione è il riflesso dei pigmenti di screening gialli, i carotenoidi della xantofilla zeaxantina e luteina (Balashov e Bernstein, 1998), presenti negli assoni a cono dello strato di fibra di Henle. Si pensa che la macula lutea agisca come un filtro a lunghezza d’onda corta, aggiuntivo a quello fornito dalla lente (Rodieck, 1973)., Poiché la fovea è la parte più essenziale della retina per la visione umana, sono essenziali meccanismi protettivi per evitare la luce intensa e in particolare i danni da irradiazione ultravioletta. Perché, se i coni delicati della nostra fovea vengono distrutti diventiamo ciechi.
Questa pigmentazione è il riflesso dei pigmenti di screening gialli, i carotenoidi della xantofilla zeaxantina e luteina (Balashov e Bernstein, 1998), presenti negli assoni a cono dello strato di fibra di Henle. Si pensa che la macula lutea agisca come un filtro a lunghezza d’onda corta, aggiuntivo a quello fornito dalla lente (Rodieck, 1973)., Poiché la fovea è la parte più essenziale della retina per la visione umana, sono essenziali meccanismi protettivi per evitare la luce intensa e in particolare i danni da irradiazione ultravioletta. Perché, se i coni delicati della nostra fovea vengono distrutti diventiamo ciechi.
Fig. 14. Aspetto oftalmoscopico della retina per mostrare macula lutea

Fig. 15. Sezione verticale attraverso la fovea scimmia per mostrare la distribuzione della macula lutea. Da Snodderly et al.,, 1984
Il pigmento giallo che forma la macula lutea nella fovea può essere chiaramente dimostrato osservando una sezione della fovea al microscopio con luce blu (Fig. 15). Il modello scuro nella fossa foveale che si estende fino al bordo del pendio foveale è causato dalla distribuzione del pigmento maculare (Snodderly et al., 1984).

Fig. 16., Aspetto del mosaico conico nella fovea con e senza macula lutea
Se si dovesse visualizzare il mosaico fotorecettore foveo come se i pigmenti visivi nei singoli coni non fossero sbiancati, si vedrebbe l’immagine mostrata in Figura 16 (fotogramma inferiore) (immagine da Lall e Cone, 1996). I coni sensibili a lunghezza d’onda corta sul pendio foveale sembrano verde giallo pallido, i coni di lunghezza d’onda media, rosa e i coni sensibili a lunghezza d’onda lunga, viola., Se aggiungiamo ora l’effetto del pigmento giallo di screening della macula lutea, vediamo l’aspetto del mosaico del cono nella Figura 16 (cornice superiore). La macula lutea aiuta a migliorare la risoluzione acromatica dei coni foveali e blocca l’irradiazione dannosa della luce UV (Fig. 16 da Abner Lall e Richard Cone, dati inediti).
6. Strato di fibra delle cellule gangliari.
Gli assoni delle cellule gangliari corrono nello strato di fibra nervosa sopra la membrana limitante interna verso la testa del nervo ottico in una forma arcuata (Fig. 00, streaming fibre rosa)., La fovea è, naturalmente, priva di uno strato di fibra nervosa poiché la retina interna e le cellule gangliari vengono allontanate verso il pendio foveale. Le fibre delle cellule gangliari centrali corrono attorno al pendio foveale e spazzano nella direzione del nervo ottico. Gli assoni delle cellule gangliari periferiche continuano questo corso di arco verso il nervo ottico con una divisione dorso / ventrale lungo il meridiano orizzontale (Fig. 00). La topografia retinica viene mantenuta nel nervo ottico, attraverso il genicolato laterale alla corteccia visiva.
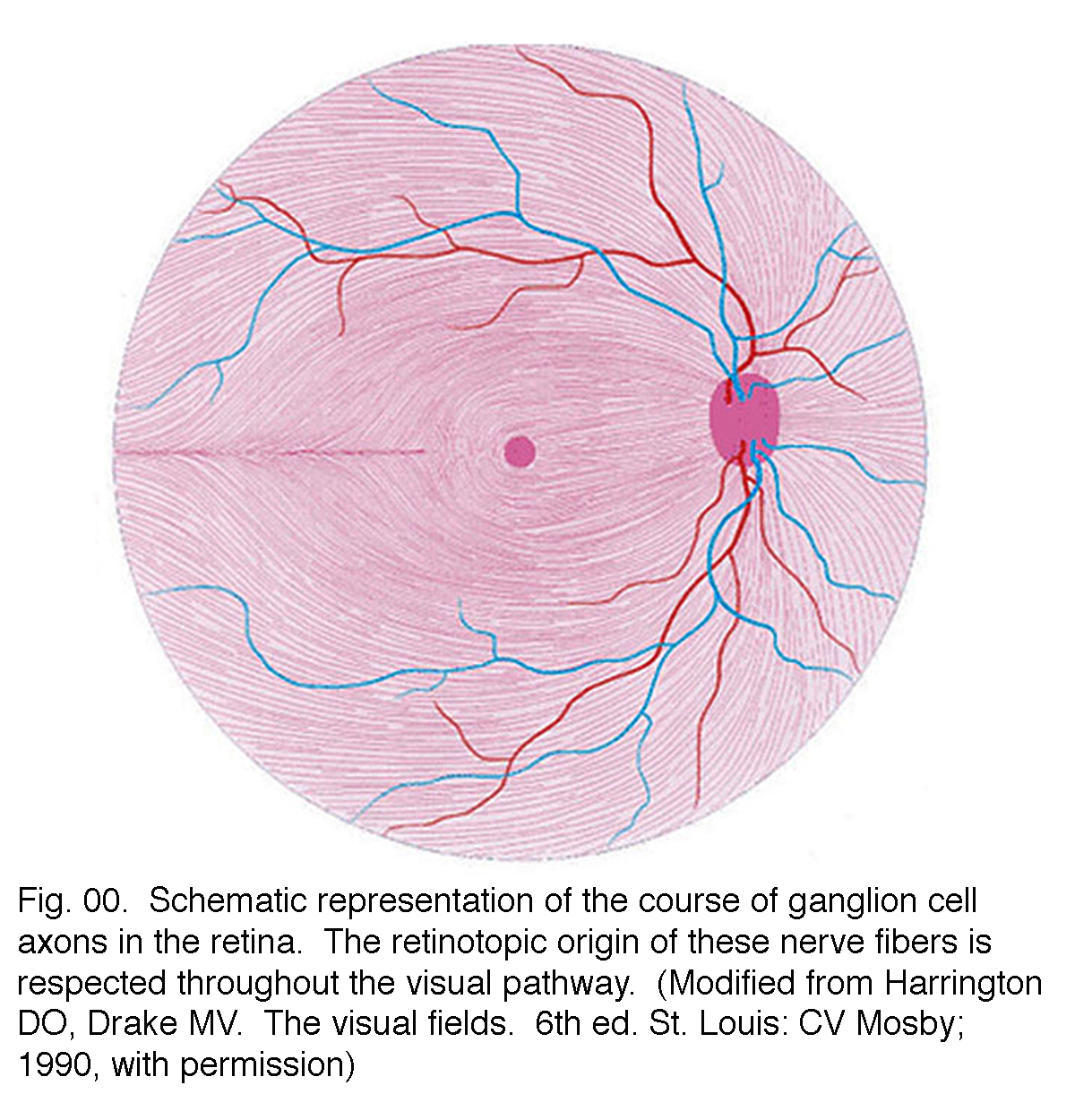
Fig. 00., Rappresentazione schematica del decorso degli assoni delle cellule gangliari nella retina. L’origine retinotopica di queste fibre nervose è rispettata in tutto il percorso visivo. (Modificato da Harrington DO, Drake MV. I campi visivi. 6a ed. St. Louis: CV Mosby; 1990, con permesso)
7. Rifornimento di sangue alla retina.
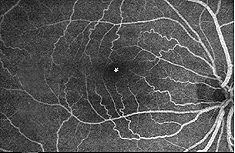
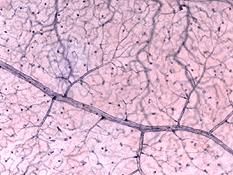
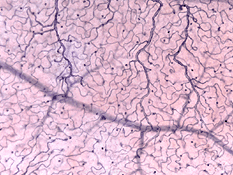
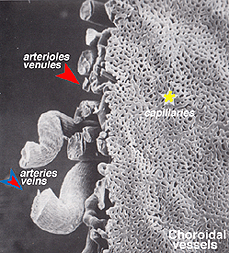
Esistono due fonti di afflusso di sangue alla retina dei mammiferi: l’arteria retinica centrale e i vasi sanguigni coroidali. La coroide riceve il maggior flusso sanguigno (65-85%) (Henkind et al.,, 1979) ed è vitale per il mantenimento della retina esterna (in particolare i fotorecettori) e il restante 20-30% scorre alla retina attraverso l’arteria retinica centrale dalla testa del nervo ottico per nutrire gli strati retinici interni. L’arteria retinica centrale ha 4 rami principali nella retina umana (Fig. 17).
Fig. 17. Fotografia del fondo che mostra l’imaging di flourescein delle principali arterie e vene in una normale retina dell’occhio destro umano., I vasi emergono dalla testa del nervo ottico e corrono in modo radiale curvando verso e intorno alla fovea (asterisco in fotografia) (Immagine gentilmente concessa da Isabel Pinilla, Spagna)
I rami intraretinici arteriosi forniscono quindi tre strati di reti capillari cioè 1) i capillari peripapillari radiali (RPC) e 2) uno interno e 3) uno strato esterno di capillari (Fig. 18 bis). Le venule precapillari drenano in venule e attraverso il corrispondente sistema venoso alla vena retinica centrale (Fig. 18 ter).,
|
|
|
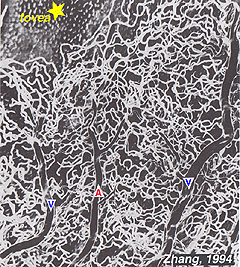
La radiale peripapillary capillari (Rpc) sono più superfical livello dei capillari che giace nella parte interna dello strato di fibre nervose, e correre lungo i percorsi delle principali superotemporal e inferotemporal vasi 4-5 mm dal disco ottico (Zhang, 1994). I RPC anatomosi tra loro e i capillari più profondi. I capillari interni si trovano negli strati delle cellule gangliari sotto e paralleli agli RPC., La rete capillare esterna va dallo strato plessiforme interno allo strato plessiforme esterno pensato lo strato nucleare interno (Zhang, 1974).
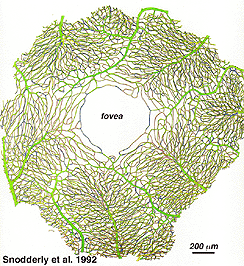
Come si noterà dall’angiografia flourescein della Figura 17, lì come un anello di vasi sanguigni nell’area maculare attorno a una zona priva di vasi sanguigni e capillari di 450-600 um di diametro, che denota la fovea. I vasi maculari derivano da rami delle arterie temporali e inferotemporali superiori. Al confine della zona avascolare i capillari diventano a due strati e infine si uniscono come un unico anello stratificato., Le venule di raccolta sono più profonde (posteriori)alle arteriole e drenano il flusso sanguigno nelle vene principali (Fig. 19, da Zhang, 1974). Nella scimmia rhesus questo anello perimacular e la fovea libera del vaso sanguigno è chiaramente visto nei bei disegni fatti dal gruppo di Max Snodderly (Fig. 20, Sodderly et al., 1992.)
|
|
|
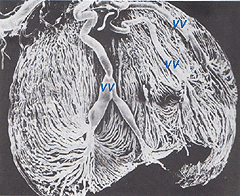
Le arterie coroidali derivano da arterie ciliari posteriori lunghe e corte e rami del cerchio di Zinn (attorno al disco ottico)., Ciascuna delle arterie ciliari posteriori si rompe in lobuli a forma di ventaglio di capillari che forniscono regioni localizzate della coroide (Hayreh, 1975). L’area maculare dei vasi coroidali non è specializzata come l’apporto di sangue retinico (Zhang, 1994). Le arterie perforano la sclera intorno al nervo ottico e si espandono per formare i tre strati vascolari nella coroide: strati esterni (più sclerali), mediali e interni (membrana Bruchs più vicina dell’epitelio pigmentato) dei vasi sanguigni. Questo è chiaramente mostrato nel getto di corrosione di una faccia tagliata della coroide umana nella figura 21a (Zhang, 1974)., I corrispondenti lobuli venosi drenano nelle venule e nelle vene che corrono anteriormente verso l’equatore del bulbo oculare per entrare nelle vene del vortice (Fig. 21 ter). Una o due vene a vortice drenano ciascuno dei 4 quadranti del bulbo oculare. Le vene a vortice penetrano nella sclera e si fondono nella vena oftalmica come mostrato nel getto di corrosione della Figura 21b (Zhang. 1994).
|
|
|
8., Malattie degenerative della retina umana.
La retina umana è una delicata organizzazione di neuroni, glia e vasi sanguigni nutrienti. In alcune malattie dell’occhio, la retina viene danneggiata o compromessa, e cambiamenti degenerativi impostati in quel eventally portare a gravi danni alle cellule nervose che trasportano i mesages vitali circa l’immagine visiva al cervello. Indichiamo quattro diverse condizioni in cui la retina è malata e la cecità può essere il risultato finale. Molte più informazioni riguardanti la patologia dell’intero occhio e della retina possono essere trovate in un sito web realizzato dal patologo oculista Dr., Nick Mamalis, Centro Occhi Moran.
|
|
|
La degenerazione maculare legata all’età è un problema retinico comune dell’occhio che invecchia e una delle principali cause di cecità nel mondo. L’area maculare e la fovea diventano compromesse a causa dell’epitelio pigmentato dietro la retina che degenera e forma drusen (macchie bianche, Fig. 22) e permettendo la perdita di liquido dietro la fovea. I coni della fovea muoiono causando una perdita visiva centrale, quindi non possiamo leggere o vedere dettagli precisi.
Glaucoma (Fig., 23) è anche un problema comune nell’invecchiamento, dove la pressione all’interno dell’occhio diventa elevata. La pressione aumenta perché la camera anteriore dell’occhio non può scambiare correttamente il fluido con i normali metodi di deflusso acquoso. La pressione all’interno della camera vitrea aumenta e compromette i vasi sanguigni della testa del nervo ottico e alla fine gli assoni delle cellule gangliari in modo che queste cellule vitali muoiano. Il trattamento per ridurre la pressione intraoculare è essenziale nel glaucoma.
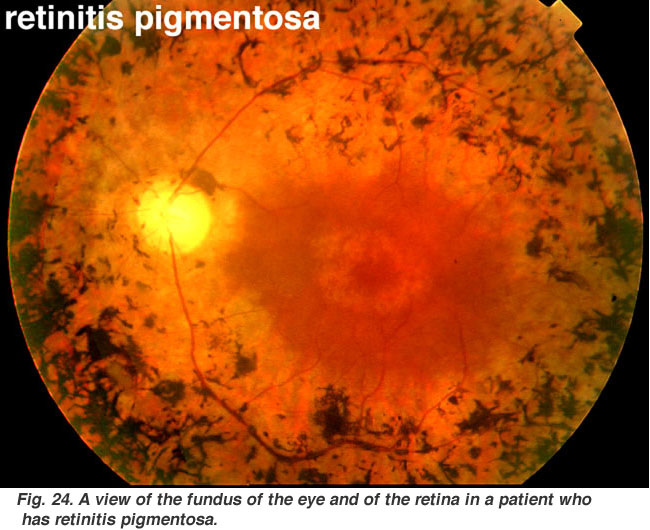
Fig. 24., Una visione del fondo oculare e della retina in un paziente affetto da retinite pigmentosa |
|
Retinits pigmentosa (Fig. 24) è una brutta malattia ereditaria della retina per la quale al momento non esiste una cura. Si presenta in molte forme e consiste in un gran numero di mutazioni genetiche attualmente in fase di analisi., La maggior parte dei geni difettosi che sono stati scoperti riguardano i fotorecettori dell’asta. Le aste della retina periferica iniziano a degenerare nelle prime fasi della malattia. I pazienti diventano ciechi notturni gradualmente man mano che sempre più della retina periferica (dove risiedono le aste) viene danneggiata. Eventualmente i pazienti sono ridotti alla visione a tunnel con solo la fovea risparmiato il processo di malattia. La patologia caratteristica è l’occorrenza di pigmento nero nella retina periferica e vasi sanguigni assottigliati alla testa del nervo ottico (Fig. 24).,
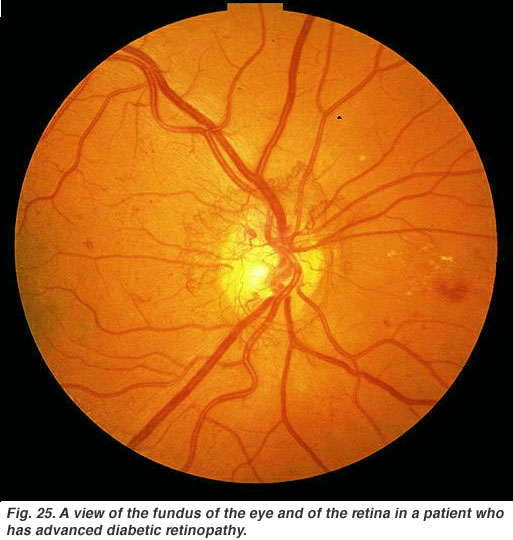
La retinopatia diabetica è un effetto collaterale del diabete che colpisce la retina e può causare cecità (Fig. 25). I vasi sanguigni nutrienti vitali dell’occhio diventano compromessi, distorti e si moltiplicano in modi incontrollabili. Trattamento laser per fermare la proliferazione dei vasi sanguigni e perdite di liquido nella retina, è il trattamento più comune al momento.
9. Riferimento.
Balashov NA, Bernstein PS. Purificazione e identificazione dei componenti delle vie metaboliche dei carotenoidi maculari umani. Investire Ophthal Vis Sci.1998; 39: s38.
Hageman GS, Johnson LV., L’interfaccia dell’epitelio pigmentato fotorecettore-retinico. In: Heckenlively JR, Arden GB, editori. Principi e pratica dell’elettrofisiologia clinica della vista. St. Louis: Mosby Year Book; 1991. pag. 53-68.
Harrington, D. O. e Drake, M. V. (1990) The Visual Fields, 6th ed. Mosby. Saint Louis.
Hayreh SS. Natura segmentale della vascolarizzazione coroidea. Br J Ophthal. 1975;59:631–648.
Kolb H. L’organizzazione neurale della retina umana. In: Heckenlively JR, Arden GB, editori. Principi e pratiche di elettrofisiologia clinica della vista. St. Louis: Mosby Anno Libro Inc.; 1991., pag. 25-52.
Polyak SL. Retina. Chicago: University of Chicago Press; 1941.
Rodieck RW. La retina dei vertebrati: principi di struttura e funzione. San Francisco: W. H. Freeman and Company; 1973.
Snodderly DM, Auran JD, Delori FC. Il pigmento maculare. II. Distribuzione spaziale nella retina dei primati. Investire Ophthal Vis Sci. 1984;25:674–685.
Snodderly DM, Weinhaus RS, Choi JC. Relazioni neuro-vascolari nella retina centrale delle scimmie Macache (Macaca fascicularis). J Neurosci. 1992;12:1169–1193.
Van Buren JM. Lo strato di cellule gangliari retinici., Springfield (IL): Charles C. Thomas; 1963.
Yamada E. Alcune caratteristiche strutturali della fovea centralis nella retina umana. Arch Ophthal. 1969;82:151–159.
Zhang HR. Scanning electron-microscopic study of corrosion casts on retinal and choroidal angioarchitecture in man and animals. Prog Ret Eye Res. 1994;13:243-270.