新生児の低酸素虚血性脳症における併用療法|Anales de Pediatría(English Edition)
はじめに
1-3例の発生率で1000満期出産あたり、1低酸素虚血性脳症(HIE)は新生児の脳損傷の最も頻繁な原因の一つである。 母体年齢の増加傾向や多胎妊娠の頻度などによるハイリスク出生数の増加を考慮すると、HIEは依然として決定的な解決策がない病院の環境において関連する問題であり続けている。,
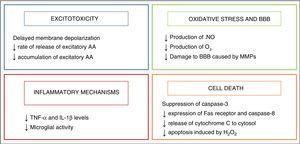
周産期仮死の病態生理に関する研究は、酸素欠乏による脳損傷が発症するにつれて、細胞および組織レベルで起こる複雑なプロセスを理解するこ 傷害の関与するメカニズムの多くは、発症までの経過タイミングに基づいてグループ化され、4つの主要なフェーズが記載されている(Fig. 1):低酸素性虚血(こんにちは)、潜伏段階、二次段階および三次段階の一次段階、か激しいエピソード。, 一次段階では、損傷は、細胞および組織への酸素の送達の減少に起因し、これは一次エネルギー障害をもたらす。 これに続いて、潜伏相として知られる高エネルギーリン酸化化合物のレベルが明らかに回復する。, しかし、この改善は一時的なものであり、新生児の脳損傷の発症に関与する病態生理学的メカニズムの多くが遊びに来る二次段階に道を譲り、興奮毒性、細胞内へのカルシウムイオンの大量流入、酸化ストレス、炎症、そしてほとんどの場合、壊死またはアポトーシスによる細胞死である。 最後に、三次期は、最初の低酸素虚血性傷害の数週間、数ヶ月または数年後の脳損傷の持続性によって特徴付けられる。,
HIEの基礎となる病態生理の理解は、窒息によって引き起こされる脳損傷および多数の治療戦略の開発を減らすのに役立つ可能性のある治療標 これらの治療法のいくつかは、現在試験中であり、新生児集中治療の設定で一般的に採用されているhieに対する唯一の治療法である治療的低体温と相乗的に作用することを意図している。,
低体温症
低体温症は、出生時に何らかの傷害を受けた乳児に現れる内因性冷却機構の発見の後、乳児の神経保護戦略として使用され始めた。2その神経保護効果は、主に脳の代謝活性の低下に関連しており、5%の温度が1℃低下するごとに、窒息によって引き起こされる有害な代謝経路のいくつかを調節する3つの図に要約されている。 2.
脳損傷メカニズムに対する低体温症の影響。
併用療法
証拠は、現在の低体温プロトコルがoptimal4であることを示唆しているので、臨床実practiceにおいて限られた有効性であることを示唆しているので、5我々は拡大する必要があるHIEの管理のための治療武器である。,6最近の研究では、病態生理学的カスケードの異なるレベルで作用し、両療法の相乗効果を促進するように設計された低体温と組み合わせて使用することができる治療法の開発と実施に焦点を当てているFig。 3).

新生児HIEの管理のための試験の対象となる可能性のある治療標的および主要な神経保護戦略。
メラトニン
メラトニン(N-アセチル-5-メトキシトリプタミナ)は、松果体によって合成される神経ホルモンであり、その分泌は夜/日のサイクルに従い、その主な役割は概日リズムを調節することにある。 HIEの管理におけるその使用を可能にする重要な側面は、その強力な抗酸化物質および抗炎症活性7および血液脳関門を通過して中枢神経系に到達,8
新生児で試される前に、メラトニンは、窒息の子豚モデルにおける脳エネルギー代謝の最適化を通じて低体温によって与えられる保護のレベルを9臨床現場では、Alyらによって発表された研究。窒息した新生児の半分を低体温に割り当て、経口経路によって送達されるメラトニンの5用量10mg/kg/日を割り当てた。, 著者らは、併用療法で治療された患者において、冷却単独で治療された患者と比較して、スーパーオキシドジスムターゼと一酸化窒素の血清レベルが低下することを見出し、酸化ストレスに対する両方の戦略の組み合わせの有益な効果を実証した。
Balduiniらによって実施された最近の研究。, 低体温と組み合わせて使用されるメラトニンの安全性、薬物動態、投与量および有効性を評価するために、冷却はメラトニン11の薬物動態に影響を与えず、実験動物モデルで使用されるものと比較して低かったホルモン投与用量の高い血清レベルを得ることが可能であることがわかった。 現在、MELPRO(NCT03806816)臨床試験では、新生児100人のサンプルを目指して患者を募集しています。, この研究および他の同様の研究は、将来の第III相臨床試験の開発およびその後の日常臨床診療におけるメラトニンの使用に不可欠である。
アロプリノール
HIEの管理におけるアロプリノールの使用の理論的根拠は、酸化ストレスに関与する酵素であるキサンチンオキシダーゼに対するその阻 さらに、この薬物は遊離鉄キレート剤として作用し、ヒドロキシルラジカルを隔離する。,こんにちは、こんにちは。12,13動物を1の5群(対照群、HI群、低体温で治療された群、アロプリノールで治療された群および併用療法で治療された群)に割り当てられたラット子犬における前臨床研究では、HI侮辱の後の72hは、併用療法群が最も低い梗塞量を示したことがわかった。これは、併用療法グループが最も低い梗塞量を示した。,14
その薬理学的特性に関しては、アロプリノールは迅速に胎盤を通過し、新生児の治療濃度を達成することができ、静脈内投与500mgのアロプリノールを受けた妊婦に対して行われた研究で示されているように、臍帯血サンプル中のアロプリノールの最適レベルの証拠で、臍帯血サンプル中の5分後に最適レベルを示すことができる。15van Belらによって行われた研究。, 1998年にそれは厳しいHIEの窒息させた新生児の潜在的な酸化防止効果を分析したallopurinolの40mg/kgの静脈内投与が遊離基の形成の減少を達成したことが分13しかし、後にBendersらによって行われた研究。 2006年には、アロプリノールで治療された群と対照群との間に違いは見つからなかった。16結論において、これらの著者は、有意な差の欠如の可能な説明として、サンプルに含まれる新生児におけるHIEの極端な重症度を同定した。, 彼らはまた、アロプリノールの投与までの期間(再灌流後3–4h)が良好な結果を達成するには長すぎる可能性があるという仮説を立てた。 後者の点に関連して、Gunes et al. 以前の2つの研究で与えられた同じ用量のアロプリノールを投与したが、出生から2時間以内に投与し、治療群における神経発達転帰の改善を見出した。,17同じ線に沿って、低酸素症または初期低酸素症を伴う胎児の送達中の母親への静脈内アロプリノールの投与は、治療の有効性を増加させ、脳損傷のマーカーであるプロテインS-100βの臍帯血レベルを低下させた。18神経認知的転帰(NCT03162653)に対する低酸素虚血性脳損傷に対するアロプリノールの効果という名の臨床試験は、出生後の最初の数分でこの酵素阻害剤の投与の潜在的な治療効果を評価するために現在進行中である。,エリスロポエチン(EPO)は成長因子およびneuroprotective代理店として機能する腎臓および成長の頭脳によって胎児の生命のそして生れの後でレバーによって総合される30.4kDaを測定するcytokineです。19HIEにおけるEPOおよび組換えヒトEPO(rhEPO)の両方の使用は、ニューロンおよびグリアに存在するEPO受容体の関与を通じて、20強力な抗アポトーシス剤(抗アポトーシス遺伝子BCL-2およびBCL-XLの転写を刺激する)および抗炎症性および酸化防止剤としての活性に基づいている。,19,21その神経保護効果に加えて、EPOは、血管新生、オリゴデンドロゲネシスおよび神経新生などの長期修復プロセスを促進することができる。22,23
EPOまたはrhEPOの投与を低体温と組み合わせることの相乗効果を評価した前臨床試験は、矛盾した結果をもたらした。 出生後7日目における低酸素虚血性脳損傷の同様のラットモデルにおいて、Fang et al. それらの併用の有意な神経保護効果は見られなかった。24しかし、ファンらによって行われた別の研究で。,,25著者らは、ラットの子犬の感覚運動機能に対する軽度の有益な効果を観察したが、この違いは脳組織試料の組織学的特徴には反映されなかった。
hieを有する新生児における研究は、rhEPOの使用が300–2500IU/kgの用量で安全であることを示している。 RhEPOの低い線量は適当な損傷の患者で有効あり、不能または死の減らされた危険と関連付けられるようです。26高用量(2500IU/kgまで)は、6ヶ月で発作および神経学的異常の発生率を減少させることができる。,27
今日、三相第III相臨床試験は、低体温症(新生児における低酸素性虚血性脳症のためのエリスロポエチン、Nct03079167;窒息および脳症のための高用量エリスロポエチン、NCT02811263;新生児低酸素性虚血性脳症の管理におけるエリスロポエチン、NCT03163589)と組み合わせた高用量EPO(1000IU/kg)の安全性および有効性を評価するために、新生児の合計の計画された募集と進行中である。 最初の2つの主な目標は、2年の死亡率または障害を減らすことであり、第三は1年後にこれら二つの結果を評価することである。, 我々は、これらおよび他の研究の結果を待って、EPOまたはその誘導体のいずれかが有効であるかどうか、そしてそれらが臨床現場でどのように使用されるべきかを決定し、最小有効用量、投与経路、治療期間などの要因を評価する。
幹細胞
HIEを含むあらゆる種類の疾患の治療に幹細胞を使用することは、成長を続けている研究分野です。, この治療アプローチは、脾臓などの脳から遠く離れた器官における幹細胞と免疫細胞との相互作用を通じて、低酸素虚血性傷害後の損傷した脳組織を修復および再生するのに役立ち、免疫/炎症反応を変化させる。 同様に、それらの投与によって達成される機能回復は、移植された細胞と脳組織との相互作用によって部分的に説明され、最終的な効果が神経新生および細胞増殖の増加に反映される成長因子のその後の産生によって説明される可能性がある。,
幹細胞を有効な治療法として使用できるようにするためにはまだ知識を深める必要がありますが、動物を対象とした実験研究では、異なるタイプの幹細胞が損傷した脳で生存し、ニューロンまたはグリアに分化し、標的組織に統合し、行動アウトカムを良好に変更することができることが実証されています(Bennet et al.28)., 最近の研究では、ラットの子犬における冷却の24hと組み合わせた間葉系幹細胞の投与は、出生後7日間隔でのいずれかの治療と比較してより良い転帰を達成したことが報告されている,29また、低体温症は、低酸素虚血事象後2日までに間葉系幹細胞の投与のための治療時間ウィンドウを拡大することを発見しました.,30さらに、幹細胞は、脾臓などの脳から離れた器官に位置するエフェクター免疫細胞との相互作用によって免疫応答を調節することができ、その動員は、未熟脳における炎症応答および虚血性損傷を悪化させる可能性があることが知られており、それによって神経保護効果を高めることができる。,31,32
幹細胞療法は、単独で、または治療低体温と組み合わせて、まだ他の側面の中で、幹細胞の最も効果的なタイプと可能な限り最高の治療結果を得るために、治療の最適な投与量と期間を決定するために臨床試験を必要とする研究の有望な分野です。,28募集フェーズ(中等度または重度のHIEを有する新生児におけるhCT-MSCの研究、NCT03635450)で現在進行中のプロジェクトの一つには、低体温症で治療される中等度から重度のHIEを有する6週間以上の妊娠年齢で生まれた乳児36および臍帯組織由来の間葉系間質細胞(hCT-MSC)の2静脈内投与が含まれる。 この第i相試験の主な目的は、hCT-MSCの安全性を評価し、それぞれ6ヶ月および16ヶ月の参加者の生存および神経発達転帰を分析することである。, 別の第i相試験(NCT00593242)は、臍帯血細胞の自己移植で有望な結果を得ており、幹細胞を受けた新生児の74%がベイリースケールで85以上のスコアで生存し、冷却だけで治療された新生児の41%と比較していた。33
N-アセチルシステイン
N-アセチルシステイン(NAC)は、フリーラジカルを捕捉し、グルタチオンの維持に関与するシステインの前駆体であり、34このように酸化ストレスを調節する。, 動物モデルからの証拠は、これらの介入のいずれかのみで治療された動物と比較して、NACと低体温の組み合わせで治療された動物における脳梗塞容積のより大きな減少を示した。 さらに、併用療法で治療された動物は、反射および白質損傷において対照群に見られるものと同様の結果を示した。35妊娠中の投与は催奇形性効果がなく、胎盤を通過することができるため、36NACは新生児集中治療室での将来の使用のための最も有望な治療薬の一, しかし、我々の知る限り、hieの管理におけるその使用を評価するための臨床試験はこれまでに設計されておらず、利用可能な証拠は羊膜内炎症、絨毛膜炎炎
希ガス
キセノンやラドンのような希ガスは、新生児こんにちはの動物モデルで神経保護効果を示しています。 多数の研究が、治療剤としてキセノンを使用する可能性を分析している(証拠のレビューについては、Lobo et al.,37)NMDAグルタミン酸受容体の変調を介してこんにちは侮辱の後に興奮毒性を低減する能力に起因します。.38,39
multicentre臨床試験総体低体温プラスキセノン(TOBY-Xe)は、妊娠92週と36週の間に生まれた乳児のサンプルで低体温と組み合わせてキセノンガスを使用しました。, グループ間で有意差は見られませんでしたが、40この希ガスによる治療の結果に影響を与えた可能性のある変数のいくつかについてのより詳細な情,
一方、これまでにアルゴンの臨床試験は行われていないが、アルゴンはn-アセチル-アスパラギン酸/乳酸マーカーのレベルに関して冷却の転帰を改善することが示されており、これは平均細胞死値の増加および罹患した新生児における神経学的後遺症の発症に関連している。41これらの有望な結果は、キセノンと比較されるより高い生物学的利用能および低コストと共に、アルゴンをHIEの処置のベンチからベッドサイドへの翻訳のための高い潜在性の分子にします。,
結論
HIEに対する効果的な治療を達成することは、現代医学が直面する大きな課題の一つです。 このため、周産期仮死後の脳細胞損傷につながるメカニズムを分析し、それらをブロックする効果的な治療法を開発することを目的として、長年にわたってかなりの努力がなされてきた。 現在、小児科医および神経科学者は、hieの神経学的後遺症を最小限に抑えることを目的として、低体温症との相乗効果で働くことができる新しい化合物を開発しようとしている。, 一方、最近の研究では、傷害のメカニズム(実験モデルでは、雌の動物はより大きな記憶障害を示し、雄の動物は酸化ストレスに対するより大きな感受性を示している)および検討中の異なる治療の経路の両方において二形性の性差が見出されているため、HIEの管理に考慮すべき変数の間に性別を含めるようになっている。, メラトニンやEPOなどの化合物の使用による有望な進歩にもかかわらず、これらの分子の作用機序をさらに解明するためには前臨床研究が必要であり、これらおよび他の治療法の最適投与量および投与経路を決定するためにはより大きなサンプルを用いた臨床試験が必要である。
資金調達
この研究は、大学の研究グループ資金プログラム(GIU17/018)の一環としてUPV/EHUによって与えられた助成金によって支援されました。
利益相反
著者には、宣言すべき利益相反はありません。