10.6: Gitter Strukturer i Krystallinske faste stoffer
Enhet Celler av Metaller
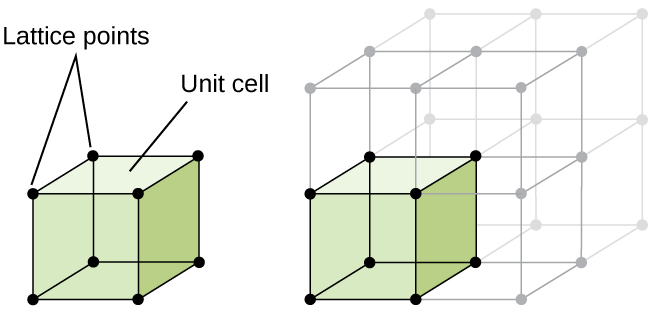
– struktur av krystallinske solid, om et metall eller ikke, kan best beskrives ved å vurdere sin enkleste å gjenta enhet, som er referert til som enhet sin celle. Enheten celle består av gitter poeng som representerer plasseringen av atomer eller ioner. Hele strukturen så består denne enheten celle gjenta i tre dimensjoner, som illustrert i Figur \(\PageIndex{1}\).,
La oss begynne etterforskningen vår av crystal gitter-struktur og enhet celler med den mest enkel struktur og de mest grunnleggende enhet celle. For å visualisere dette, tenk på å ta et stort antall identiske områder, som for eksempel tennis baller, og arrangere dem jevnt i en beholder., Den enkleste måten å gjøre dette på ville være å lage lag som kuler i ett lag er direkte ovenfor de som er i laget under, som illustrert i Figur \(\PageIndex{2}\). Denne ordningen kalles enkel kubisk struktur, og enheten celle kalles enkel kubisk enhet, cellen eller primitive kubikk enhet celle.
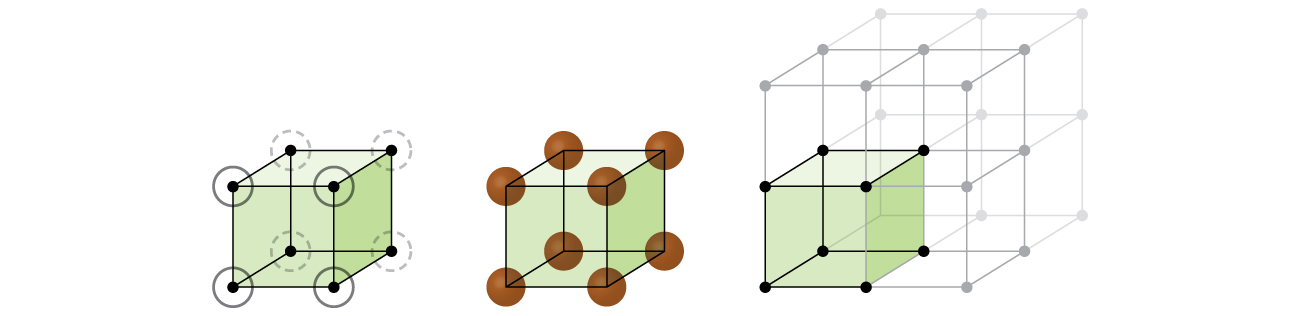
I en enkel kubisk struktur, kuler er ikke pakket så tett som de kunne være, og de bare «fylle» om lag 52% av volumet av beholderen. Dette er et relativt lite effektiv ordning, og bare ett metall (polonium, Po) crystallizes i en enkel kubisk struktur. Som vist i Figur \(\PageIndex{3}\), som er en solid med denne type arrangement består av fly (eller lag) hvor hvert atom kontakter bare de fire nærmeste naboer i sitt lag; ett atom direkte over den i lag over, og ett atom rett nedenfor det i laget under., Antall av andre partikler som hver partikkel i en krystallinsk solid kontakter er kjent som sin koordinering antall. For en polonium atom i en enkel kubisk utvalg, koordinering tallet er, derfor, seks.

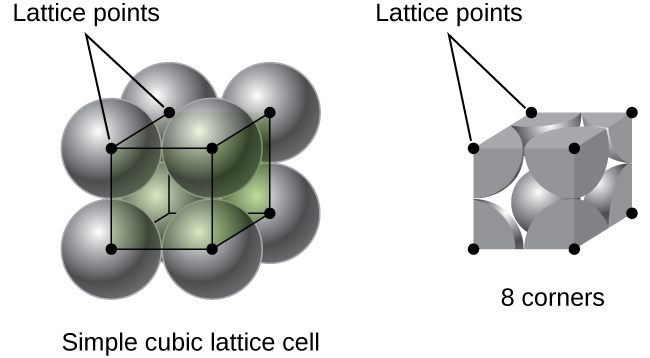
I en enkel kubisk gitter, enheten celle som gjentas i alle retninger er en kube som er definert av sentre for åtte atomer, som vist i Figur \(\PageIndex{4}\). Atomer på tilstøtende hjørner av denne enheten celle kontakt med hverandre, slik at kanten lengden av denne cellen er lik to atomic radier, eller en atom-diameter. En kubisk enhet celle inneholder bare deler av disse atomene som er i den. Siden et atom i et hjørne av en enkelt kubikk enhet celle er inneholdt av totalt åtte enhet celler, bare en åttendedel av at atomet er innenfor en spesifikk enhet, cellen., Og siden hver enkelt kubikk enhet celle har ett atom i hvert av de åtte «hjørner» det er \(8×\dfrac{1}{8}=1\) atom innenfor en enkel kubisk enhet celle.
de Fleste metal krystaller er en av de fire store typer enhet celler., For nå, vil vi fokusere på de tre kubikk enhet celler: enkel kubisk (som vi allerede har sett), kropp-sentrert kubikk enhet, cellen, og ansikt-sentrert kubikk enhet celle—som alle er illustrert i Figur \(\PageIndex{5}\). (Merk at det er faktisk sju forskjellige gitter systemene, og noen av dem har mer enn én type gitter, for en sum av 14 forskjellige typer enhet celler. Vi la mer kompliserte geometrier for senere i denne modulen.,)
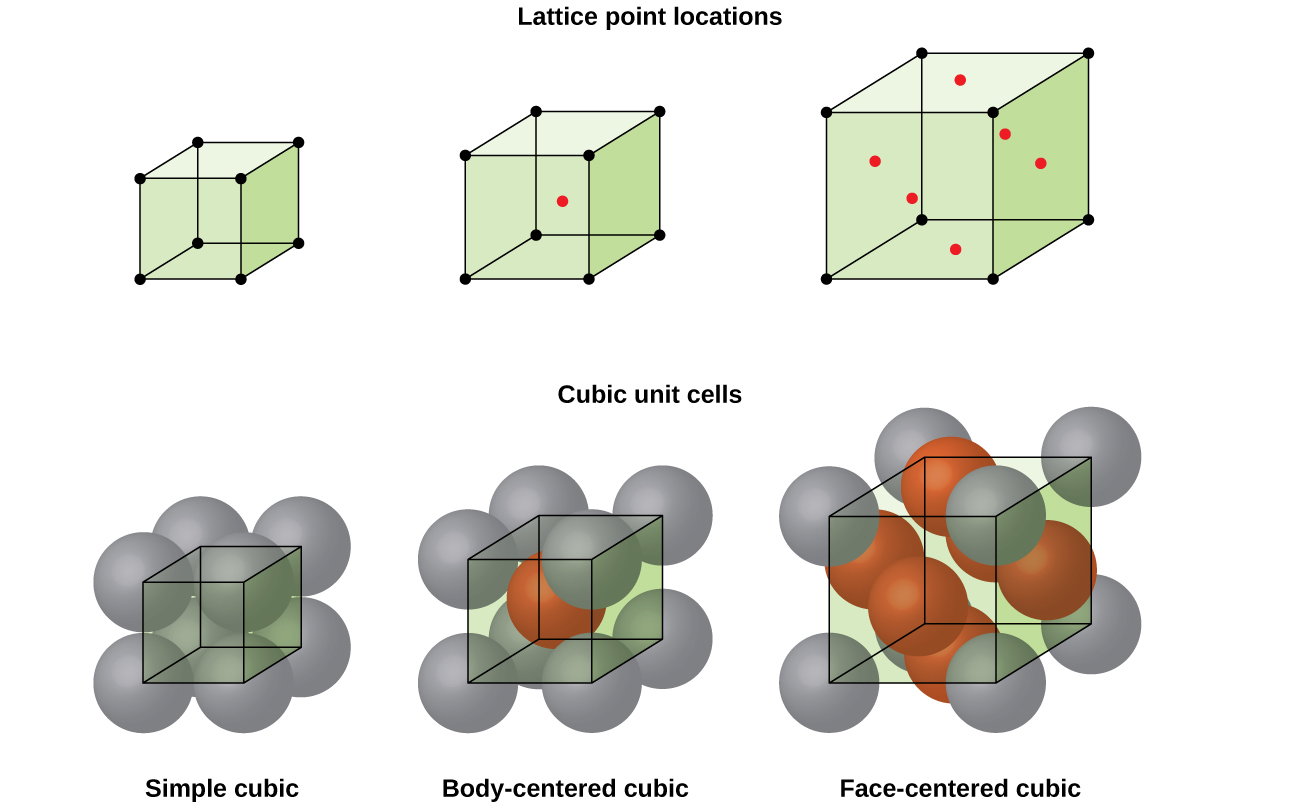
Noen metaller krystallisere i et arrangement som har en kubisk enhet celle med atomer i alle hjørner og et atom i midten, som vist i Figur \(\PageIndex{6}\). Dette kalles en kropp-sentrert kubikkmeter (BCC) fast., Atomer i hjørnene av et BL.KOPI-enhet cellen ikke kontakt med hverandre, men kontakt atom i sentrum. En BLINDKOPI-enhet cellen inneholder to atomer: en åttendedel av et atom i hvert av de åtte hjørnene (\(8×\dfrac{1}{8}=1\) atom fra hjørnene), pluss en atom fra sentrum. Ethvert atom i denne strukturen berører fire atomene i lag over det og fire atomer i laget under. Dermed kan et atom i en BLINDKOPI-strukturen har en koordinering nummer åtte.,
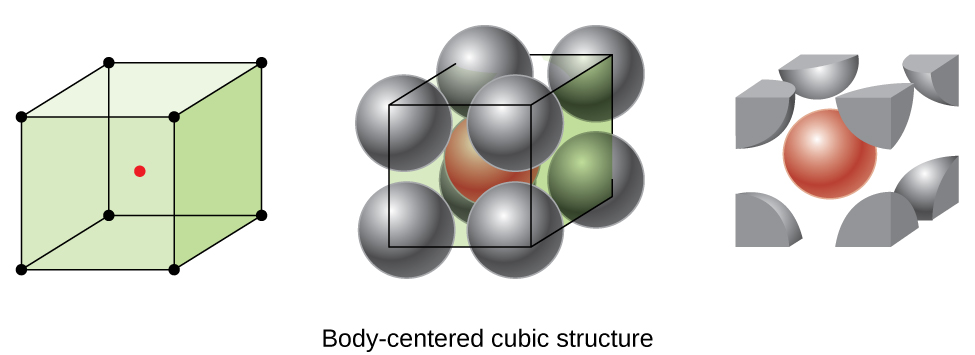
Atomer i BLINDKOPI-ordninger er mye mer effektivt pakket enn i en enkel kubisk struktur, som opptar ca 68% av det totale volumet. Isomorphous metaller med en BLINDKOPI struktur inkluderer K, Ba, Cr, Mo, W, og Fe i romtemperatur., (Elementer eller forbindelser som utkrystalliserer med samme struktur er sagt å være isomorphous.)
Mange andre metaller, som aluminium, kobber og bly, krystallisere i et arrangement som har en kubisk enhet celle med atomer i alle hjørner og på midten av hver ansikt, som illustrert i Figur \(\PageIndex{7}\). Denne ordningen kalles et ansikt-sentrert kubikkmeter (FCC) fast., En FCC-enhet cellen inneholder fire atomer: en åttendedel av et atom i hvert av de åtte hjørnene (\(8×\dfrac{1}{8}=1\) atom fra hjørnene) og en halv av et atom på hver av de seks ansikter (\(6×\dfrac{1}{2}=3\) atomer fra ansiktene). Atomene i hjørnene touch atomene i sentrene i de tilstøtende overflater langs ansiktet diagonaler av kuben. Fordi atomene er identiske gitter poeng, de har identiske miljøer.
Atomer i en FCC-ordningen er pakket så tett sammen som mulig, med atomer som opptar 74% av volumet., Denne strukturen er også kalt kubikk nærmeste pakking (CCP). I CCP, det er tre gjenta lag av hexagonally arrangert atomer. Hvert atom kontakter seks atomer i egne lag, tre i lag over, og tre i laget under. I denne ordningen, hvert atom berører 12 nærheten naboer, og har derfor en samordning antall 12. Det faktum at FCC-og CCP ordninger er tilsvarende kan ikke umiddelbart opplagt, men hvorfor de er faktisk den samme strukturen er illustrert i Figur \(\PageIndex{8}\).,
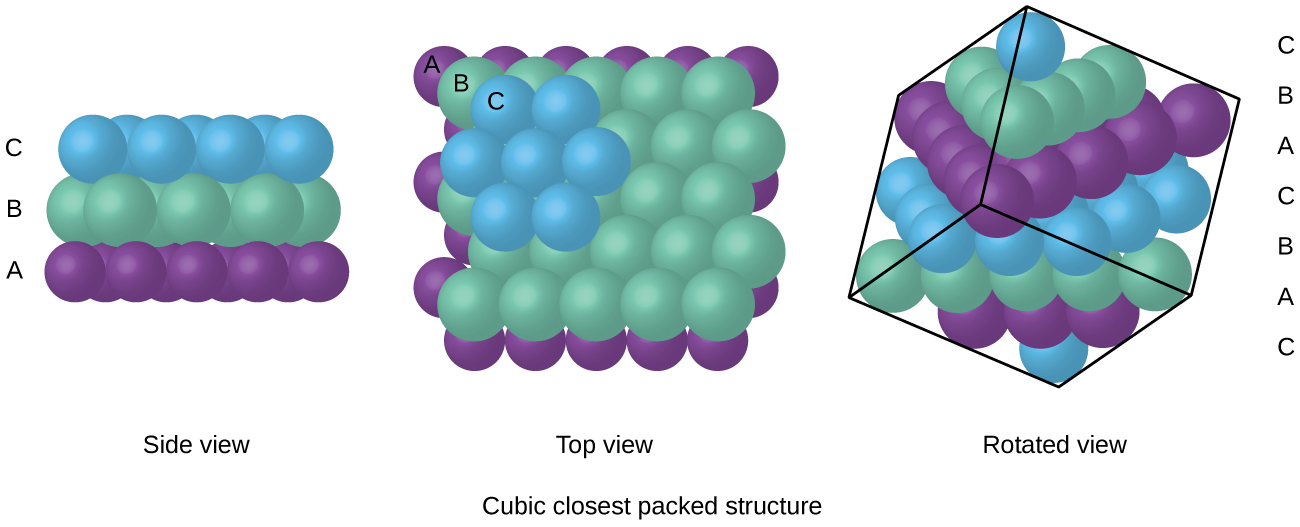
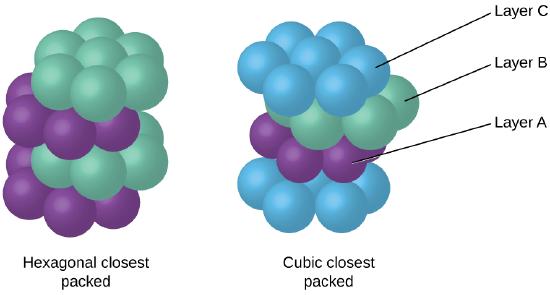
Fordi tettere pakking maksimerer den samlede attraksjoner mellom atomer og reduserer den totale intermolecular energi, atomene i de fleste metaller pack på denne måten., Vi finner to typer nærmeste pakking i enkle metallic krystallinske strukturer: CCP, som vi allerede har møtt, og sekskantet nærmeste pakking (HCP) er vist i Figur \(\PageIndex{9}\). Begge består av gjentatte lag av hexagonally arrangert atomer. I begge typer, en andre lag (B) er plassert på det første laget (A) slik at hvert atom i det andre laget er i kontakt med tre atomer i det første laget. Det tredje laget er plassert i en av to måter. I HCP, atomer i det tredje laget er rett over atomer i den første lag (dvs., det tredje laget er også type A), og legger dem i bunker består av vekslende type A og type B tett pakket lag (dvs., ABABAB⋯). I CCP, atomer i det tredje laget er ikke over atomer i en av de to første lagene (dvs., det tredje laget er type C), og legger dem i bunker består av vekslende type A, type B og type C lukk-pakket lag (dvs., ABCABCABC⋯). Om lag to tredeler av alle metaller krystallisere i nærmeste pakket matriser med koordinering antall 12., Metaller som utkrystalliserer i en HCP struktur inkluderer Cd, Co, Li, Mg, Na, og Zn, og metaller som utkrystalliserer i en CCP struktur inkluderer Ag, Al, Ca, Cu, Ni, Pb, og Pt.
Trening \(\PageIndex{2}\)
Sølv crystallizes i en FCC-struktur. Kanten lengde enhet sin celle er 409 pm.
- Hva er atomic radius av Ag i denne strukturen?
- Beregne tettheten av Ag.
Svar på en
144 pm
Svar b
10.5 g/cm3
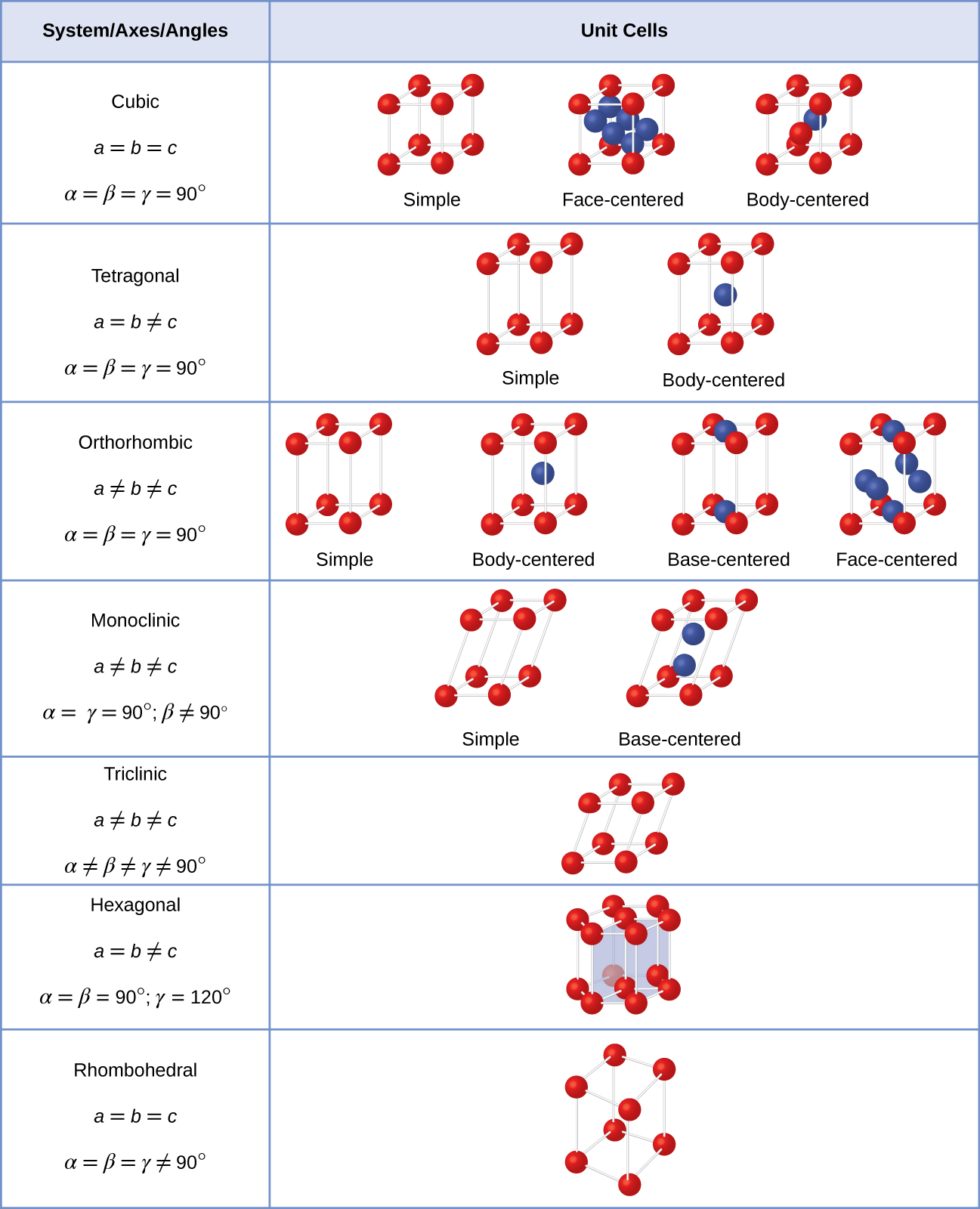
generelt, en enhet, cellen er definert av lengder på tre akser (a, b, og c) og vinkler (α, β og γ) mellom dem, som illustrert i Figur \(\PageIndex{10}\)., Aksene er definert som det lengder mellom punkter i rommet gitter. Følgelig, enhet celle akser bli poeng med identiske miljøer.
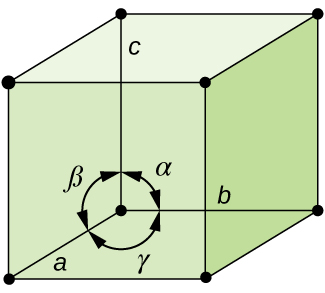
Det er syv forskjellige gitter systemene, og noen av dem har mer enn én type gitter, for en sum av fjorten forskjellige enhet celler, som har figurene vist i Figur \(\PageIndex{11}\).