Kombinert terapi i neonatal hypoksisk-ischaemic encefalopati | Anales de Pediatría (engelsk Utgave)
Innledning
Med en fordeling av 1-3 tilfeller per 1000 full-fullbårne barn,1 hypoksisk-ischaemic encefalopati (HIE) er en av de hyppigste årsakene til hjerneskade hos nyfødte. Tatt i betraktning den økende antall av høy-risiko fødsler på grunn av den økende trender i mors alder og i frekvensen av flere svangerskap, blant andre faktorer, HIE fortsetter å være et relevant problem i sykehus for der er ennå ingen endelig løsning.,
Forskning på pathophysiology of perinatal kvelning har tillatt oss å forstå den komplekse prosessen som finner sted på mobil og vev nivåer som hjerne skader utvikler seg på grunn av mangel på oksygen. Mange av de involverte mekanismer for skader er gruppert basert på timing medgått til utviklingen deres, og 4 hovedfaser har blitt beskrevet (Fig. 1): primær fase, eller akutt episode av hypoksisk ischaemia (HI), latent fase, sekundær fase og høyere fase., I primær fase, skade stammer fra en reduksjon i tilførselen av oksygen til cellene og vevet, noe som resulterer i primær energi svikt. Dette er etterfulgt av en tydelig bedring i nivåene av høy-energi phosphorylated forbindelser, kjent som den latente fasen., Imidlertid, denne forbedringen er bare midlertidig, og gir vei til den sekundære fasen, når mange av pathophysiological mekanismene som er involvert i utviklingen av hjerneskade hos nyfødte komme inn i lek, sjefen over det som er excitotoxicity, en massiv tilstrømning av kalsium ioner inn i cellene, oksidativt stress, betennelser og, i de fleste tilfeller, celle død på grunn av nekrose eller apoptosis. Sist av alle, den tredje fasen er preget av utholdenhet til hjerneskade uker, måneder eller selv år etter den første hypoksisk-ischaemic fornærmelse.,
Den forståelse av den underliggende pathophysiology av HIE har tillatt identifisering av potensielle terapeutiske mål som kan bidra til å redusere hjerneskade forårsaket av kvelning og utvikling av mange behandlingsstrategier. Noen av disse behandlinger, for tiden i forsøk, er ment å fungere sammen med terapeutisk hypotermi, den eneste behandlingen mot HIE som har vært generelt adoptert i neonatal intensive care innstilling.,
Hypotermi
Hypotermi begynte å bli brukt som en neuroprotective strategi hos spedbarn etter oppdagelsen av en endogen kjøling mekanisme som manifestert i spedbarn som hadde lidd noen form for skade under fødselen.2 Sin neuroprotective effekter er i hovedsak knyttet til reduksjon i den metabolske aktiviteten i hjernen, 5% med hver 1°C reduksjon i temperatur,3 som modulerer noen av de skadelige metabolske veier utløst av kvelning, som er oppsummert i Fig. 2.
– >
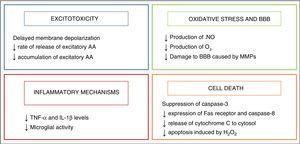
Effekten av nedkjøling på hjerneskade mekanismer.
kombinasjonsbehandling
Siden det tyder på at dagens hypotermi protokoller er optimal4 ennå er av begrenset effektivitet i klinisk praksis,5 vi trenger å utvide er terapeutisk armamentarium for behandling av HIE.,6 Nyere forskning har fokusert på utvikling og implementering av behandlinger som kan brukes i kombinasjon med hypotermi, utformet for å fungere på ulike nivåer av pathophysiologic kaskade, og for å fremme synergi av både terapi (Fig. 3).
– >

det er Mulig terapeutisk siktemål og viktigste neuroprotective strategier for tiden gjenstand for studier for behandling av neonatal HIE.
Melatonin
Melatonin (N-acetyl-5-metoxitriptamina) er en neurohormone syntetisert av pinealkjertelen som sekresjon følger en natt/dag-syklus, og hvis viktigste rolle er å regulere døgnrytmen. De viktige aspekter som tillater slik bruk i forvaltningen av HIE er en kraftig antioksidant og anti-inflammatoriske activity7 og dens evne til å krysse blod–hjerne-barrieren, og nå det sentrale nervesystemet.,8
Før du blir prøvd i nyfødte, melatonin har vist seg å øke nivå av vern av hypotermi gjennom optimalisering av hjernen energiomsetningen i en nasse nøff modell av kvelning.9 I klinisk setting, en studie publisert av Aly et al.10 tildelt halvparten av kvalt nyfødte til nedkjøling og 5 doser på 10 mg/kg/dag av melatonin levert av oral rute., Forfatterne fant en reduksjon i serum nivåer av superoxide dismutase og nitrogenoksid i pasienter behandlet med kombinasjonsbehandling i forhold til de som er behandlet med kjøling alene, og dermed demonstrerer de gunstige effektene av en kombinasjon av begge strategier mot oksidativt stress.
En fersk undersøkelse utført av Balduini et al., for å evaluere sikkerheten, farmakokinetikk, dosering og effekt av melatonin brukes i kombinasjon med hypotermi fant at kjøling ikke påvirker farmakokinetikk melatonin11 og at det var mulig å få høy serum nivåer av hormonet administrering av doser som var lavere enn de som brukes i eksperimentelle dyremodeller. I dag, MELPRO (NCT03806816) klinisk studie er å rekruttere pasienter, med sikte på en prøve på 100 nyfødte., Dette og andre lignende studier er uunnværlig for den fremtidige utviklingen av fase III kliniske studier og påfølgende bruk av melatonin i daglig klinisk praksis.
Allopurinol
begrunnelsen for bruk av allopurinol i forvaltningen av HIE er sin hemmende effekt på xantin oksidase, et enzym som er involvert i oksidativ stress. I tillegg, dette stoffet fungerer som en gratis-strykejern chelator og sequesters hydroksyl-radikaler.,12,13 En preklinisk studie i rotte unger der dyrene ble tildelt 1 av 5 grupper (kontroll gruppe, HI-gruppe, gruppe behandlet med hypotermi, gruppen behandlet med allopurinol og gruppen behandlet med kombinasjonsbehandling) fant at 72h etter HI fornærmelse, kombinasjon terapi gruppe utstilt laveste infarkt volum.,14
Når det kommer til sin farmakologiske egenskaper, allopurinol kan raskt krysser placenta og oppnå terapeutiske konsentrasjoner i nyfødte, som demonstrert i en studie utført på gravide kvinner som fikk 500mg av allopurinol intravenøst, med bevis for optimale nivåer av allopurinol 5min senere i navlestrengen blodprøver.15 En studie utført av van Bel et al., i 1998 som ble analysert potensialet sitt antioksidant effekt i kvalt nyfødte med alvorlig HIE funnet at intravenøs administrasjon av 40mg/kg av allopurinol oppnådd en reduksjon i dannelse av frie radikaler.13 Men en studie utført senere av Benders et al. i 2006 fant ikke forskjeller mellom gruppen behandlet med allopurinol og kontrollgruppen.16 I konklusjonene, disse forfatterne identifisert ekstreme alvorlighetsgraden av HIE i den nyfødte inkludert i utvalget som en mulig forklaring på mangelen på signifikante forskjeller., De har også hypothesised at perioden medgått til administrasjon av allopurinol (3–4t etter reperfusion) kunne ha blitt for lang til å oppnå gunstige utfall. I forhold til sistnevnte punkt, Gunes et al. administreres i samme dose av allopurinol gitt i 2 tidligere studier, men innen 2 timer fra fødselen av, og fant forbedringer i nevrologiske utfall i behandlingen gruppen.,17 Langs de samme linjene, administrasjon av intravenøs allopurinol til mødre under levering av foetuses med hypoksi eller begynnende hypoxia økt effektiviteten av behandlingen, redusere ledningen blod nivåer av protein S-100β, som er en markør på hjerneskade.18 En klinisk studie under navnet Effekten av Allopurinol for Hypoksisk-iskemisk hjerneskade på Nevrokognitiv Utfallet (NCT03162653) er for tiden i gang med å vurdere den potensielle terapeutiske virkninger av administrasjonen av dette enzym-hemmer i de første minuttene post fødselen.,
Erytropoietin
Erytropoietin (EPO) er et cytokin som måler 30.4 kDa syntetisert av leveren i foetal livet og etter fødselen av nyre og utvikling av hjernen, der den fungerer som en vekstfaktor og neuroprotective agent.19 bruk av både EPO og rekombinant human EPO (rhEPO) i HIE er basert på egen aktivitet, gjennom engasjement av EPO-reseptorer i nervecellene og glia,20 som en potent antiapoptotic agent (stimulerende transkripsjon av antiapoptotic gener BCL-2 og BCL-XL), og som et anti-inflammatorisk og antioksidant.,19,21 I tillegg til sin neuroprotective effekt, EPO kan fremme langsiktig repair prosesser, for eksempel angiogenese, oligodendrogenesis og neurogenesis.22,23
Prekliniske studier som har vurdert synergic effekten av å kombinere administrasjon av EPO eller rhEPO med hypotermi har gitt motstridende resultater. I en lignende rotte modell av hypoksisk-ischaemic skader på hjernen i dag 7 innlegg fødsel, Fang et al. fant ingen signifikante neuroprotective virkninger av sine kombinert bruk.24 Men i en annen studie utført av Fan et al.,,25 forfatterne gjorde observere en mild gunstig effekt på sensorimotor funksjon i rotte unger, selv om denne forskjellen ikke var reflektert i den histologiske trekk av hjernen vevsprøver.
Studier på nyfødte med HIE har vist at bruk av rhEPO er safe i doser på 300–2500IU/kg. Lave doser av rhEPO har blitt funnet effektive hos pasienter med moderat skade, og ser ut til å være assosiert med en redusert risiko for uførhet eller død.26 Høyere doser (opp til 2500IU/kg) kan redusere forekomsten av beslag og nevrologiske abnormiteter på 6 måneder.,27
i Dag, tre fase III kliniske studier er i gang med en planlagt rekruttering av totalt 840 nyfødte som skal vurdere sikkerhet og effekt av høye doser av EPO (1000IU/kg) kombinert med hypotermi (Erytropoietin for Hypoksisk Ischaemic Encefalopati hos Nyfødte, NCT03079167; Høy-dose Erytropoietin for Kvelning og Encefalopati, NCT02811263; Erytropoietin i behandling av Neonatal Hypoksisk Iskemisk Encefalopati, NCT03163589). De viktigste mål de 2 første er å redusere 2-års dødelighet eller uførhet, mens den tredje vil vurdere disse to utfall etter 1 år., Vi venter på resultatene av disse og andre studier for å finne ut om EPO eller noen av dets derivater er effektive og hvordan de bør brukes i klinisk praksis, vurdering av faktorer som laveste effektive dose, bruksmåte, varigheten av behandlingen, etc.
Stamceller
bruk av stamceller for behandling av alle slags sykdommer, inkludert HIE, er et forskningsfelt som fortsetter å vokse., Denne terapeutiske tilnærmingen kan bidra til å reparere og regenerere skadet hjernevev etter hypoksisk-ischaemic fornærmelse gjennom samspillet av stamceller med immunceller i organer fjernt fra hjernen, for eksempel milt, og dermed endre immune/inflammatorisk respons. På samme måte funksjonell bedring oppnås med deres administrasjon kan delvis forklares med et samspill av de transplanterte cellene og hjernevev, med påfølgende produksjon av vekstfaktorer som endelig effekten vil bli reflektert i økt neurogenesis og mobile spredning.,
Selv om vi fortsatt trenger å utdype vår kunnskap for å være i stand til å bruke stamceller som en effektiv terapi, eksperimentelle studier på dyr har vist at ulike typer stamceller er i stand til å overleve i det skadede hjernen, differensiering til nevroner eller glia, integrere inn i målet vev og gunstig endre atferd utfall (anmeldt i Bennet et al.28)., Nyere studier har rapportert at administrasjonen av mesenchymal stem cells kombinert med 24-timers avkjøling i rotte valpene 7 dager etter fødsel oppnådd bedre resultater i forhold til behandling enten i isolasjon,29 og har også funnet at hypotermi utvider den terapeutiske tid-vinduet for administrasjon av mesenchymal stem cells til opp til 2 dager etter hypoksisk-ischaemic event.,30 I tillegg stamceller kan regulere immunforsvaret gjennom sine samhandlinger med effector immunceller ligger i organer fjernt fra hjernen, for eksempel milt, som mobilisering er kjent for å ha potensial til å forverre inflammatorisk respons og ischaemic skade i den umodne hjerne, og dermed styrke deres neuroprotective effekt.,31,32
Stem cell therapy, alene eller i kombinasjon med terapeutisk hypotermi, er et lovende forskningsfelt som krever fortsatt kliniske studier for å avgjøre, blant andre aspekter, den mest effektive typen av stamceller og optimal dosering og varighet av behandlingen for å oppnå best mulig behandling utfall.,28 En av de prosjekter som pågår i rekrutterings-fase (Studiet av hCT-MSC i Nyfødt Spedbarn Med Moderat eller Alvorlig HIE, NCT03635450) vil omfatte 6 spedbarn som er født på en gestational age of 36 eller flere uker med moderat til alvorlig HIE å bli behandlet med hypotermi og 2 intravenøse doser av mesenchymal stromal celler avledet fra navlestrengen vev (hCT-MSC). De viktigste målene for denne fasen jeg prøveversjon er å vurdere sikkerheten av hCT-MSC og analysere overlevelse og nevrologiske utfall i deltakerne på 6 og 16 måneder, henholdsvis., En annen fase i trial (NCT00593242) oppnådd lovende resultater med autologous transplantasjon av navlestrengen blodceller, med 74% av de nyfødte som fikk stamceller overleve med en score på 85 eller høyere i Bayley scales i forhold til 41% av de nyfødte behandlet med kjøling alene.33
N-acetylcysteine
N-acetylcysteine (NAC) er en forløper av cystein som scavenges frie radikaler og er involvert i glutation vedlikehold,34 og dermed regulere oksidativt stress., Bevis fra dyr modeller viste en større reduksjon i cerebral infarkt volum i dyr behandlet med en kombinasjon av NAC og hypotermi forhold til dyr behandlet med bare en av disse intervensjonene. Videre, dyr behandlet med kombinasjonsbehandling viste lignende resultater i reflekser og hvit substans skade på de fant i kontrollgruppen.35 Siden sin administrasjon under svangerskapet ikke har teratogene effekter, og det kan krysse placenta,36 NAC har kommet til å bli betraktet som en av de mest lovende terapeutiske agenter for fremtidig bruk i neonatale intensivavdelinger., Men til vår kjennskap ingen kliniske forsøk har vært designet for å date for å vurdere sin bruk i forvaltningen av HIE, og tilgjengelig dokumentasjon er begrenset til forsøk knyttet til intra-fostervann betennelse, chorioamnionitis eller respiratorisk distress syndrom.
Edle gasser
Edle gasser som xenon og radon har utstilt neuroprotective virkninger i dyreforsøk modeller av neonatal HI. En rekke studier har analysert muligheten for å bruke xenon som en terapeutisk agent (for en gjennomgang av bevisene, se artikkel av Lobo et al.,37) på grunn av sin evne til å redusere excitotoxicity etter en HI fornærmelse gjennom modulering av NMDA glutamat-reseptorer.38,39
– multicenter klinisk studie hele Kroppen hypotermi Xenon plus (TOBY-Xe) brukes xenon gass i kombinasjon med hypotermi i en prøve av 92 spedbarn som er født mellom 36 og 43 uker av svangerskapet., Selv om det ikke fant signifikante forskjeller mellom grupper,40 med sikte på å få mer detaljert informasjon om noen av de variabler som kan ha hatt innvirkning på utfallet av behandlingen med dette edle gass, for eksempel sin dose eller varighet, en fase II kliniske studier pågår nå (CoolXenon3 Studie, NCT02071394).,
På den annen side, det har vært noen kliniske studier av argon til dato, men argon har vist seg å forbedre resultatene av kjøling i form av nivåene av N-acetyl-aspartat/laktat markør, som har vært assosiert med en økning i gjennomsnittlig celledød verdier og utvikling av nevrologiske følgetilstander i berørte nyfødte.41 Disse lovende resultatene, sammen med sin høyere biotilgjengelighet og lavere kostnader i forhold til xenon, gjøre argon et molekyl med et høyt potensial for benk til sengen oversettelse i behandling av HIE.,
Konklusjon
å Oppnå en effektiv behandling for HIE er en av de store utfordringene i moderne medisin. For denne grunn, et betydelig arbeid har vært gjort for mange år for å analysere mekanismer som fører til hjernen celle skade etter perinatal kvelning med sikte på å utvikle effektive behandlinger for å blokkere dem. I dag, barneleger og nevrologer forsøker å utvikle nye forbindelser som kan virke i synergi med hypotermi med sikte på å redusere til et minimum i den nevrologiske følgetilstander av HIE., På den annen side, nyere studier har begynt å inkludere kjønn blant de variabler å ta hensyn til i forvaltningen av HIE, som seksuelt dimorphic forskjellene har blitt funnet både i mekanismer for skader (i eksperimentelle modeller, kvinnelige dyr har vist større minne underskudd, mens mannlige dyr har vist større mottakelighet for oksidativt stress), og i utviklingen av de ulike behandlinger under vurdering., Til tross for den lovende framskritt som er gjort med bruk av melatonin eller stoffer som EPO, prekliniske studier er fortsatt behov for å ytterligere belyse mekanismer av disse molekylene, og kliniske studier med større prøvene er nødvendig for å finne den optimale dosering og ruter for forvaltningen av disse og andre behandlinger.
Midler
studien ble støttet av en tillatelse gitt av den UPV/EHU som en del av forskningsgruppen finansiering program for universitetet (GIU 17/018).
Interessekonflikter
forfatterne har ingen interessekonflikter for å forkynne.