6.3: Konfiguracja absolutna i System (R) I (S)
absolutne konfiguracje formuł perspektywicznych
chemicy potrzebują wygodnego sposobu odróżnienia jednego stereoizomeru od drugiego. System Cahn-Ingold-Prelog jest zbiorem reguł, które pozwalają nam jednoznacznie określić stereochemiczną konfigurację dowolnego stereocentrum, używając oznaczeń ” R „(od łacińskiego rectus, co oznacza praworęczny) lub ” S ” (od łacińskiego sinister, co oznacza leworęczny).,
zasady tego systemu nomenklatury stereochemicznej są z pozoru dość proste.
zasady przypisywania oznaczenia R/S do centrum chiralnego
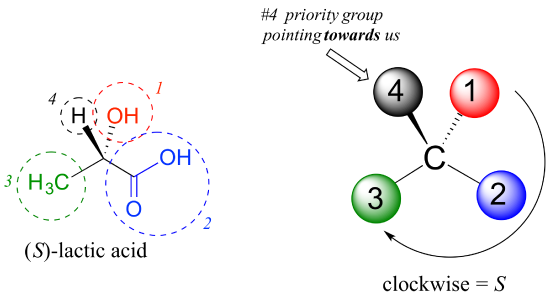
1: Przypisywanie priorytetów do czterech podstawników, przy czym #1 jest najwyższym priorytetem, a #4 NAJNIŻSZYM. Priorytety są oparte na liczbie atomowej.
2: wyznacz krąg od #1 do #2 do # 3.
3: określa orientację grupy priorytetowej #4. Jeśli jest zorientowany na płaszczyznę strony (z dala od Ciebie), przejdź do kroku 4a. jeśli jest zorientowany na płaszczyznę strony (w kierunku Ciebie) przejdź do kroku 4b.,
4a: (Grupa#4 skierowana od Ciebie): okrąg zgodnie z ruchem wskazówek zegara w części 2 odpowiada konfiguracji R, podczas gdy okrąg w kierunku przeciwnym do ruchu wskazówek zegara odpowiada konfiguracji S.
4b: (Grupa # 4 skierowana w Twoją stronę): okrąg w kierunku zgodnym z ruchem wskazówek zegara w części 2 odpowiada konfiguracji S, podczas gdy okrąg w kierunku przeciwnym do ruchu wskazówek zegara odpowiada konfiguracji R.
jako pierwszy przykład użyjemy 3-węglowego glicerolu cukrowego. Pierwszą rzeczą, którą musimy zrobić, jest przypisanie priorytetu każdemu z czterech podstawników związanych z chiralnym centrum., Najpierw przyjrzymy się atomom, które są bezpośrednio związane z centrum chiralnym: są to H, O( W hydroksylu), C (w aldehydach) i C (w grupie CH2OH).
przypisanie konfiguracji R/S do aldehydu glicerolowego:

dwa priorytety są łatwe: Wodór, o liczbie atomowej 1, jest najniższym (#4) priorytetem, a tlen hydroksylowy, o liczbie atomowej 8, jest priorytetem #1. Węgiel ma liczbę atomową 6. Która z dwóch grup ” C ” ma priorytet # 2, aldehyd czy CH2OH?, Aby to określić, oddalamy o jedno wiązanie od centrum chiralnego: dla aldehydu mamy wiązanie podwójne do tlenu, podczas gdy w grupie CH2OH mamy Wiązanie pojedyncze do tlenu. Jeśli atom jest taki sam, wiązania podwójne mają wyższy priorytet niż wiązania pojedyncze. Dlatego grupie aldehydowej przypisany jest Priorytet #2, a grupie CH2OH Priorytet #3.
z przypisanymi priorytetami patrzymy dalej na Grupę priorytetową #4 (wodór) i widzimy, że jest ona skierowana z powrotem od nas, w płaszczyznę strony – tak więc stosuje się krok 4a z powyższej procedury., Następnie śledzimy okrąg zdefiniowany przez grupy priorytetowe #1, #2 i #3, w kolejności rosnącej. Okrąg jest zgodny z ruchem wskazówek zegara, co w kroku 4a mówi nam, że ten węgiel ma konfigurację „R”, a cząsteczka ta to (r)-aldehyd glicerolowy. Jego enancjomerem z definicji musi być (S)-aldehyd glicerolowy.
następnie przyjrzyjmy się jednemu z enancjomerów kwasu mlekowego i określmy konfigurację centrum chiralnego. Oczywiście, H jest podstawnikiem #4, A OH jest #1. Ze względu na swoje trzy wiązania z tlenem, węgiel w grupie kwasowej ma priorytet #2, a grupa metylowa ma # 3., Grupa # 4, wodór, jest narysowana w naszym kierunku (poza płaszczyzną strony) na tym rysunku, więc używamy kroku 4b: okrąg śledzony od #1 do #2 do #3 jest zgodnie z ruchem wskazówek zegara, co oznacza, że chiral centrum ma konfigurację s.
lek talidomid jest interesującym – ale tragicznym – studium przypadku w znaczeniu stereochemii w projektowaniu leków., Po raz pierwszy produkowany przez niemiecką firmę farmaceutyczną i przepisywany szeroko w Europie i Australii pod koniec 1950 roku jako środek uspokajający i środek na poranne mdłości u kobiet w ciąży, talidomid został wkrótce uznany za przyczynę niszczycielskich wad wrodzonych u dzieci urodzonych przez kobiety, które go zażyły. Talidomid zawiera centrum chiralne, a zatem występuje w dwóch formach enancjomerycznych. Był sprzedawany jako mieszanina racemiczna: innymi słowy, mieszanina 50: 50 obu enancjomerów.
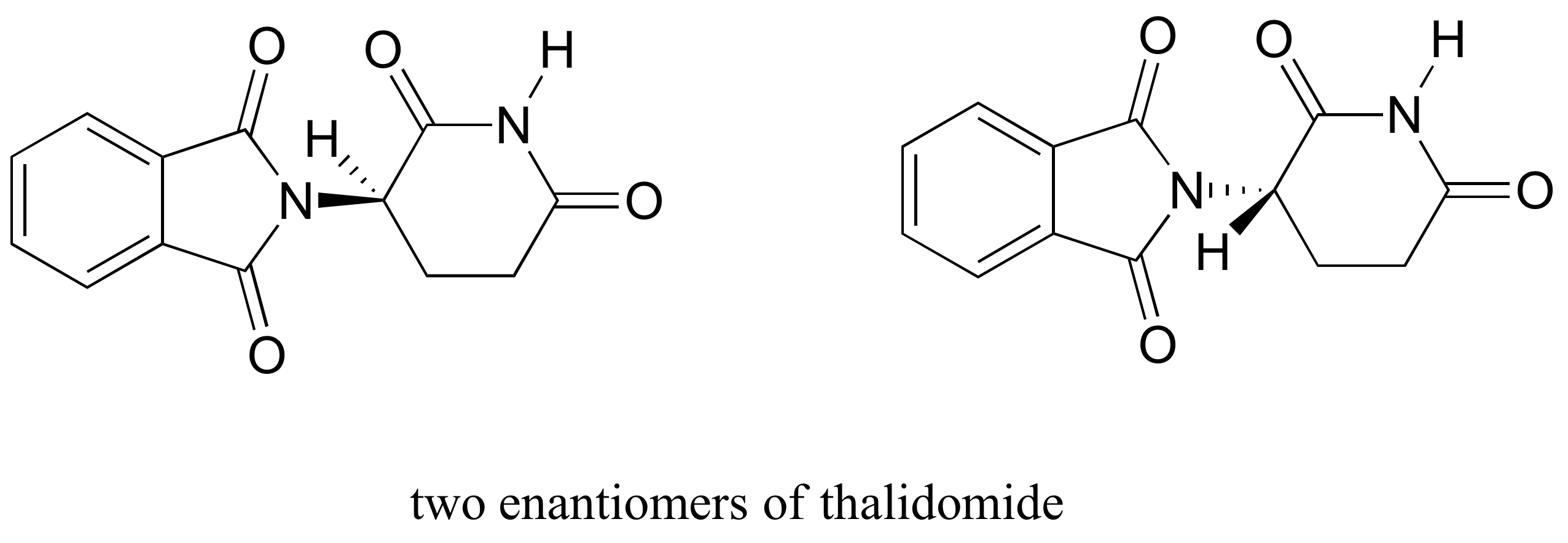
spróbujmy określić stereochemiczną konfigurację enancjomeru po lewej stronie., Z czterech wiązań do chiralnego centrum, priorytetem nr 4 jest wodór. Grupa azotowa to #1, strona karbonylowa pierścienia to #2, a strona-CH2 pierścienia to #3.
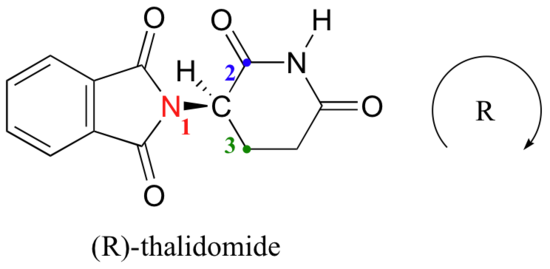
wodór jest wskazywany od nas, a priorytetowe podstawniki wyznaczają okrąg zgodnie z ruchem wskazówek zegara: jest to enancjomer R talidomidu. Drugi enancjomer, oczywiście, musi mieć konfigurację S.,
chociaż naukowcy nadal nie są pewni, jak działa talidomid, eksperymentalne dowody sugerują, że to enancjomer R miał pożądane efekty medyczne, podczas gdy enancjomer S powodował wady wrodzone. Nawet z tą wiedzą, jednak czysty (R)-talidomid nie jest bezpieczny, ponieważ enzymy w organizmie szybko konwertują między dwoma enancjomerami – zobaczymy, jak to się dzieje w rozdziale 12.
talidomid nigdy nie został dopuszczony do stosowania w Stanach Zjednoczonych. Było to w dużej mierze dzięki staraniom Dr., Frances Kelsey, oficer żywnościowy i narkotykowy, który w niebezpieczeństwie dla jej kariery, zablokował jego zatwierdzenie ze względu na jej obawy o brak odpowiednich badań bezpieczeństwa, szczególnie w odniesieniu do leku ” s zdolność do przedostania się do krwiobiegu rozwijającego się płodu. Niestety, jednak w tym czasie badania kliniczne nowych leków wiązały się z powszechną i nieuregulowaną dystrybucją do lekarzy i ich pacjentów w całym kraju, więc rodziny w USA nie zostały oszczędzone od wyrządzonych szkód.,
bardzo niedawno w Stanach Zjednoczonych legalnie zaczęto przepisywać bliską pochodną talidomidu, wprowadzając rygorystyczne środki bezpieczeństwa w leczeniu postaci raka krwi zwanego szpiczakiem mnogim. W Brazylii talidomid jest stosowany w leczeniu trądu – jednak pomimo środków bezpieczeństwa dzieci wciąż rodzą się z wadami związanymi z talidomidem.
Ćwiczenie 1.: Określić stereochemiczne konfiguracje chiralnych ośrodków w biomolekułach pokazanych poniżej.
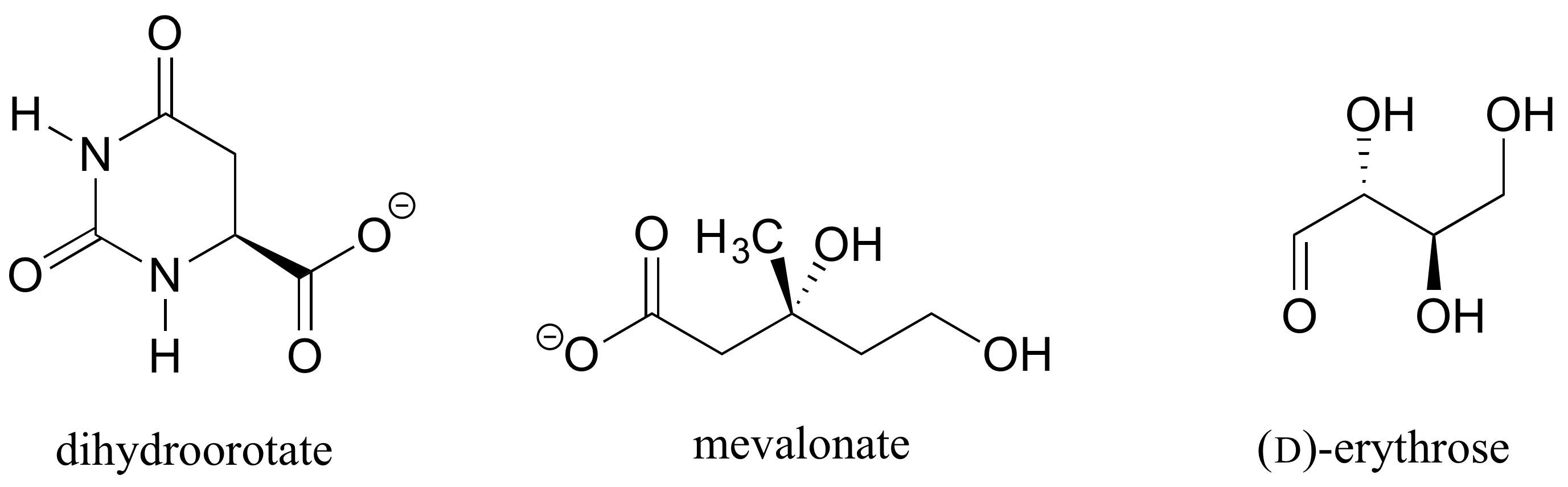
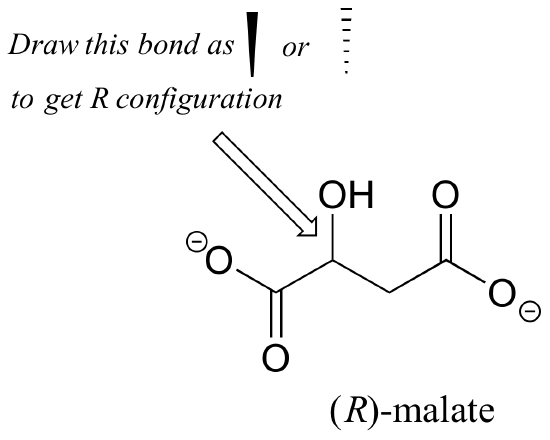
Ćwiczenie 2.,: Czy enancjomer (R) jabłczanu powinien mieć klin stały lub przerywany dla wiązania C-O na rysunku poniżej?
ćwiczenie 3.: Używając klinów stałych lub przerywanych do pokazania stereochemii, narysuj (r) enancjomer ibuprofenu i (S) enancjomer 2-metyloerytrytol-4-fosforanu (struktury pokazano wcześniej w tym rozdziale bez stereochemii).
rozwiązania do ćwiczeń
absolutne konfiguracje projekcji Fischera
aby określić absolutną konfigurację ośrodka chiralnego w projekcji Fishera, należy zastosować następującą procedurę dwuetapową.,
Krok 1
Przypisz numery priorytetów do czterech ligandów (grup) połączonych z centrum chiralnym za pomocą systemu priorytetów CIP.
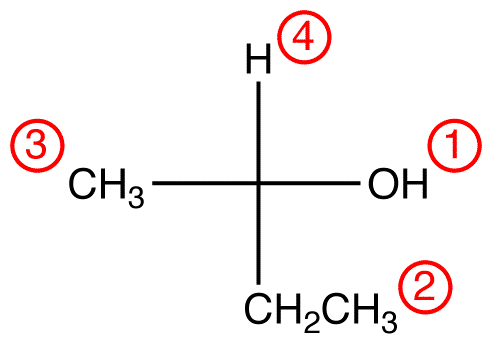
Krok 2 – opcja pionowa
Jeśli najniższy ligand priorytetu znajduje się na wiązaniu pionowym, to jest skierowany od przeglądarki.
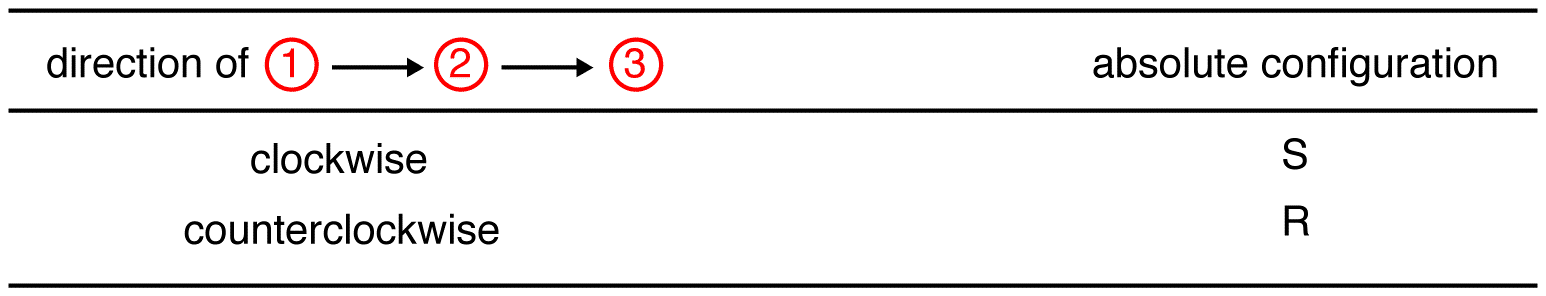
śledź trzy ligandy o najwyższym priorytecie, zaczynając od liganda o najwyższym priorytecie ( ① → → → ③ ) w kierunku, który da bardzo poprawną odpowiedź.

w poniższym związku ruch jest zgodny z ruchem wskazówek zegara, wskazując konfigurację R., Pełna nazwa IUPAC dla tego związku to (r) – butan-2-ol.

Krok 2 – opcja pozioma
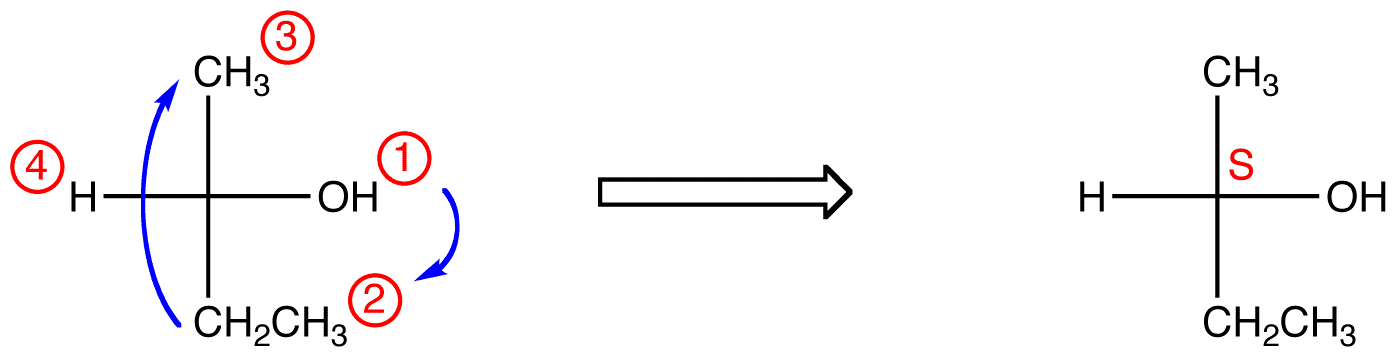
Jeśli ligand o najniższym priorytecie znajduje się na wiązaniu poziomym, to jest skierowany w stronę przeglądarki.
śledź trzy ligandy o najwyższym priorytecie, zaczynając od liganda o najwyższym priorytecie ( ① → → → ③ ) w kierunku, który da strasznie złą odpowiedź. Zauważ w poniższej tabeli, że konfiguracje są odwrócone od pierwszego przykładu.,
w poniższym związku ruch jest zgodny z ruchem wskazówek zegara (R), co jest strasznie błędne, więc rzeczywista konfiguracja to S. pełna nazwa IUPAC dla tego związku to (s)-butan-2-ol.
manipulowanie projekcjami Fischera bez zmiany konfiguracji
projekcja Fischera ogranicza trójwymiarową cząsteczkę do dwóch wymiarów. W związku z tym istnieją ograniczenia co do operacji, które mogą być wykonywane na projekcji Fischera bez zmiany konfiguracji absolutnej w centrach chiralnych., Operacje, które nie zmieniają konfiguracji absolutnej w ośrodku chiralnym w rzutach Fischera można podsumować jako dwie zasady.
Zasada 1: obrót rzutu Fischera o 180º w dowolnym kierunku bez podnoszenia go z płaszczyzny papieru nie zmienia konfiguracji absolutnej w chiralnym centrum.
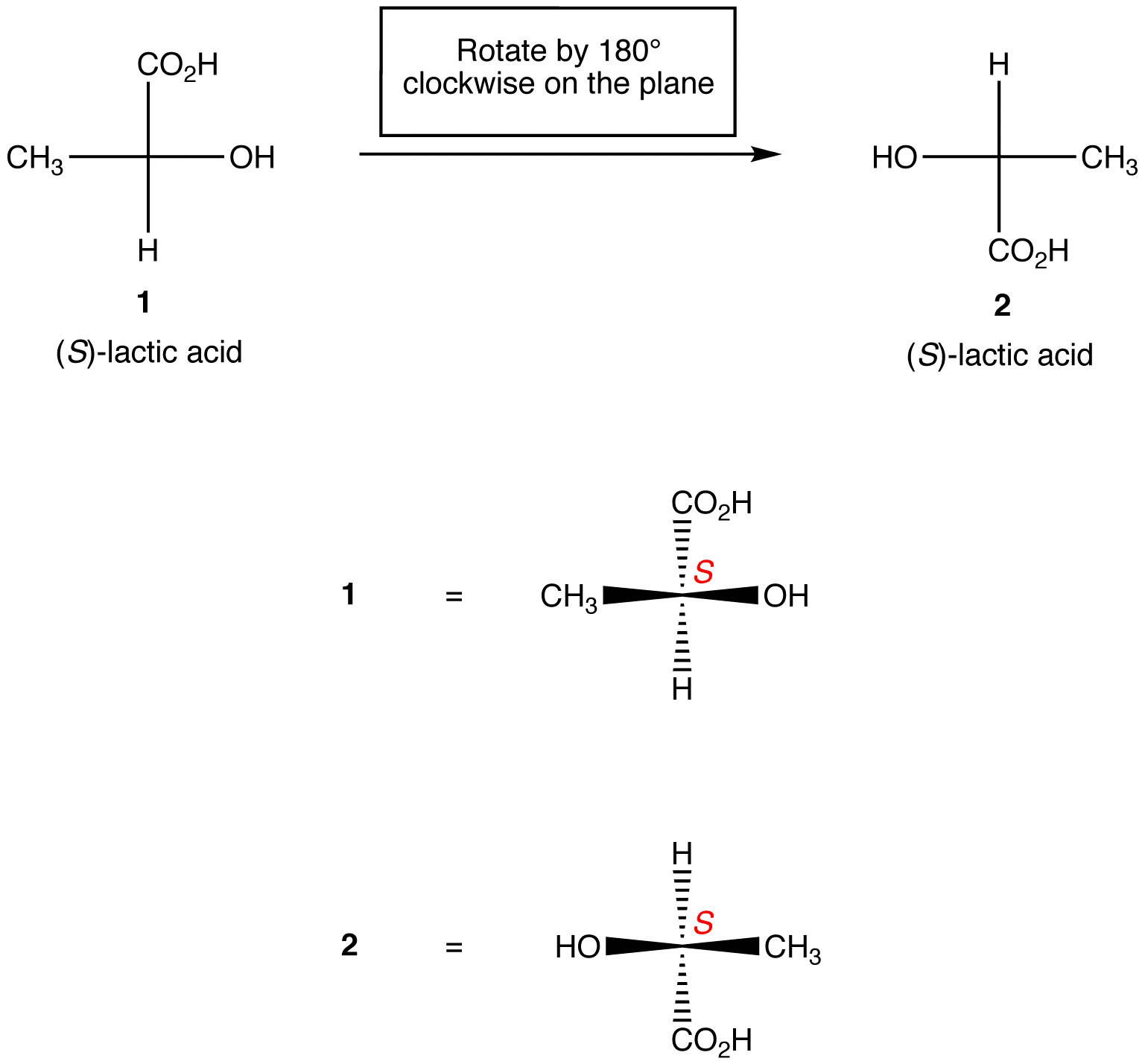
Zasada 2: obrót trzech ligandów w centrum chiralnym w obu kierunkach, utrzymując pozostały ligand w miejscu, nie zmienia konfiguracji absolutnej w centrum chiralnym.,
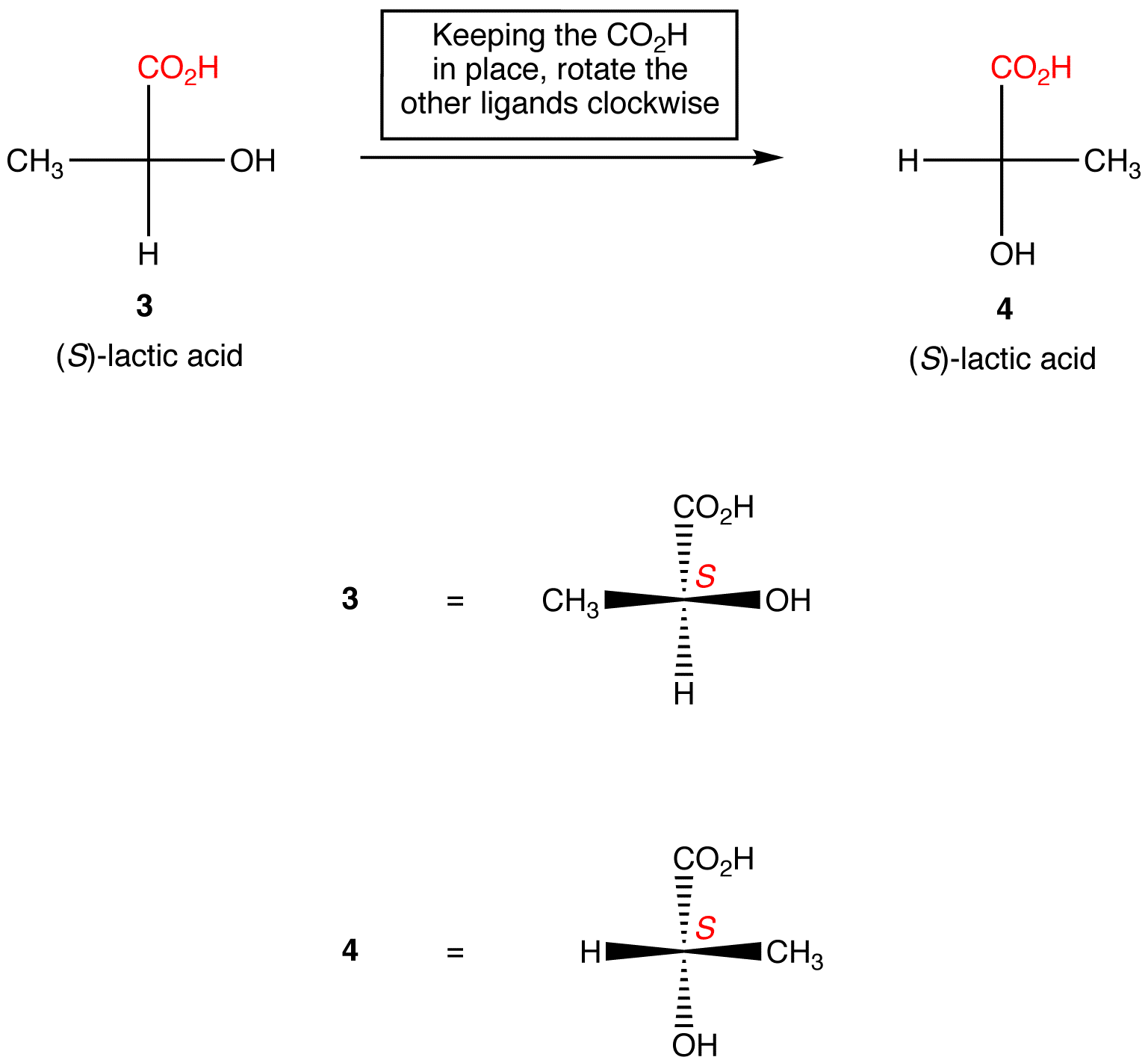
manipulowanie rzutami Fischera ze zmianą konfiguracji
operacje, które zmieniają konfigurację bezwzględną w centrum chiralnym w rzutach Fischera można podsumować jako dwie zasady.
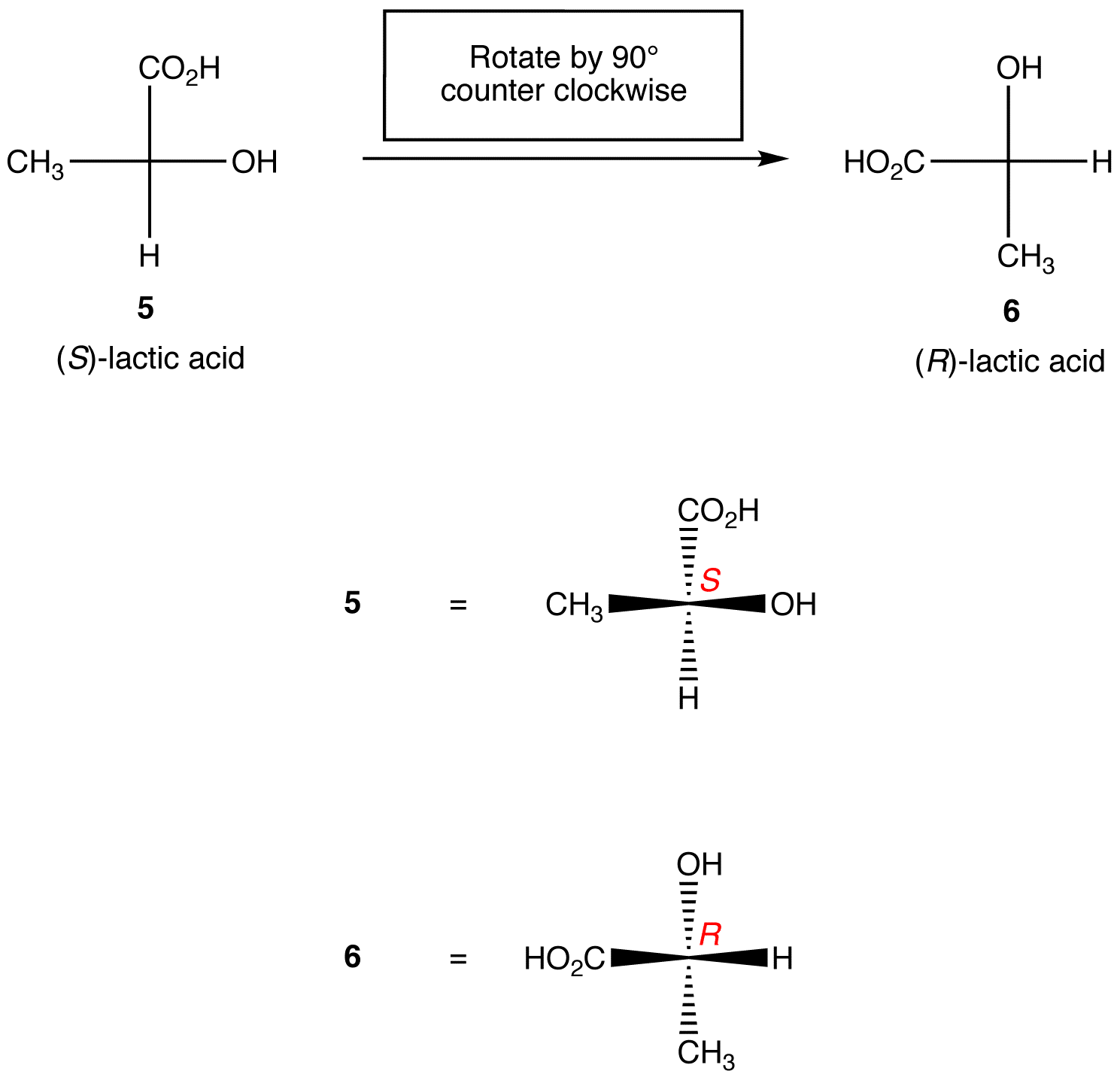
Zasada 1: obrót rzutu Fischera o 90º w dowolnym kierunku zmienia konfigurację absolutną w centrum chiralnym.
reguła 2: Zamiana dowolnych dwóch ligandów na centrum chiralnym zmienia konfigurację absolutną w centrum chiralnym.,
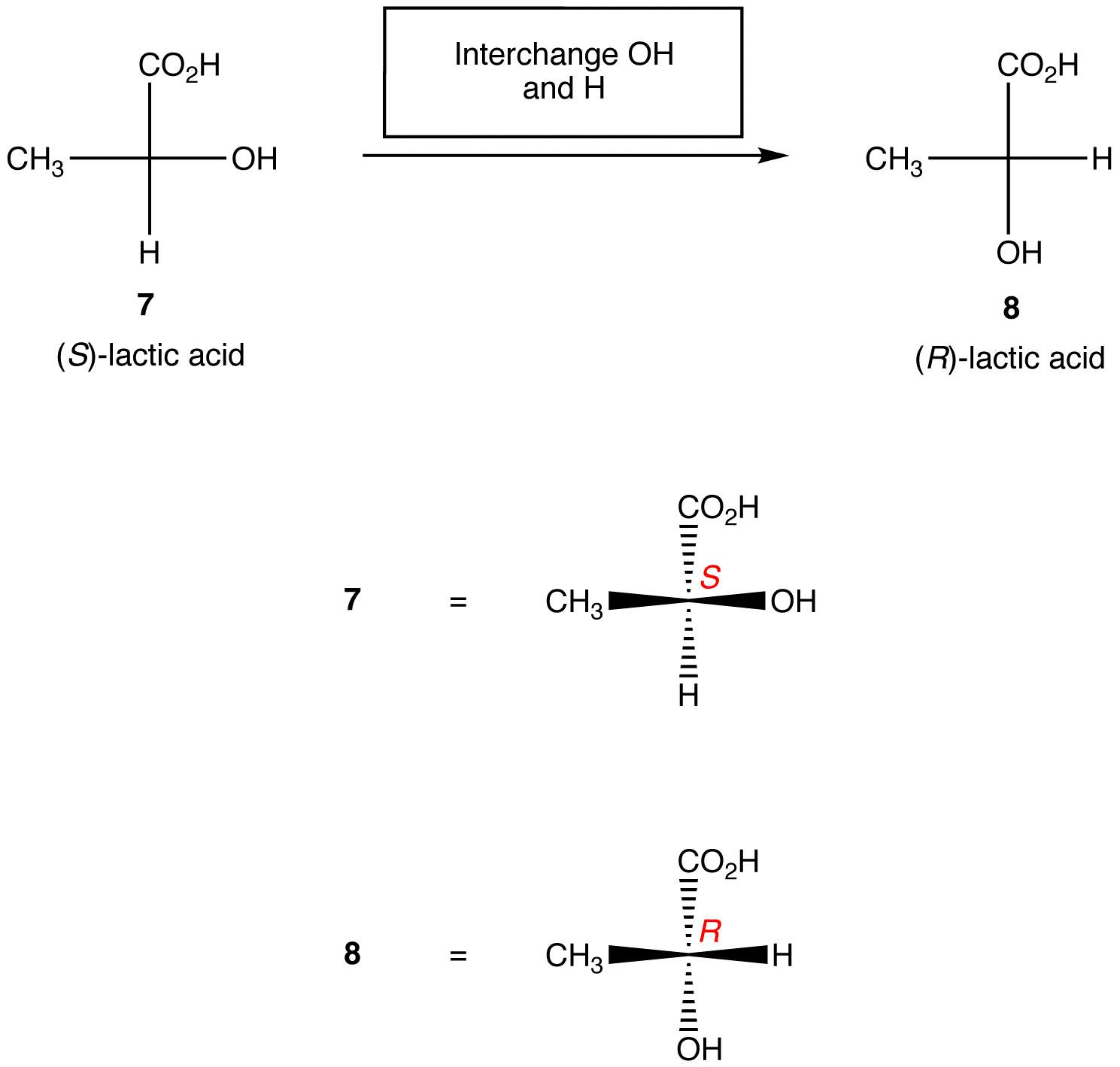
powyższe zasady zakładają, że rozważana projekcja Fischera zawiera tylko jedno centrum chiralne. Jednak z ostrożnością można je zastosować do projekcji Fischera zawierających dowolną liczbę ośrodków chiralnych.
Ćwiczenie 1
rozwiązanie
- S: I > Br > F > H. podstawnik najniższego priorytetu, h, idzie już w kierunku tyłu., Skręca w lewo przechodząc od I do Br do F, więc jest to S.
- R: Br > Cl > CH3 > H. musisz przełączyć H I Br, aby umieścić H, najniższy priorytet, z tyłu. Następnie, przechodząc od Br do Cl, CH3 skręca w prawo, dając R.
- ani r ani S: ta cząsteczka jest achiralna. Tylko cząsteczki chiralne mogą być nazwane R lub S.
- R: OH > CN > CH2NH2 > H. H, najniższy priorytet, musi być przełączony z powrotem., Następnie, przechodząc od OH do CN do CH2NH2, skręcasz w prawo, dając R.
- (5) s: \(\ce{-COOH}\) > \(\ce {C#CH}\) > \(\CE{H}\). Następnie, przechodząc od \(\ce {- COOH}\) do \(\ce {- CH_2OH}\) do \(\ce{-C#CH}\) skręcasz w lewo, dając Ci konfigurację S.
ćwiczenia
6. Orientować następujące tak, aby atom o najmniejszym priorytecie (4) był przesunięty w tył, a następnie przypisać stereochemię (R lub S).

7. Draw (R) – 2-bromobutan-2-ol.
8., Przypisz R / S następującej cząsteczce.
.png?revision=1)
rozwiązania

A = S; B = R
8. Centrum stereo to R.
inne zasoby
samouczek wideo Akademii Kahna na temat systemu nazewnictwa R-S
- Schore i Vollhardt. Chemia organiczna struktura i funkcja. W. H. Freeman and Company, 2007.
- Podstawy Chemii Organicznej. 6. Ed. Brooks Cole, 2006.,
autorzy i atrybuty
- Ekta Patel (UCD), Ifemayowa Aworanti (University of Maryland Baltimore County)
- Chemia organiczna z biologicznym naciskiem Tima Soderberga (University of Minnesota, Morris)