chmury elektronów dla dzieci

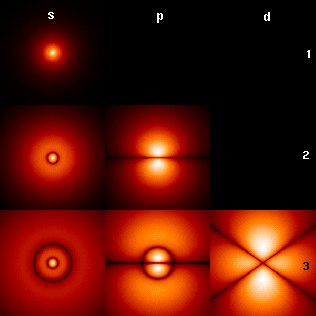
kształty pierwszych pięciu orbitali atomowych to: 1s, 2s, 2px, 2py i 2PZ. Dwa kolory pokazują fazę lub znak funkcji falowej w każdym regionie. Są to Wykresy funkcji ψ (x, y, z), które zależą od współrzędnych jednego elektronu. Aby zobaczyć wydłużony kształt ψ (x, y, z)2 funkcji, które pokazują gęstość prawdopodobieństwa bardziej bezpośrednio, Zobacz wykresy orbitali d poniżej.
Chmura elektronów jest nieformalnym terminem w fizyce., Jest on używany do opisania, gdzie elektrony są, gdy go wokół jądra atomu.
model chmury elektronowej różni się od starszego modelu atomowego Bohra autorstwa Nielsa Bohra. Bohr mówił o elektronach orbitujących wokół jądra. Wyjaśnienie zachowania tych elektronowych „Orbit” było kluczową kwestią w rozwoju mechaniki kwantowej.
model chmury elektronowej mówi, że nie możemy dokładnie wiedzieć, gdzie znajduje się elektron w danym momencie, ale elektrony są bardziej prawdopodobne, aby być w określonych obszarach., Teoretycznie jest możliwe, aby elektron znajdował się w niemal nieskończonej odległości od jądra atomowego, na którym krąży, chociaż prawdopodobieństwo elektronu zmniejsza się dramatycznie w miarę oddalania się od poszukiwanego jądra. Jest to najbardziej nowoczesny i akceptowany sposób na opisanie sytuacji.
w modelu Bohra elektrony zostały przypisane do różnych powłok. Powłoki te wyjaśniały powtarzające się wzorce właściwości chemicznych w układzie okresowym. Korzystając z mechaniki kwantowej, chemicy mogą wykorzystać model chmury elektronowej do przypisania elektronów różnym orbitalom atomowym., Te orbitale atomowe to nie wszystkie sfery. Orbitale atomowe wyjaśniają również wzory w układzie okresowym.
model chmury elektronowej został opracowany w 1925 roku przez Erwina Schrödingera i Wernera Heisenberga. Model jest sposobem na wizualizację najbardziej prawdopodobnego położenia elektronów w atomie. Model chmury elektronowej jest obecnie akceptowanym modelem atomu.,d=”345ec9c6a1″>