Leczenie skojarzone u noworodków encefalopatia niedotlenczo-niedokrwienna / Anales de Pediatría (wydanie angielskie)
wprowadzenie
z częstością 1-3 przypadków na 1000 pełnych urodzeń,1 encefalopatia niedotlenczo-niedokrwienna (Hie) jest jedną z najczęstszych przyczyn uszkodzenia mózgu u noworodków. Biorąc pod uwagę rosnącą liczbę porodów wysokiego ryzyka, wynikającą między innymi z rosnących tendencji w wieku matek i częstotliwości ciąż mnogich, HIE nadal stanowi istotny problem w warunkach szpitalnych, dla którego nie ma jeszcze ostatecznego rozwiązania.,
badania nad patofizjologią asfiksji okołoporodowej pozwoliły nam zrozumieć złożony proces, który odbywa się na poziomie komórkowym i tkankowym, ponieważ uszkodzenie mózgu rozwija się z powodu braku tlenu. Wiele zaangażowanych mechanizmów urazu są zgrupowane w oparciu o czas, jaki upłynął do ich rozwoju, i 4 główne fazy zostały opisane (rys. 1): faza podstawowa lub ostry Epizod niedokrwienia niedotlenienia( HI), Faza utajona, Faza wtórna i faza trzeciorzędowa., W fazie pierwotnej uszkodzenia wynikają ze zmniejszenia dostarczania tlenu do komórek i tkanek, co powoduje awarię energii pierwotnej. Po tym następuje pozorna regeneracja w poziomach wysokoenergetycznych związków fosforylowanych, znanych jako faza utajona., Jednak poprawa ta jest tylko tymczasowa i ustępuje fazie wtórnej, kiedy wchodzi w grę wiele mechanizmów patofizjologicznych zaangażowanych w rozwój uszkodzenia mózgu u noworodków, z których główne to ekscytotoksyczność, ogromny napływ jonów wapnia do komórek, stres oksydacyjny, stan zapalny i, w większości przypadków, śmierć komórek z powodu martwicy lub apoptozy. Ostatnią fazą trzeciorzędową jest utrzymywanie się uszkodzenia mózgu tygodnie, miesiące lub nawet lata po początkowym niedotlenieniu-niedokrwieniu.,
zrozumienie podstawowej patofizjologii HIE pozwoliło na identyfikację potencjalnych celów terapeutycznych, które mogłyby pomóc zmniejszyć uszkodzenia mózgu spowodowane uduszeniem i opracowanie licznych strategii leczenia. Niektóre z tych zabiegów, obecnie w badaniach, mają działać synergistycznie z hipotermią terapeutyczną, jedynym leczeniem przeciwko HIE, które zostało ogólnie przyjęte w warunkach intensywnej terapii noworodków.,
hipotermia
hipotermia zaczęła być stosowana jako strategia neuroprotekcyjna u niemowląt po odkryciu endogennego mechanizmu chłodzenia, który objawiał się u niemowląt, które doznały pewnego rodzaju urazu podczas porodu.2 jego działanie neuroprotekcyjne jest związane głównie ze spadkiem aktywności metabolicznej mózgu, o 5% przy każdym spadku temperatury o 1°C, 3, który moduluje niektóre szkodliwe szlaki metaboliczne wywołane przez uduszenie, które podsumowano na ryc. 2.
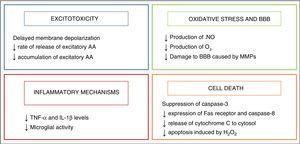
wpływ hipotermii na mechanizmy uszkodzenia mózgu.
terapia skojarzona
ponieważ dowody sugerują,że obecne protokoły hipotermii są optymalne4, ale mają ograniczoną skuteczność w praktyce klinicznej, 5 musimy rozszerzyć są terapeutyczne armamentarium do zarządzania HIE.,6 ostatnie badania koncentrowały się na opracowywaniu i wdrażaniu terapii, które mogą być stosowane w połączeniu z hipotermią, zaprojektowanych do działania na różnych poziomach kaskady patofizjologicznej i promowania synergii obu terapii (rys. 3).

Możliwe cele terapeutyczne i główne strategie neuroprotekcyjne są obecnie przedmiotem badań w zakresie postępowania z HIE noworodków.
Melatonina
Melatonina (N-acetylo-5-metoksytryptamina) jest neurohormonem syntetyzowanym przez szyszynkę, którego wydzielanie następuje w cyklu noc / dzień i którego główna rola polega na regulacji rytmu dobowego. Kluczowymi aspektami, które pozwalają na jego zastosowanie w zarządzaniu HIE, są jego silne działanie przeciwutleniające i przeciwzapalne7 oraz jego zdolność do przekraczania bariery krew-mózg i docierania do ośrodkowego układu nerwowego.,8
przed wypróbowaniem u noworodków udowodniono, że melatonina zwiększa poziom ochrony zapewnianej przez hipotermię poprzez optymalizację metabolizmu energetycznego mózgu w modelu uduszenia prosiąt.9 w warunkach klinicznych, badanie opublikowane przez Aly et al.100 mg/kg mc./dobę melatoniny podawanej drogą doustną., Autorzy stwierdzili zmniejszenie stężenia dysmutazy ponadtlenkowej i tlenku azotu w surowicy u pacjentów leczonych terapią skojarzoną w porównaniu do pacjentów leczonych tylko chłodzeniem, co dowodzi korzystnego wpływu połączenia obu strategii przeciwko stresowi oksydacyjnemu.
ostatnie badanie przeprowadzone przez Balduini et al., w celu oceny bezpieczeństwa stosowania, farmakokinetyki, dawkowania i skuteczności melatoniny stosowanej w skojarzeniu z hipotermią stwierdzono, że chłodzenie nie wpływa na farmakokinetykę melatoniny11 i że możliwe jest uzyskanie wysokich stężeń hormonu w surowicy w dawkach, które były niższe w porównaniu z tymi stosowanymi w modelach doświadczalnych na zwierzętach. Obecnie w badaniu klinicznym MELPRO (NCT03806816) rekrutuje się pacjentów, których celem jest próba 100 noworodków., To i inne podobne badania są niezbędne do przyszłego rozwoju badań klinicznych III fazy i późniejszego stosowania melatoniny w codziennej praktyce klinicznej.
Allopurinol
uzasadnieniem stosowania allopurinolu w leczeniu HIE jest jego hamujący wpływ na oksydazę ksantynową, enzym zaangażowany w stres oksydacyjny. Ponadto lek ten działa jako chelator wolnego żelaza i sekwestry rodników hydroksylowych.,12,13 badanie przedkliniczne na szczurach, w którym zwierzęta przydzielono do 1 z 5 grup (grupa kontrolna, Grupa HI, Grupa leczona hipotermią, Grupa leczona allopurynolem i grupa leczona skojarzonym leczeniem) wykazało, że 72 godziny po leczeniu HI, Grupa leczona skojarzonym leczeniem wykazywała najniższą objętość zawału.,14
jeśli chodzi o właściwości farmakologiczne, allopurynol może szybko przenikać przez łożysko i osiągać stężenia terapeutyczne u noworodków, co wykazano w badaniu przeprowadzonym na kobietach w ciąży, które otrzymały 500 mg allopurynolu dożylnie, z dowodem optymalnego poziomu allopurynolu 5 minut później w próbkach krwi pępowinowej.15 badanie przeprowadzone przez van Bel et al., w 1998 roku, który przeanalizował jego potencjalne działanie przeciwutleniające u uduszonych noworodków z ciężką HIE, stwierdzono, że dożylne podawanie 40 mg/kg allopurynolu spowodowało zmniejszenie tworzenia się wolnych rodników.13 jednak badanie przeprowadzone później przez Benders et al. w 2006 r. nie stwierdzono różnic między grupą leczoną allopurynolem a grupą kontrolną.We wnioskach autorzy Ci zidentyfikowali skrajną ciężkość HIE u noworodków włączonych do próby jako możliwe Wyjaśnienie braku znaczących różnic., Postawiono również hipotezę, że okres do podania allopurynolu (3–4 godziny po reperfuzji) mógł być zbyt długi, aby osiągnąć korzystne wyniki. W odniesieniu do tego ostatniego punktu, Gunes et al. podawano tę samą dawkę allopurynolu podawaną w dwóch poprzednich badaniach, ale w ciągu 2 godzin od urodzenia i stwierdzono poprawę wyników neurorozwojowych w grupie leczonej.,Podobnie, podawanie dożylnego allopurynolu matkom podczas porodu płodów z niedotlenieniem lub niedotlenieniem początkowym zwiększało skuteczność leczenia, zmniejszając stężenie białka S-100β we krwi pępowinowej, które jest markerem uszkodzenia mózgu.Obecnie trwa badanie kliniczne pod nazwą wpływ allopurynolu na niedotlenienie i niedokrwienie mózgu na wynik Neurokognitywny (NCT03162653) w celu oceny potencjalnych efektów terapeutycznych podawania tego inhibitora enzymu w pierwszych minutach po urodzeniu.,Erytropoetyna
Erytropoetyna (EPO) jest cytokiną o masie 30, 4 kDa syntetyzowaną przez wątrobę w życiu płodowym, a po porodzie przez nerki i rozwijający się mózg, gdzie działa jako czynnik wzrostu i czynnik neuroprotekcyjny.Stosowanie zarówno EPO, jak i rekombinowanego ludzkiego EPO (rhEPO) w HIE opiera się na jego aktywności,poprzez zaangażowanie receptorów EPO obecnych w neuronach i glia, 20 jako silnego środka przeciwapoptotycznego (stymulującego transkrypcję antyapoptotycznych genów BCL-2 i BCL-XL) oraz jako przeciwzapalnego i przeciwutleniającego.,Oprócz działania neuroprotekcyjnego EPO może promować długotrwałe procesy naprawcze, takie jak angiogeneza, oligodendrogeneza i neurogeneza.22,23
badania przedkliniczne, w których oceniano synergiczne działanie połączenia podawania EPO lub rhEPO z hipotermią, przyniosły sprzeczne wyniki. W podobnym szczurzym modelu niedotlenczo-niedokrwiennego uszkodzenia mózgu w 7 dniu po urodzeniu, Fang et al. nie stwierdzono znaczących efektów neuroprotekcyjnych ich łącznego stosowania.24 jednak w innym badaniu przeprowadzonym przez Fan et al.,, 25 autorzy zaobserwowali łagodny korzystny wpływ na funkcję sensorimotoryczną u szczeniąt szczura, chociaż różnica ta nie znalazła odzwierciedlenia w cechach histologicznych próbek tkanki mózgowej.
badania u noworodków z HIE wykazały, że stosowanie rhEPO jest bezpieczne w dawkach 300–2500iu/kg. Małe dawki preparatu rhEPO okazały się skuteczne u pacjentów z umiarkowanym uszkodzeniem i wydają się być związane ze zmniejszonym ryzykiem niepełnosprawności lub śmierci.Większe dawki (do 2500 J. M. / kg) mogą zmniejszyć częstość występowania napadów padaczkowych i zaburzeń neurologicznych po 6 miesiącach.,Obecnie trwają trzy badania kliniczne III fazy z planowaną rekrutacją łącznie 840 noworodków w celu oceny bezpieczeństwa i skuteczności wysokich dawek EPO (1000iu/kg) w połączeniu z hipotermią (Erytropoetyna w Niedotleniej encefalopatii niedokrwiennej u noworodków, NCT03079167; Erytropoetyna w wysokiej dawce w przypadku zamartwiania się i encefalopatii, NCT02811263; Erytropoetyna w leczeniu Niedotleniej encefalopatii niedokrwiennej noworodków, Nct03079167) nct03163589). Głównym celem pierwszych 2 jest zmniejszenie 2-letniej śmiertelności lub niepełnosprawności, podczas gdy trzeci oceni te dwa wyniki po 1 roku., Czekamy na wyniki tych i innych badań, aby określić, czy EPO lub którykolwiek z jego pochodnych są skuteczne i jak powinny być stosowane w praktyce klinicznej, oceniając czynniki takie jak minimalna dawka skuteczna, droga podania, czas trwania leczenia itp.
komórki macierzyste
wykorzystanie komórek macierzystych do leczenia wszelkiego rodzaju chorób, w tym HIE, jest dziedziną badań, która wciąż rośnie., Takie podejście terapeutyczne może pomóc w naprawie i regeneracji uszkodzonej tkanki mózgowej po niedotlenieniu i niedokrwieniu poprzez interakcję komórek macierzystych z komórkami odpornościowymi w narządach odległych od mózgu, takich jak śledziona, zmieniając w ten sposób odpowiedź immunologiczną/zapalną. Podobnie odzysk funkcjonalny uzyskany przy ich podawaniu można częściowo wyjaśnić interakcją przeszczepionych komórek i tkanki mózgowej, w wyniku czego powstają czynniki wzrostu, których efekt końcowy miałby odzwierciedlenie w zwiększonej neurogenezie i proliferacji komórek.,
chociaż nadal musimy pogłębiać naszą wiedzę, aby móc wykorzystywać komórki macierzyste jako skuteczną terapię, badania eksperymentalne na zwierzętach wykazały, że różne typy komórek macierzystych są w stanie przetrwać w uszkodzonym mózgu, różnicować się w neurony lub glię, integrować się z tkanką docelową i korzystnie modyfikować wyniki behawioralne (recenzowane w Bennet et al.28)., Ostatnie badania donoszą, że podawanie mezenchymalnych komórek macierzystych w połączeniu z 24-godzinnym ochładzaniem u młodych szczurów 7 dni po urodzeniu osiągnęło lepsze wyniki w porównaniu z leczeniem w izolacji 29, a także wykazały, że hipotermia rozszerza terapeutyczny okres podawania mezenchymalnych komórek macierzystych do maksymalnie 2 dni po zdarzeniu niedotlenczo-niedokrwiennym.,Ponadto komórki macierzyste mogą regulować odpowiedź immunologiczną poprzez interakcje z efektorowymi komórkami immunologicznymi zlokalizowanymi w narządach odległych od mózgu, takich jak śledziona, których mobilizacja może nasilać reakcję zapalną i uszkodzenie niedokrwienne w niedojrzałym mózgu, zwiększając w ten sposób ich działanie neuroprotekcyjne.,31,32
terapia komórkami macierzystymi, sama lub w połączeniu z hipotermią terapeutyczną, jest obiecującą dziedziną badań, która nadal wymaga badań klinicznych w celu określenia, między innymi, najskuteczniejszego rodzaju komórek macierzystych oraz optymalnej dawki i czasu trwania leczenia w celu uzyskania najlepszych możliwych wyników leczenia.,Jeden z projektów realizowanych obecnie w fazie rekrutacji (badanie hCT-MSC u noworodków z umiarkowaną lub ciężką HIE, NCT03635450) obejmie 6 niemowląt urodzonych w wieku ciążowym 36 lub więcej tygodni z umiarkowaną lub ciężką HIE, które będą leczone hipotermią oraz 2 dożylne dawki mezenchymalnych komórek zrębowych pochodzących z tkanki pępowinowej (hCT-MSC). Głównym celem tego badania fazy i jest Ocena bezpieczeństwa hCT-MSC oraz analiza wyników przeżycia i rozwoju neurologicznego u uczestników odpowiednio po 6 i 16 miesiącach., Kolejne badanie fazy i (NCT00593242) uzyskało obiecujące wyniki z autologicznym przeszczepieniem komórek pępowinowej krwi, przy czym 74% noworodków, które otrzymały komórki macierzyste, przeżyło z wynikiem 85 lub wyższym w skali Bayleya w porównaniu do 41% noworodków leczonych wyłącznie chłodzeniem.33
N-acetylocysteina
N-acetylocysteina (NAC) jest prekursorem cysteiny,która usuwa wolne rodniki i bierze udział w utrzymaniu glutationu 34, regulując w ten sposób stres oksydacyjny., Dowody z modeli zwierzęcych wykazały większe zmniejszenie objętości zawału mózgu u zwierząt leczonych kombinacją NAC i hipotermii w porównaniu do zwierząt leczonych tylko jedną z tych interwencji. Ponadto u zwierząt leczonych terapią skojarzoną stwierdzono podobne wyniki w zakresie odruchów i uszkodzeń substancji białej do tych stwierdzonych w grupie kontrolnej.Ponieważ jego podawanie w czasie ciąży nie ma działania teratogennego i może przenikać przez łożysko 36, NAC został uznany za jeden z najbardziej obiecujących środków terapeutycznych do przyszłego stosowania w oddziałach intensywnej terapii noworodków., Jednak zgodnie z naszą wiedzą do tej pory nie zaprojektowano żadnych badań klinicznych, aby ocenić jego zastosowanie w leczeniu HIE, a dostępne dowody są ograniczone do badań związanych z zapaleniem wewnątrz owodniowym, zapaleniem kosmówki lub zespołem niewydolności oddechowej.
gazy szlachetne
gazy szlachetne, takie jak ksenon i radon, wykazują działanie neuroprotekcyjne w zwierzęcych modelach noworodków HI. Liczne badania analizowały możliwość stosowania ksenonu jako środka terapeutycznego (przegląd dowodów znajduje się w artykule Lobo et al.,37) ze względu na jego zdolność do zmniejszania ekscytotoksyczności po HIT poprzez modulację receptorów glutaminianowych NMDA.38,39
w wieloośrodkowym badaniu klinicznym Total Body hypothermia plus Xenon (TOBY-XE) zastosowano Gaz ksenonowy w połączeniu z hipotermią w próbie 92 niemowląt urodzonych między 36 A 43 tygodniem ciąży., Chociaż nie stwierdzono istotnych różnic między grupami 40 w celu uzyskania bardziej szczegółowych informacji na temat niektórych zmiennych,które mogły mieć wpływ na wyniki leczenia tym gazem szlachetnym, takich jak jego dawkowanie lub czas trwania, obecnie trwa badanie kliniczne II Fazy (badanie CoolXenon3, Nct02071394).,
z drugiej strony do tej pory nie przeprowadzono badań klinicznych argonu, ale wykazano, że argon poprawia wyniki chłodzenia pod względem poziomu markera N-acetylo-asparaginianu / mleczanu, co było związane ze wzrostem średniej wartości śmierci komórek i rozwojem następstw neurologicznych u noworodków dotkniętych chorobą.Te obiecujące wyniki, wraz z wyższą biodostępnością i niższym kosztem w porównaniu z ksenonem, sprawiają, że argon jest cząsteczką o wysokim potencjale translacji ławki do łóżka w leczeniu HIE.,
wnioski
osiągnięcie skutecznego leczenia HIE jest jednym z wielkich wyzwań stojących przed współczesną medycyną. Z tego powodu od lat podejmowane są znaczne wysiłki w celu analizy mechanizmów prowadzących do uszkodzenia komórek mózgu po asfiksji okołoporodowej w celu opracowania skutecznych metod ich blokowania. Obecnie pediatrzy i neurolodzy próbują opracować nowe związki, które mogłyby działać w synergii z hipotermią w celu zmniejszenia do minimum następstw neurologicznych HIE., Z drugiej Strony, ostatnie badania zaczęły włączać Płeć do zmiennych, które należy uwzględnić w zarządzaniu HIE, ponieważ dymorficzne różnice płciowe stwierdzono zarówno w mechanizmach urazów (w modelach doświadczalnych samice wykazywały większe deficyty pamięci, podczas gdy samce wykazywały większą podatność na stres oksydacyjny), jak i w ścieżkach różnych analizowanych metod leczenia., Pomimo obiecujących postępów dokonanych za pomocą melatoniny lub związków takich jak EPO, badania przedkliniczne są nadal potrzebne do dalszego wyjaśnienia mechanizmów działania tych cząsteczek, a badania kliniczne z większymi próbkami są potrzebne do określenia optymalnej dawki i dróg podawania tych i innych metod leczenia.
finansowanie
badanie było wspierane przez grant udzielony przez UPV / EHU w ramach Programu finansowania grupy badawczej Uniwersytetu (GIU 17/018).
konflikty interesów
autorzy nie mają żadnych konfliktów interesów do zadeklarowania.