10.6: Lattice Estruturas em Sólidos Cristalinos
Unidade Células de Metais
A estrutura de um sólido cristalino, se um metal ou não, é melhor descrito, considerando sua mais simples unidade de repetição, o que é denominado de célula unitária. A célula unitária consiste em pontos de retículo que representam a localização dos átomos ou íons. A estrutura inteira consiste então nesta célula unitária que se repete em três dimensões, como ilustrado na figura \(\PageIndex{1}\).,
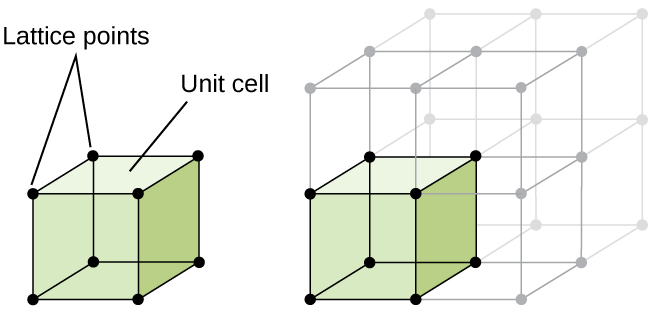
vamos começar a nossa investigação da estrutura de retículos cristalinos e células unitárias com a estrutura mais simples e a célula unitária mais básica. Para visualizar isso, imagine pegar um grande número de esferas idênticas, como bolas de tênis, e organizá-las uniformemente em um recipiente., A maneira mais simples de fazer isso seria fazer camadas nas quais as esferas de uma camada estão diretamente acima das da camada abaixo, como ilustrado na figura \(\PageIndex{2}\). Este arranjo é chamado de estrutura cúbica simples, e a célula unitária é chamada de célula cúbica simples ou célula cúbica primitiva.
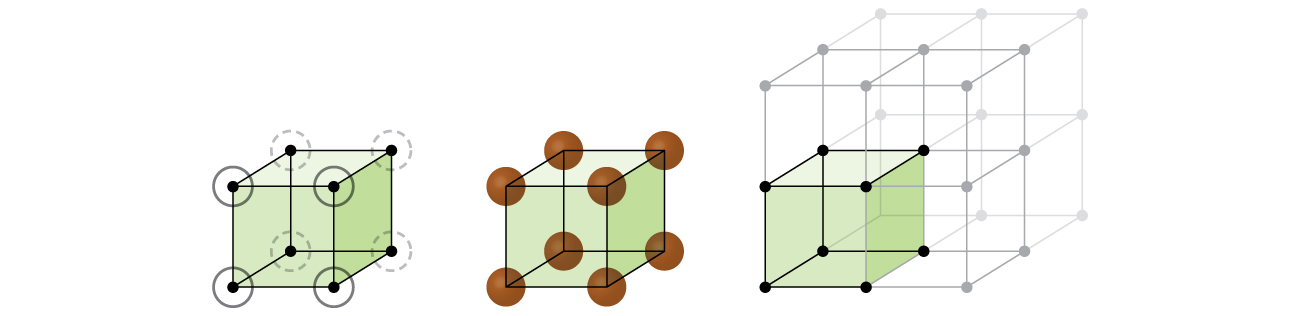
em uma estrutura cúbica simples, as esferas não são embaladas tão perto quanto poderiam ser, e elas apenas” preenchem ” cerca de 52% do volume do recipiente. Este é um arranjo relativamente ineficiente, e apenas um metal (polônio, Po) cristaliza em uma estrutura cúbica simples. Como mostrado na Figura \(\PageIndex{3}\), um sólido com este tipo de arranjo é composto de aviões (ou camadas), em que cada átomo de contatos apenas os quatro vizinhos mais próximos em sua capa; um átomo diretamente acima da camada acima; e um átomo diretamente abaixo da camada abaixo., O número de outras partículas que cada partícula em um contato sólido cristalino é conhecido como seu número de coordenação. Para um átomo de polônio em uma matriz cúbica simples, o número de Coordenação é, portanto, seis.

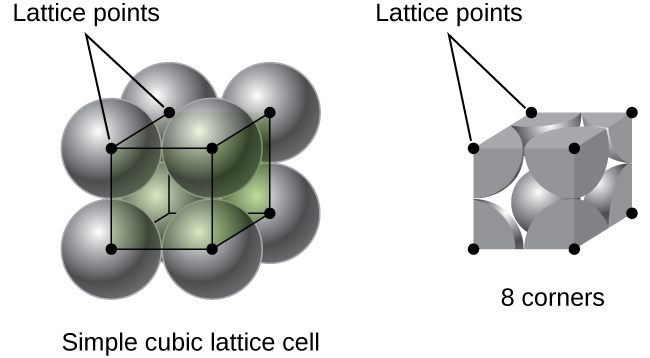
em uma estrutura cúbica simples, a célula unitária que repete em todas as direções é um cubo definido pelos centros de oito átomos, como mostrado na figura \(\PageIndex{4}\). Os átomos nos cantos adjacentes desta célula se contatam uns aos outros, de modo que o comprimento da borda desta célula é igual a dois raios atômicos, ou um diâmetro atômico. Uma célula cúbica contém apenas as partes destes átomos que estão dentro dela. Uma vez que um átomo em um canto de uma simples célula cúbica está contido por um total de oito células unitárias, apenas um oitavo desse átomo está dentro de uma unidade específica., E uma vez que cada célula cúbica simples tem um átomo em cada um dos seus oito “cantos”, há \(8×\dfrac{1}{8}=1\) átomo dentro de uma simples célula cúbica.
a maioria dos cristais de metal são um dos quatro maiores tipos de células unitárias., Por agora, vamos focar nas três células cúbicas: cúbicas simples (que já vimos), unidades cúbicas centradas no corpo, e células cúbicas centradas no rosto-todas as quais são ilustradas na figura \(\PageIndex{5}\). (Note que existem na verdade sete sistemas retículos diferentes, alguns dos quais têm mais de um tipo de retículo, para um total de 14 tipos diferentes de células unitárias. Deixamos as geometrias mais complicadas para mais tarde neste módulo.,)
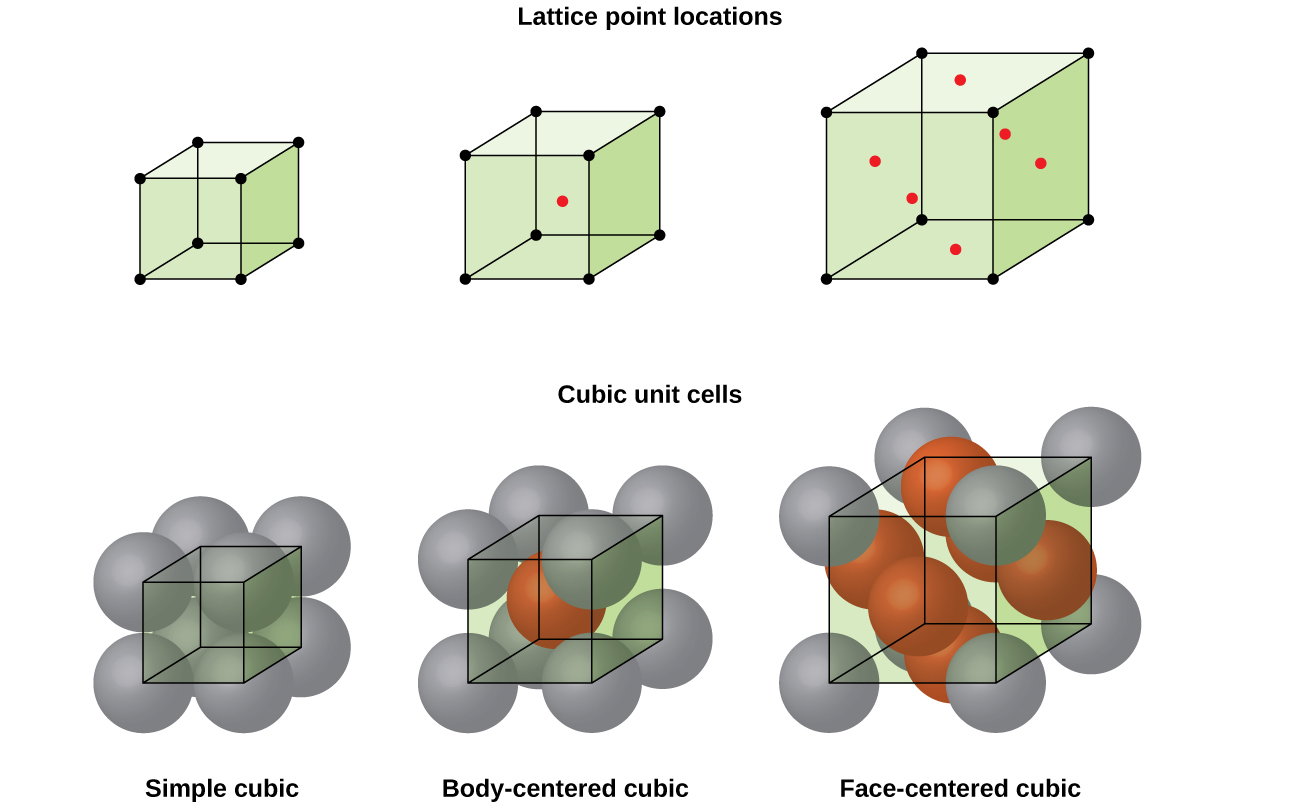
Alguns metais cristalizam em um arranjo que tem uma célula unitária cúbica com os átomos, em todos os cantos e um átomo no centro, como mostrado na Figura \(\PageIndex{6}\). Isto é chamado de sólido cúbico centrado no corpo (BCC)., Átomos nos cantos de uma célula de unidade BCC não entram em contato uns com os outros, mas entram em contato com o átomo no centro. Uma célula de unidade BCC contém dois átomos: um oitavo de um átomo em cada um dos oito cantos (\(8×\dfrac{1}{8}=1\) atom dos cantos) mais um átomo do centro. Qualquer átomo nesta estrutura toca quatro átomos na camada acima dela e quatro átomos na camada abaixo dela. Assim, um átomo numa estrutura BCC tem um número de coordenação de oito.,
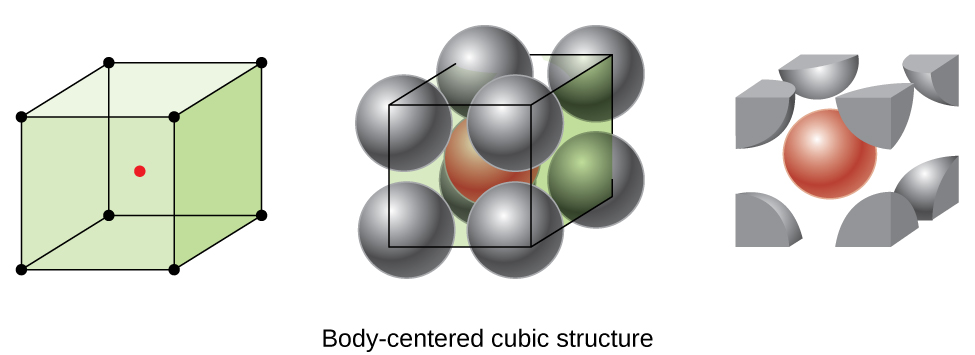
átomos em arranjos BCC são muito mais eficientemente embalados do que em uma estrutura cúbica simples, ocupando cerca de 68% do volume total. Metais isomorfos com uma estrutura BCC incluem K, Ba, Cr, Mo, W e Fe à temperatura ambiente., (Elements or compounds that crystallize with the same structure are said to be isomorphous.)
muitos outros metais, tais como alumínio, cobre e chumbo, cristalizam em um arranjo que tem uma unidade cúbica de célula com átomos em todos os cantos e nos centros de cada face, como ilustrado na figura \(\PageIndex{7}\). Este arranjo é chamado de sólido cúbico centrado na face (FCC)., Uma unidade de FCC célula contém quatro átomos: um oitavo de um átomo em cada um dos oito cantos (\(8×\dfrac{1}{8}=1\) átomo de cantos) e metade de um átomo em cada uma das seis faces (\(6×\dfrac{1}{2}=3\) os átomos das faces). Os átomos nos cantos tocam os átomos nos centros das faces adjacentes ao longo das diagonais da face do cubo. Como os átomos estão em pontos de rede idênticos, eles têm ambientes idênticos.
átomos em um arranjo FCC são embalados o mais próximo possível, com átomos ocupando 74% do volume., Esta estrutura também é chamada de embalagem cúbica mais próxima (CCP). No CCP, há três camadas repetidas de átomos com arranjo hexagonal. Cada átomo contacta seis átomos em sua própria camada, três na camada acima, e três na camada abaixo. Neste arranjo, cada átomo toca 12 vizinhos próximos, e portanto tem um número de coordenação de 12. O facto de os acordos FCC e CCP serem equivalentes pode não ser imediatamente óbvio, mas a razão pela qual são na verdade a mesma estrutura é ilustrada na figura \(\PageIndex{8}\).,
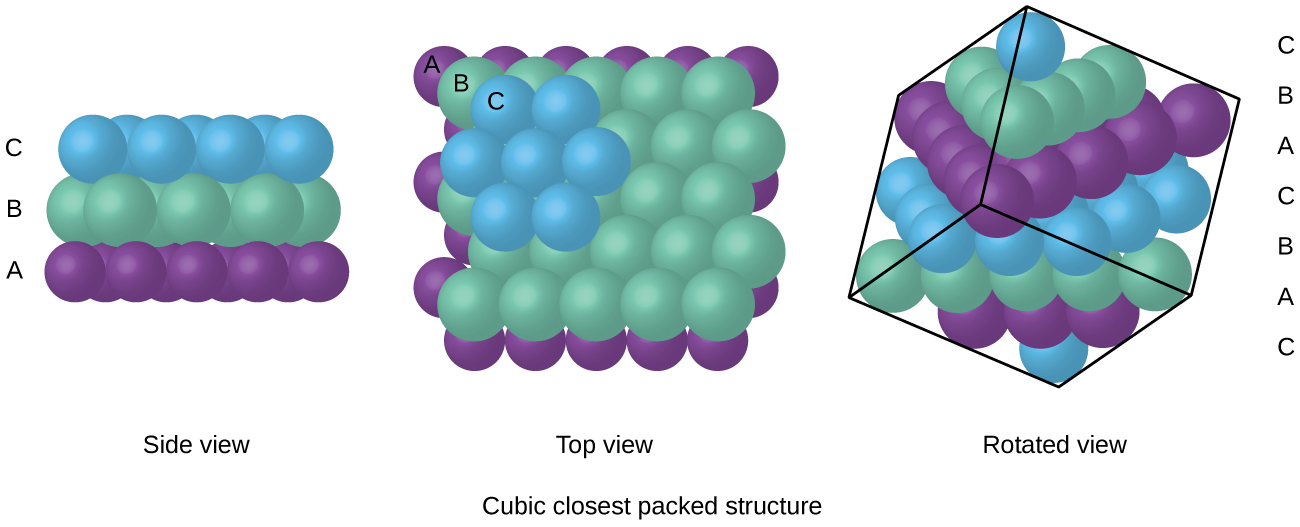
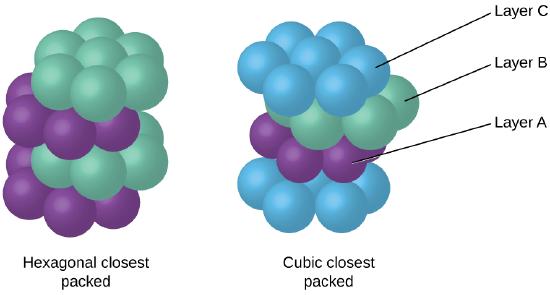
Because closer packing maximizes the overall attractions between atoms and minimizes the total intermolecular energy, the atoms in most metals pack in this way., Encontramos dois tipos de embalagem mais próxima em estruturas cristalinas metálicas simples: CCP, que já encontramos, e embalagem hexagonal mais próxima (HCP) mostrada na figura \(\PageIndex{9}\). Ambos consistem em camadas repetidas de átomos com arranjo hexagonal. Em ambos os tipos, uma segunda camada (B) é colocada na primeira camada (a) de modo que cada átomo na segunda camada está em contato com três átomos na primeira camada. A terceira camada é posicionada de uma de duas maneiras. Em HCP, átomos na terceira camada estão diretamente acima dos átomos na primeira camada (i.e.,, a terceira camada também é tipo A), e o empilhamento consiste em camadas alternadas de tipo A E Tipo B (isto é, ababab⋯). Em CCP, os átomos na terceira camada não estão acima dos átomos em nenhuma das duas primeiras camadas (ou seja, a terceira camada é tipo C), e o empilhamento consiste em camadas alternadas tipo A, Tipo B, E Tipo C de camadas fechadas (ou seja, ABCABCABC⋯). Cerca de dois terços de todos os metais cristalizam em matrizes com números de coordenação de 12., Metais que cristalizam em uma estrutura HCP incluem Cd, Co, Li, Mg, Na, E Zn, e metais que cristalizam em uma estrutura CCP incluem Ag, Al, Ca, Cu, Ni, Pb, e Pt.
Exercise \(\PageIndex{2}\)
Silver crystallizes in an FCC structure. O comprimento da aresta de sua célula unitária é de 409 pm.
- Qual é o raio Atómico do Ag nesta estrutura?
- calcular a densidade da Ag.
Resposta
144 pm
a Resposta b
10,5 g/cm3
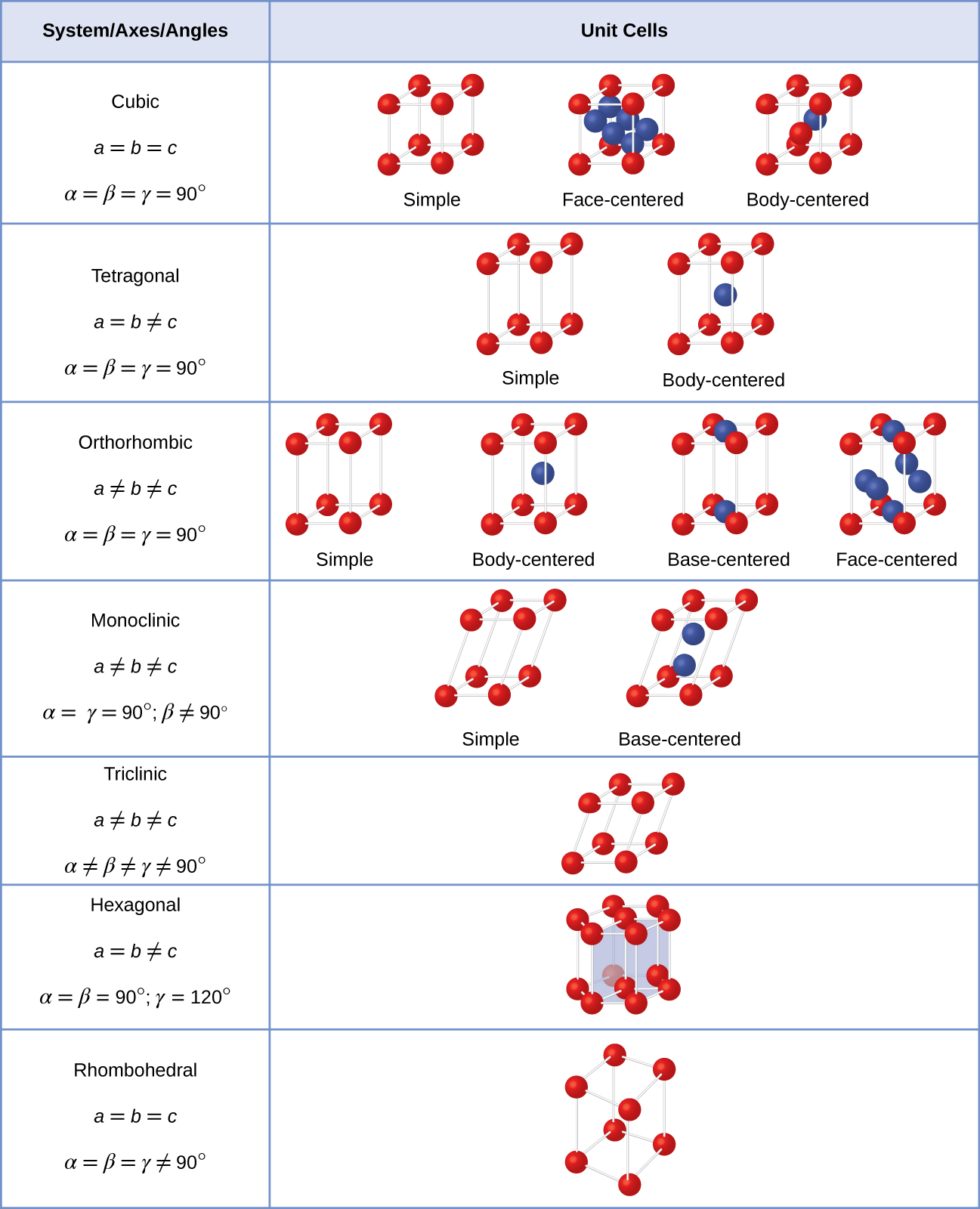
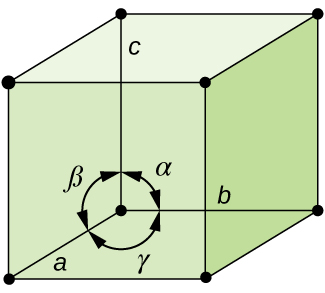
Em geral, uma célula unitária é definida pelo comprimento de três eixos (a, b e c) e o ângulo (α, β, e γ) entre eles, como ilustrado na Figura \(\PageIndex{10}\)., Os eixos são definidos como sendo os comprimentos entre pontos na estrutura espacial. Consequentemente, os eixos das células unitárias ligam pontos com ambientes idênticos.
Existem sete diferentes lattice sistemas, alguns dos quais têm mais de um tipo de treliça, para um total de quatorze diferentes unidades de células, que têm as formas mostrado na Figura \(\PageIndex{11}\).