6.3: Configuração Absoluta e a (R) e (S) Sistema
Absoluta Configurações de Perspectiva Fórmulas
os Químicos precisam de uma conveniente maneira de distinguir uma stereoisomer de outro. O sistema Cahn-Ingold-Prelog é um conjunto de regras que nos permite definir inequivocamente a configuração estereoquímica de qualquer estereocentro, usando as designações “R’ (do latim rectus, significando destro) ou ” S ” (do latim sinistro, significando canhoto)., as regras deste sistema de nomenclatura estereoquímica são, à primeira vista, bastante simples.
regras para atribuir uma designação r/s a um centro quiral
1: atribuir prioridades aos quatro substituintes, com #1 sendo a maior prioridade e #4 a menor. As prioridades baseiam-se no número atómico.
2: Trace um círculo de #1 a #2 a #3.
3: Determinar a orientação do grupo prioritário #4. Se estiver orientado para o plano da página (longe de você), vá para o passo 4a. se estiver orientado para fora do plano da página (em direção a você) vá para o passo 4b.,
4a: (#4 grupo a apontar para longe de si): um círculo no Sentido DOS ponteiros do relógio na parte 2 corresponde à configuração R, enquanto um círculo no sentido anti-horário corresponde à configuração S.
4b: (#4 grupo a apontar para si): um círculo no Sentido DOS ponteiros do relógio na parte 2 corresponde à configuração S, enquanto um círculo no sentido anti-horário corresponde à configuração R.usaremos o gliceraldeído de 3-carbono como nosso primeiro exemplo. A primeira coisa que devemos fazer é atribuir prioridade a cada um dos quatro substituintes ligados ao centro quiral., Nós primeiro olhamos para os átomos que estão diretamente ligados ao centro quiral: estes são H, O (no hidroxil), C (no aldeído), e C (no grupo CH2OH).
atribuindo a configuração R/S ao gliceraldeído:

duas prioridades são fáceis: hidrogênio, com um número atômico de 1, é a prioridade mais baixa (#4), e o oxigênio hidroxila, com o número atômico 8, é a prioridade #1. O carbono tem um número atômico de 6. Qual dos dois grupos ” C ” é a prioridade número 2, o aldeído ou o CH2OH?, Para determinar isso, movemos mais uma ligação para longe do centro quiral: para o aldeído temos uma ligação dupla a um oxigênio, enquanto no grupo CH2OH temos uma ligação única a um oxigênio. Se o átomo é o mesmo, as ligações duplas têm uma prioridade maior do que as ligações únicas. Portanto, ao grupo aldeído é atribuída a prioridade #2 e ao grupo CH2OH a prioridade #3.
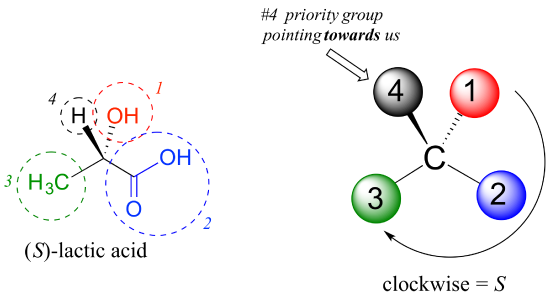
com as nossas prioridades atribuídas, olhamos em seguida para o grupo de prioridade #4 (o hidrogênio) e vemos que ele é apontado de volta para longe de nós, no plano da página – assim passo 4a do procedimento acima se aplica., Em seguida, traçamos um círculo definido pelos grupos de prioridade #1, #2, e #3, em ordem crescente. O círculo é no Sentido DOS ponteiros do relógio, que pela etapa 4a nos diz que este carbono tem a configuração ‘R’, e que esta molécula é (R)-gliceraldeído. O seu enantiómero, por definição, deve ser (s) – gliceraldeído.em seguida, vamos olhar para um dos enantiômeros do ácido láctico e determinar a configuração do centro quiral. Claramente, H é o substituinte # 4 e OH é #1. Devido às suas três ligações ao oxigênio, o carbono no grupo ácido tem prioridade #2, e o grupo metil leva #3., O grupo # 4, hidrogênio, acontece ser desenhado apontando para nós (fora do plano da Página) nesta figura, então usamos o passo 4b: o círculo traçado de #1 a #2 a #3 é no sentido horário, o que significa que o centro quiral tem a configuração S.
a droga talidomida é um estudo de caso interessante – mas trágico – na importância da estereoquímica no design de drogas., Fabricada pela primeira vez por uma empresa de drogas Alemã e receitada amplamente na Europa e Austrália no final dos anos 1950″s como um sedativo e remédio para a doença matinal em mulheres grávidas, a talidomida foi logo implicada como a causa de defeitos de nascimento devastadores em bebês nascidos de mulheres que a tinham tomado. A talidomida contém um centro quiral, e assim existe em duas formas enantioméricas. Foi comercializado como uma mistura racêmica:em outras palavras, uma mistura 50: 50 de ambos os enantiômeros.
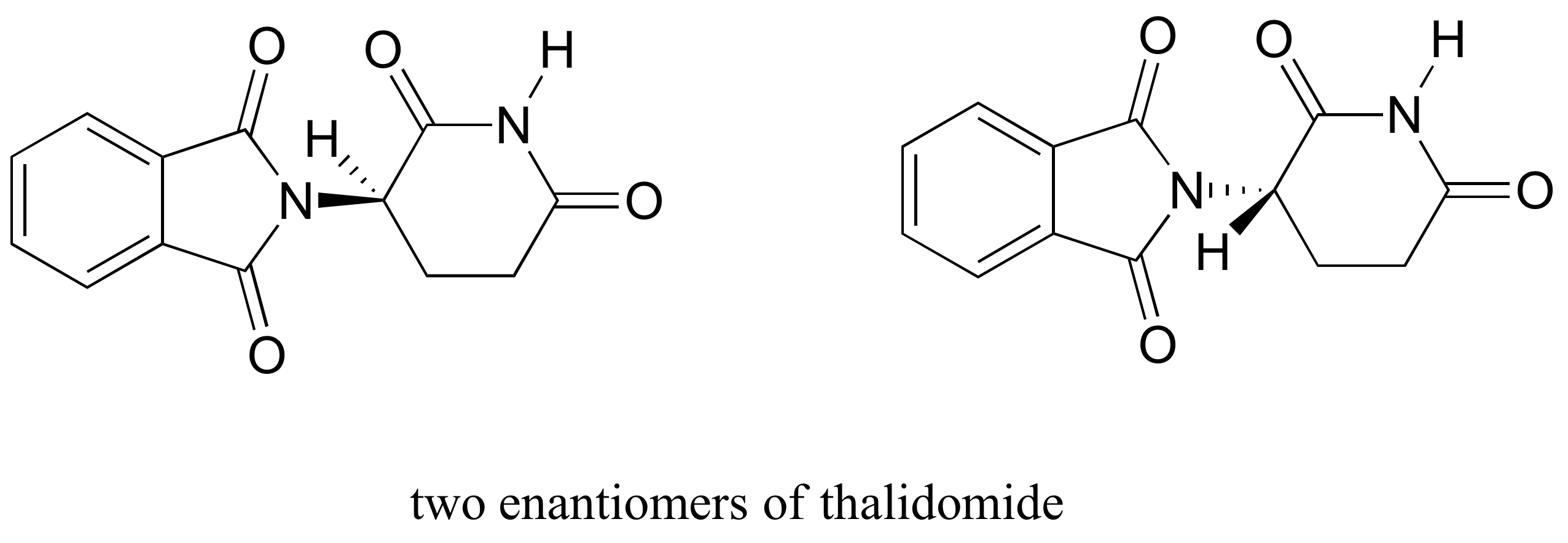
vamos tentar determinar a configuração estereoquímica do enantiómero à esquerda., Das quatro ligações ao centro quiral, a prioridade número 4 é o hidrogênio. O grupo nitrogênio é #1, o lado carbonila do anel é #2, e o lado –CH2 do anel é #3.
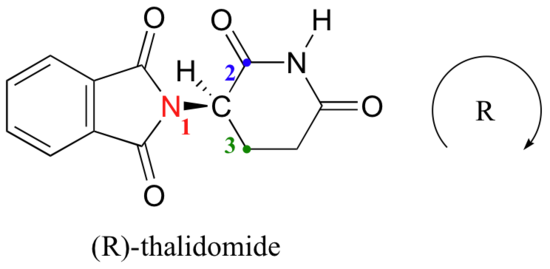
o hidrogénio é mostrado a apontar para longe de nós, e os substituintes priorizados traçam um círculo no Sentido DOS ponteiros do relógio: Este é o enantiómero R da talidomida. O outro enantiômero, é claro, deve ter a configuração S.,embora os cientistas ainda não saibam como a talidomida funciona hoje, evidências experimentais sugerem que foi na verdade o enantiómero R que teve os efeitos médicos desejados, enquanto o enantiómero S causou os defeitos de nascença. Mesmo com esse conhecimento, no entanto, pura (R)-a talidomida não é segura, porque as enzimas no corpo rapidamente se convertem entre os dois enantiômeros – veremos como isso acontece no Capítulo 12. como nota histórica, a talidomida nunca foi aprovada para uso nos Estados Unidos. Isto foi em grande parte graças aos esforços do Dr., Frances Kelsey, uma Oficial De Alimentos e drogas que, em perigo de sua carreira, bloqueou sua aprovação devido às suas preocupações sobre a falta de estudos de segurança adequados, particularmente no que diz respeito à capacidade da droga para entrar na corrente sanguínea de um feto em desenvolvimento. Infelizmente, porém, na época, os ensaios clínicos para novas drogas envolveram distribuição generalizada e não regulamentada para médicos e seus pacientes em todo o país, de modo que as famílias nos EUA não foram poupadas dos danos causados.,
muito recentemente, um derivado próximo da talidomida tornou-se legal para prescrever novamente nos Estados Unidos, com medidas de segurança rigorosas aplicadas, para o tratamento de uma forma de câncer de sangue chamado mieloma múltiplo. No Brasil, a talidomida é usada no tratamento da lepra – mas apesar das medidas de segurança, as crianças ainda estão nascendo com defeitos relacionados à talidomida.Exercício 1.: Determine as configurações estereoquímicas dos centros quirais nas biomoléculas mostradas abaixo.
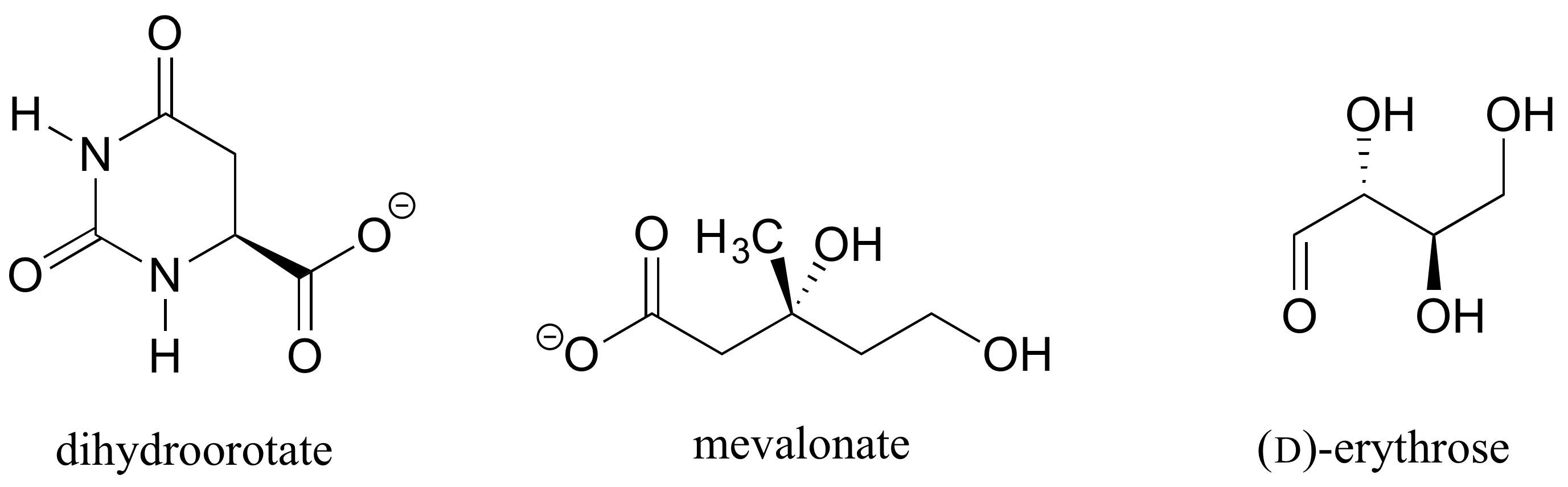
Exercício 2.,: O enantiômero (R) do malato deve ter uma cunha sólida ou amarrada para a ligação C-O na figura abaixo?
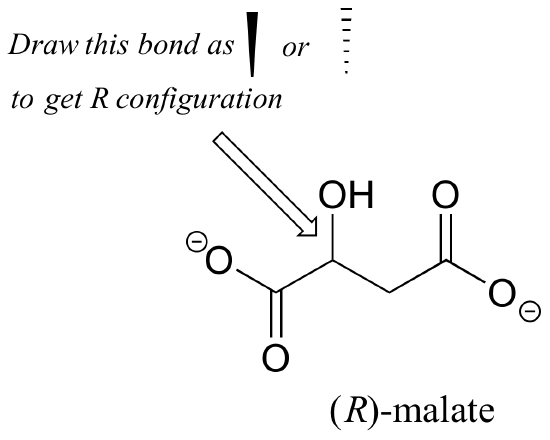
Exercício 3.: Usando cunhas sólidas ou tracejadas para mostrar estereoquímica, desenhar o enantiômero (R) do ibuprofeno e o enantiômero (S) do 2-metileritritol-4-fosfato (estruturas são mostradas anteriormente neste capítulo sem estereoquímica).
soluções para exercícios
Configurações absolutas de projeções de Fischer
para determinar a configuração absoluta de um centro quiral em uma projeção de Fisher, use o seguinte procedimento em duas etapas.,
Passo 1
atribuir números de prioridade aos quatro ligandos (grupos) ligados ao centro quiral usando o sistema de prioridade CIP.
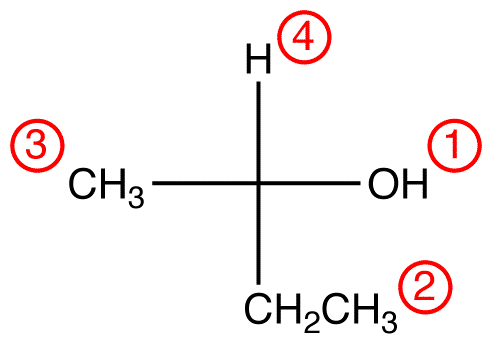
Passo 2 – opção vertical
Se o ligando de prioridade mais baixa estiver numa ligação Vertical, então está a apontar para longe do visualizador.
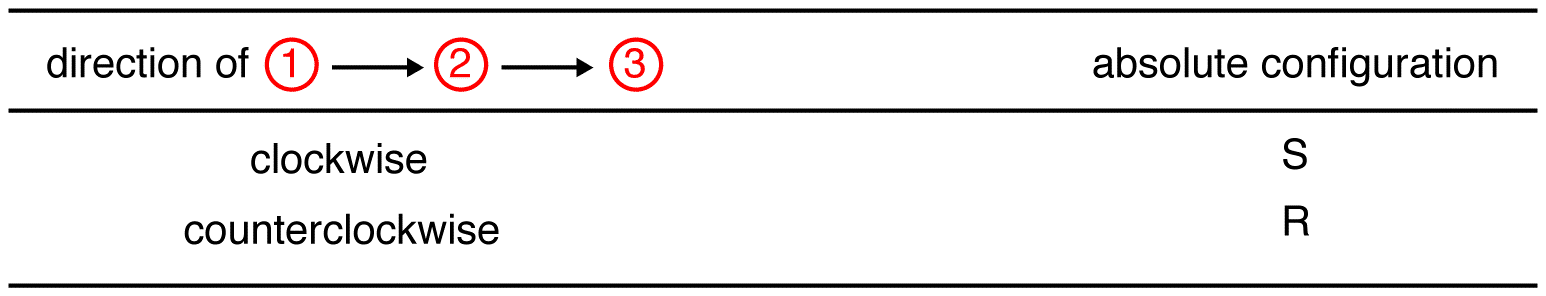
Trace the three highest-priority ligands starting at the highest-priority ligand ( ① → → → → ) in the direction that will give a Very correct answer.
no composto abaixo, o movimento é no Sentido DOS ponteiros do relógio indicando uma configuração R., O nome completo do IUPAC para este composto é (R)-butan-2-ol.

Step 2 – opção horizontal
Se o ligando de prioridade mais baixa estiver numa ligação Horizontal, então está a apontar para o visualizador.
Trace the three highest-priority ligands starting at the highest-priority ligand ( ① → → → → ) in the direction that will give a Horribly wrong answer. Note na tabela abaixo que as configurações são invertidas a partir do primeiro exemplo.,
no composto abaixo, o movimento é no Sentido DOS ponteiros do relógio (R), O que é horrivelmente errado, de modo que a configuração real é S. o nome completo do IUPAC para este composto é (s)-butan-2-ol.
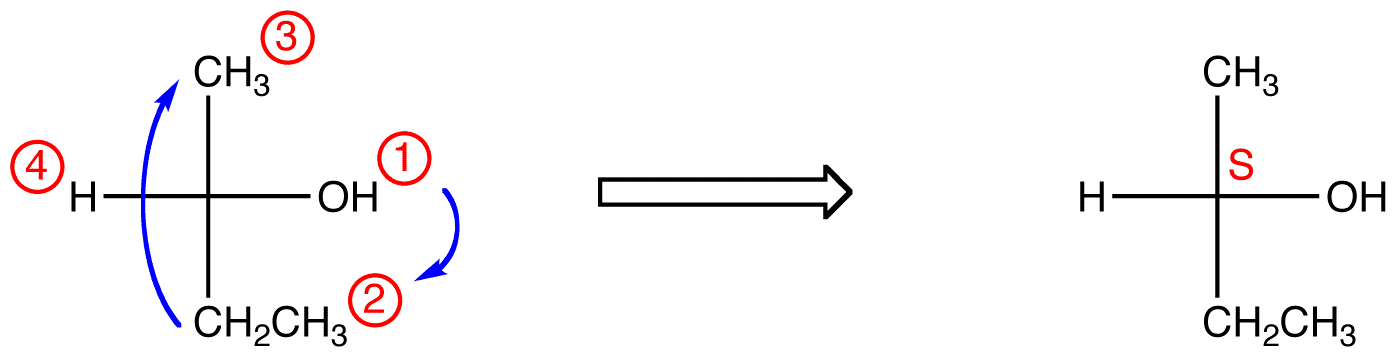
manipulando projeções Fischer sem alteração na configuração
uma projeção Fischer restringe uma molécula tridimensional em duas dimensões. Consequentemente, existem limitações quanto às operações que podem ser realizadas em uma projeção de Fischer sem mudar a configuração absoluta em centros quirais., As operações que não alteram a configuração absoluta em um centro quiral em uma projeção de Fischer podem ser resumidas como duas regras.
Regra 1: rotação da projeção de Fischer por 180 ° em qualquer direção sem levantá-la do plano do papel não altera a configuração absoluta no centro quiral.
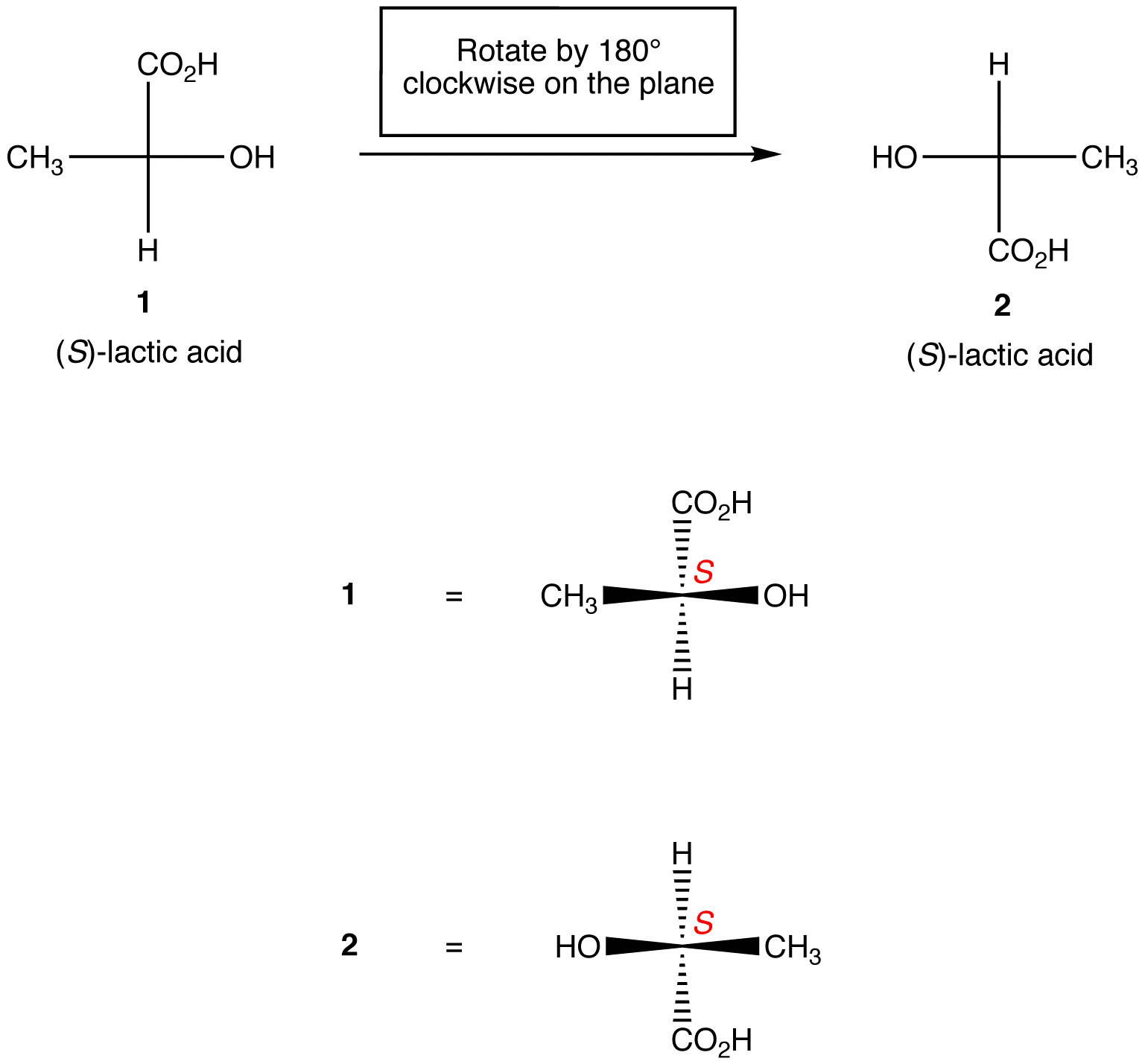
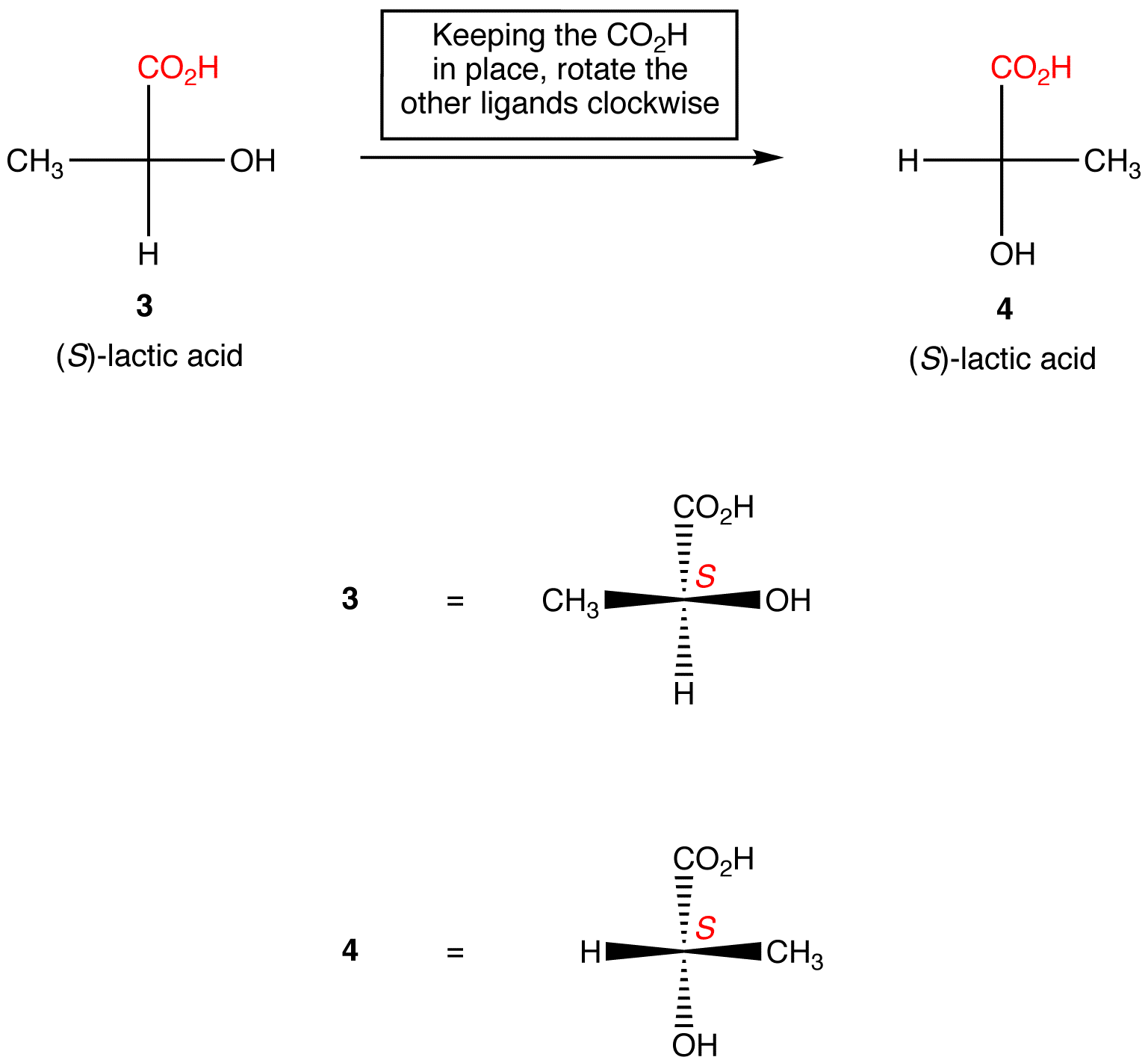
Regra 2: Rotação de três ligandos no centro quiral em qualquer direção, mantendo o restante do ligante no lugar, não altere a configuração absoluta no centro quiral.,
a Manipulação de Fischer Projeções com Alteração de Configuração
As operações que mudam a configuração absoluta em um centro quiral em uma projeção de Fischer pode ser resumido como duas regras.
Regra 1: rotação da projeção de Fischer por 90º em qualquer direção muda a configuração absoluta no centro quiral.
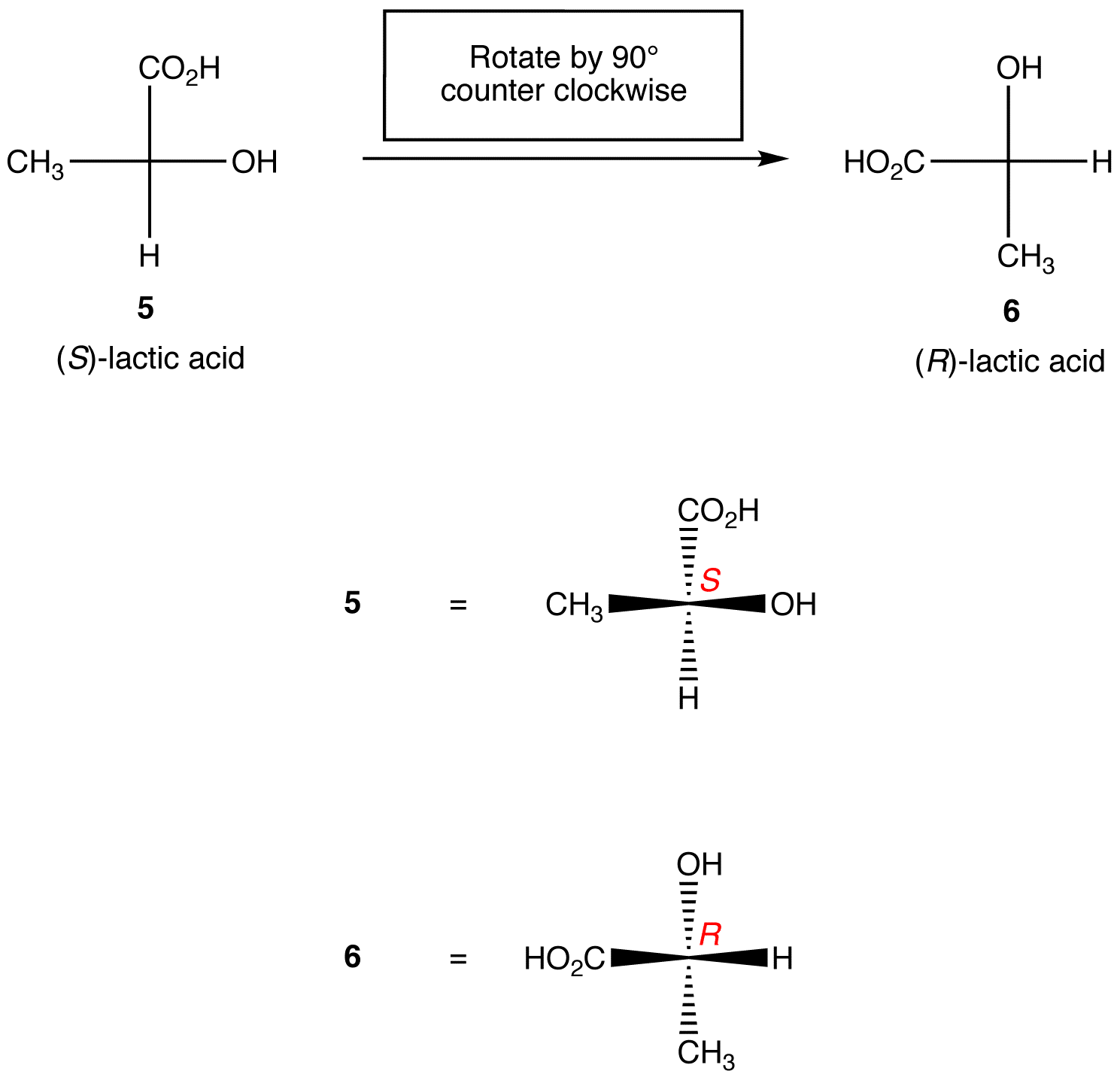
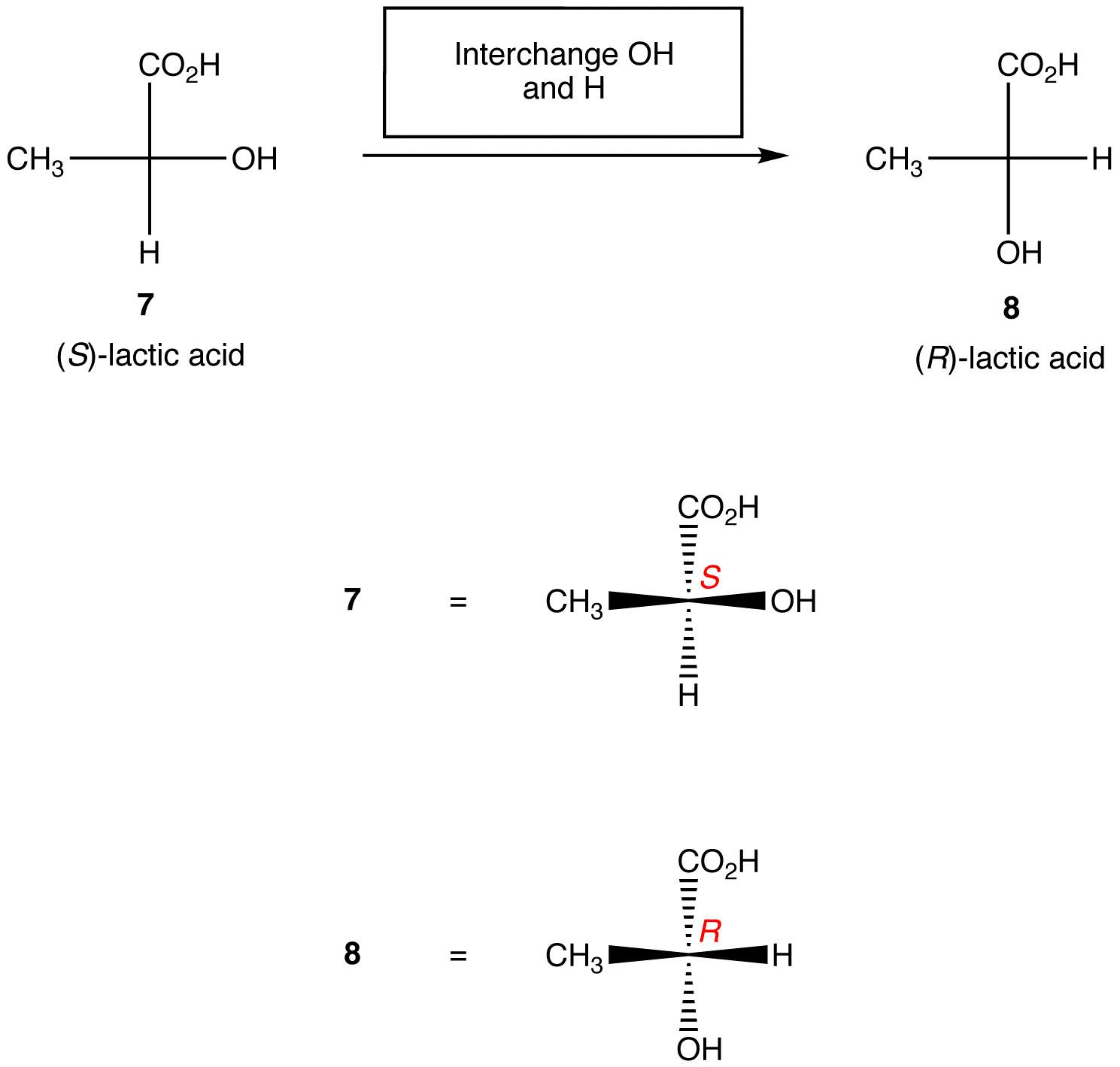
Regra 2: trocar quaisquer dois ligandos no centro quiral muda a configuração absoluta no centro quiral.,
as regras acima assumem que a projeção de Fischer em consideração contém apenas um centro quiral. No entanto, com cuidado, eles podem ser aplicados a projeções Fischer contendo qualquer número de centros quirais.Exercício 1 classificar os seguintes compostos como R ou s?
Solução
- S: I > Br > F > H. A prioridade mais baixa substituinte, H, já está indo para trás., Ele vira para a esquerda de I para Ir para F, então ele”s S.
- R: Br > Cl > CH3 > H. Você tem que mudar o H e Br para colocar o H, o de menor prioridade, na parte de trás. Então, indo de Br para Cl, CH3 está se virando para a direita, dando-lhe um R.
- nem R ou S: esta molécula é achiral. Somente moléculas quirais pode ser chamado R ou S.
- R: AH > CN > CH2NH2 > H. H, a prioridade mais baixa, tem que ser mudado para o de volta., Em seguida, passando a partir de OH CN para CH2NH2, você está virando a direita, dando-lhe um R.
- (5) S: \(\ce{-COOH}\) > \(\ce{-CH_2OH}\) > \(\ce{C#CH}\) > \(\ce{H}\). Depois, indo de \(\ce {- COOH}\) para \(\CE{-CH_2OH}\) para \(\ce{-C#CH}\), está a virar à esquerda, dando-lhe uma configuração de S.exercícios
6. Oriente o seguinte para que o átomo de menor prioridade (4) seja colocado atrás, em seguida, atribuir estereoquímica (R ou S).

7. Desenhar (R)-2-bromobutan-2-ol.8., Atribuir R / S à seguinte molécula.
.png?revision=1)
Soluções

A = S; B = R
8. The stereo center is R.
Other Resources
Kahn Academy video tutorial on the r-S naming system
- Schore and Vollhardt. Estrutura e função da Química Orgânica. New York: W. H. Freeman and Company, 2007.McMurry, John and Simanek, Eric. Fundamentos da Química Orgânica. 6th Ed. Brooks Cole, 2006.,
Colaboradores e Atribuições
- Ekta Patel (UCD), Ifemayowa Aworanti (Universidade de Maryland, Baltimore County)
- Química Orgânica, Com Ênfase Biológica por Tim Soderberg (Universidade de Minnesota, Morris)