Água pesada
a água pesada é água que contém hidrogénio pesado – também conhecido como deutério – no lugar do hidrogénio regular. Também pode ser escrito como 2H2O ou D2O. deutério é diferente do hidrogênio que geralmente ocorre na água—conhecido como protium, uma vez que cada átomo de Deutério contém um próton e um nêutron, enquanto que o hidrogênio mais comum contém apenas um próton. a água pesada ocorre naturalmente, porém em quantidades muito menores do que a água regular., Aproximadamente, uma molécula de água por cada 20 milhões de moléculas de água é água pesada. Como o deutério é um isótopo estável, a água pesada não é radioativa.
In addition to being useful for nuclear reactors, heavy water has also been used in Canada to detect neutrinos from the sun at the Sudbury Neutrino Observatory, providing important insights to subatomic physics.
uso como moderador
página principal
em reatores de fissão nuclear, os nêutrons devem ser retardados para garantir uma reação efetiva em cadeia de fissão., Este processo de desaceleração de neutrões é conhecido como moderação, e o material que atrasa estes neutrões é conhecido como um moderador de neutrões. A água pesada é um dos dois moderadores que podem ser usados para permitir que um reator nuclear funcione usando urânio natural. O outro moderador é grafite. um reator de água pesada utiliza a água pesada como seu refrigerante e moderador. O deutério funciona como moderador, uma vez que absorve menos neutrões do que o hidrogénio, o que é extremamente importante, uma vez que as reacções de fissão nuclear requerem neutrões para levar a cabo as suas reacções em cadeia., A água pesada é mantida sob pressão que aumenta o seu ponto de ebulição para que possa operar a altas temperaturas sem ebulição. Os reatores CANDU utilizam água pesada como moderador e, portanto, não requerem urânio enriquecido, mas urânio em seu estado natural pode ser usado.
Produção
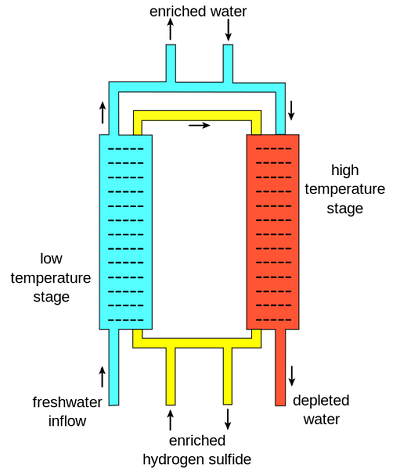
o custo da água pesada é uma parte significativa do custo de construção de um reactor de água pesada, mas torna os reactores mais baratos de funcionar (uma vez que o enriquecimento de urânio não é necessário). Tecnicamente falando, deutério não é” feito ” em um processo específico, em vez de moléculas de água pesada são separadas de grandes quantidades de água contendo H2O ou água isolada no processo de sulfeto de Girdler (que será discutido em detalhes nos dois parágrafos seguintes). A água que não é pesada é descartada e é conhecida como “água esgotada”., Um método alternativo existe quando a água é eletrolizada para produzir oxigênio e hidrogênio que contém gás normal, juntamente com deutério. O hidrogênio é então liquefeito e destilado para separar os dois componentes, então o deutério é reagido com oxigênio para formar água pesada. a produção de água pesada requer infra-estrutura avançada, e a água pesada é ativamente produzida na Argentina, Canadá, Índia e Noruega. A maior fábrica foi a fábrica Bruce no Canadá, mas foi encerrada., Tecnicamente, há uma pequena diferença nos pontos de ebulição de água pesada e água, de modo que esta diferença pode ser aproveitada ao extrair água pesada. No entanto, uma vez que o deutério existe em tão pequenos números, uma enorme quantidade de água teria de ser fervida para obter quantidades significativas de Deutério. Isso exigiria muito combustível ou eletricidade, pelo que, em vez disso, as instalações exploram diferenças químicas entre os dois. O método químico mais importante para a produção de água pesada é o processo de sulfeto de Girdler.,
o processo de sulfeto de Girdler é um método que funciona com base numa troca de Deutério entre H2S e água leve regular. Neste processo, há duas colunas separadas. Uma coluna está a 30 ° C e é conhecida como a “torre fria”, enquanto a outra está a 130 °C, conhecida como a “torre quente”. A separação ocorre com base em um equilíbrio e as diferenças de equilíbrio nas duas temperaturas diferentes. The equilibrium equation is:
The main reason that this process works is a result of hydrogen sulfide gas being circulated between hot and cold towers., Em primeiro lugar, a água doce flui para o estágio de baixa temperatura junto com gás sulfeto de hidrogênio enriquecido com deutério. Como resultado das propriedades de equilíbrio a esta temperatura, deutério migra preferencialmente do sulfeto de hidrogênio enriquecido para a água, criando água pesada. Esta água enriquecida é então retirada, e mais água doce entra na fase de alta temperatura, juntamente com o gás sulfeto de hidrogênio (agora ligeiramente esgotado em deutério). Aqui, qualquer deutério da água doce se move preferencialmente para o gás sulfeto de hidrogênio, enriquecendo-o., Este gás enriquecido, em seguida, volta para o estágio de baixa temperatura, e trabalha para enriquecer ainda mais a água pesada. A água Normal do estágio de alta temperatura, agora esgotada, é retirada. Uma cascata é então montada para que a água “enriquecida” — água com mais deutério-seja alimentada na torre fria e enriquecida novamente.