10.6: Zăbrele Structuri Cristaline Solide
Unitate de Celule de Metale
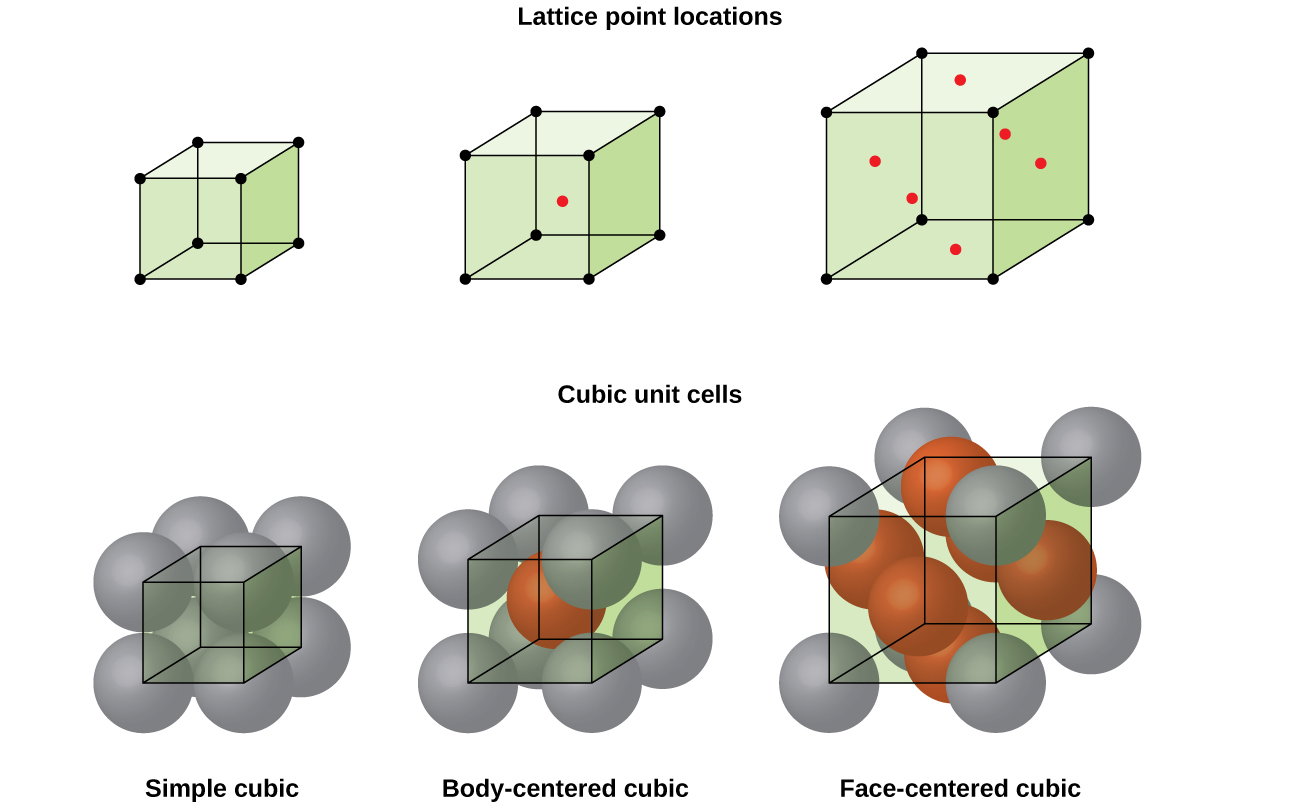
structura unui solid cristalin, dacă un metal sau nu, este cel mai bine descris prin luarea în considerare cea mai simplă unitate repetitivă, care este menționată ca unitate de celule. Celula unitară constă din puncte de zăbrele care reprezintă locațiile atomilor sau ionilor. Întreaga structură constă apoi din această celulă unitate care se repetă în trei dimensiuni, așa cum este ilustrat în figura \(\PageIndex{1}\).,
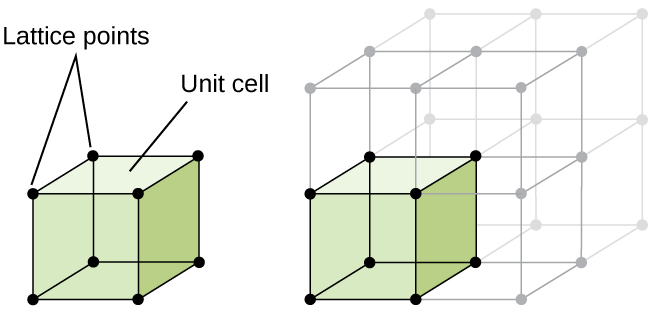
Să începem investigația noastră de cristal lattice structura și unitatea celulele cu cea mai simplă structură și cele mai de bază unitatea de celulă. Pentru a vizualiza acest lucru, imaginați-vă că luați un număr mare de sfere identice, cum ar fi mingi de tenis, și aranjându-le uniform într-un recipient., Cel mai simplu mod de a face acest lucru ar fi de a face straturi, în care sferele într-un singur strat direct peste cele din stratul de mai jos, după cum este ilustrat în Figura \(\PageIndex{2}\). Acest aranjament se numește structură cubică simplă, iar celula unitate se numește celulă unitate cubică simplă sau celulă unitate cubică primitivă.
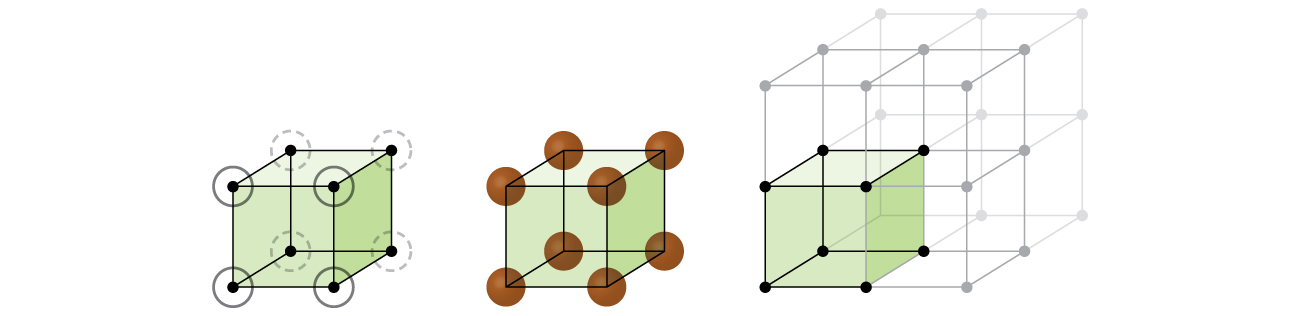
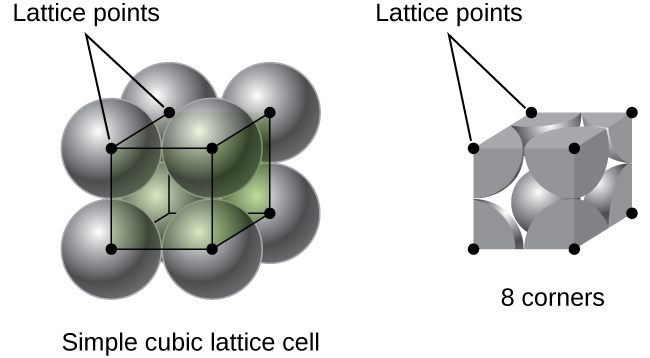
într-o structură cubică simplă, sferele nu sunt ambalate cât de strâns ar putea fi și doar” umple ” aproximativ 52% din volumul containerului. Acesta este un aranjament relativ ineficient și un singur metal (poloniu, Po) cristalizează într-o structură cubică simplă. Așa cum se arată în Figura \(\PageIndex{3}\), un solid cu acest tip de aranjament este format de planele (sau straturi), în care fiecare atom de contacte numai patru vecinii în stratul său; un atom de mai sus direct în stratul de mai sus; și un atom mai jos, direct în stratul de mai jos., Numărul de alte particule pe care fiecare particulă într-un contact solid cristalin este cunoscut sub numele de numărul său de coordonare. Pentru un atom de poloniu într-o matrice cubică simplă, Numărul de coordonare este, prin urmare, șase.

Într-un mod simplu cubic lattice, unitatea de celule care se repetă în toate direcțiile este un cub definit de centre de opt atomi, așa cum se arată în Figura \(\PageIndex{4}\). Atomii de la colțurile adiacente ale acestei celule unitate de contact reciproc, astfel încât lungimea marginii acestei celule este egală cu două raze atomice, sau un diametru atomic. O celulă de unitate cubică conține numai părțile acestor atomi care se află în ea. Deoarece un atom dintr-un colț al unei celule simple de unitate cubică este conținut de un total de opt celule de unitate, doar o optime din acel atom se află într-o celulă de unitate specifică., Și din moment ce fiecare celulă unitate cubică simplă are un atom la fiecare dintre cele opt „colțuri”, există \(8× \ dfrac{1}{8}=1\) atom într-o singură celulă unitate cubică simplă.
majoritatea cristalelor metalice sunt unul dintre cele patru tipuri majore de celule unitare., Deocamdată, ne vom concentra pe cele trei celule cubice: cubice simple (pe care le-am văzut deja), celule cubice centrate pe corp și celule cubice centrate pe față-toate acestea sunt ilustrate în figura \(\PageIndex{5}\). (Rețineți că există de fapt șapte sisteme de zăbrele diferite, dintre care unele au mai mult de un tip de zăbrele, pentru un total de 14 tipuri diferite de celule unitare. Lăsăm geometriile mai complicate pentru mai târziu în acest modul.,)
Unele metale cristalizează într-un aranjament care are un cub unitate de celule cu atomi la toate colțurile și un atom în centru, așa cum se arată în Figura \(\PageIndex{6}\). Aceasta se numește un solid cubic (BCC) centrat pe corp., Atomii din colțurile unei celule de unitate BCC nu se contactează reciproc, ci contactează atomul din centru. O celulă de unitate BCC conține doi atomi: o optime dintr-un atom la fiecare dintre cele opt colțuri (\(8× \ dfrac{1}{8}=1\) atom din colțuri) plus un atom din centru. Orice atom din această structură atinge patru atomi în stratul de deasupra lui și patru atomi în stratul de sub el. Astfel, un atom dintr-o structură BCC are un număr de coordonare de opt.,
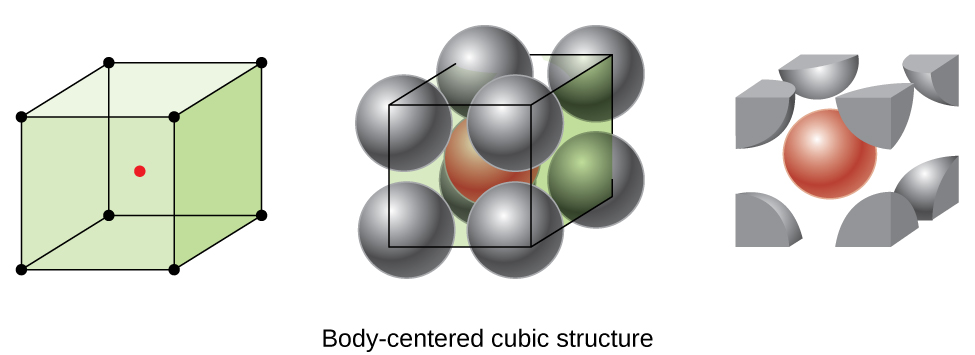
Atomi în CCA aranjamentele sunt cu mult mai eficient ambalate decât într-un simplu cubic structura, ocupând aproximativ 68% din volumul total. Metalele izomorfe cu o structură BCC includ K, Ba, Cr, Mo, W și Fe La temperatura camerei., (Se spune că elementele sau compușii care cristalizează cu aceeași structură sunt izomorfi.multe alte metale, cum ar fi aluminiu, cupru și plumb, cristalizează într-un aranjament care are o celulă unitate cubică cu atomi la toate colțurile și la centrele fiecărei fețe, așa cum este ilustrat în figura \(\PageIndex{7}\). Acest aranjament se numește solid cubic (FCC) centrat pe față., O unitate FCC celulă conține patru atomi: o optime dintr-un atom în fiecare din cele opt colțuri (\(8×\dfrac{1}{8}=1\) atom de la colțuri) și o jumătate dintr-un atom în fiecare din cele șase fețe (\(6×\dfrac{1}{2}=3\) atomii de pe fețe). Atomii din colțuri ating atomii din centrele fețelor adiacente de-a lungul diagonalelor feței cubului. Deoarece atomii sunt pe puncte de zăbrele identice, ei au medii identice.
atomii dintr-un aranjament FCC sunt împachetați cât mai strâns posibil, atomii ocupând 74% din volum., Această structură este numită și cea mai apropiată ambalare cubică (CCP). În PCC, există trei straturi repetate de atomi aranjați hexagonal. Fiecare atom contactează șase atomi în propriul strat, trei în stratul de deasupra și trei în stratul de dedesubt. În acest aranjament, fiecare atom atinge 12 în apropierea vecinilor și, prin urmare, are un număr de coordonare de 12. Faptul că aranjamentele FCC și CCP sunt echivalente poate să nu fie imediat evident, dar de ce sunt de fapt aceeași structură este ilustrat în figura \(\PageIndex{8}\).,
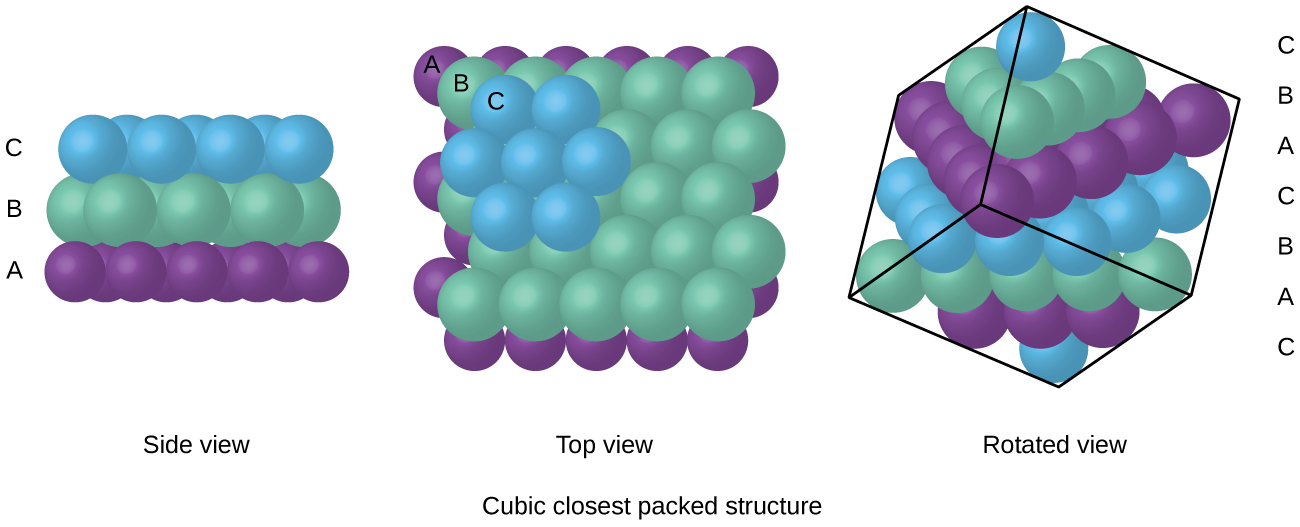
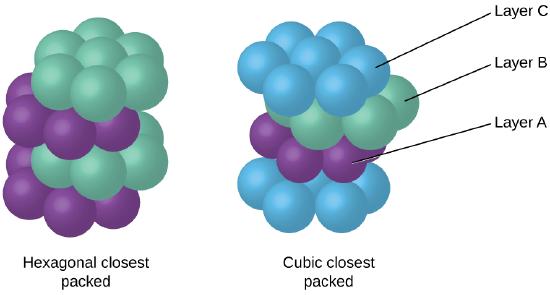
Pentru că mai aproape de ambalare maximizează general atracții între atomi și minimizează total intermoleculare de energie, atomii in cele mai multe metale pachet în acest mod., Găsim două tipuri de ambalaje cele mai apropiate în structuri cristaline metalice simple: CCP, pe care le-am întâlnit deja, și cel mai apropiat ambalaj hexagonal (HCP) prezentat în figura \(\PageIndex{9}\). Ambele constau din straturi repetate de atomi aranjați hexagonal. În ambele tipuri, un al doilea strat (B) este plasat pe primul strat (A), astfel încât fiecare atom din al doilea strat să fie în contact cu trei atomi din primul strat. Al treilea strat este poziționat într-unul din cele două moduri. În HCP, atomii din al treilea strat sunt direct deasupra atomilor din primul strat (adică.,, al treilea strat este, de asemenea, de tip A), iar stivuirea constă în alternarea straturilor de tip A și de tip B (adică ABABAB⋯). În PCC, atomii din cel de-al treilea strat nu sunt deasupra atomilor în niciunul dintre primele două straturi (adică, al treilea strat este de tip C), iar stivuirea constă în alternarea straturilor de tip A, tip B și tip C (adică ABCABCABC⋯). Aproximativ două treimi din toate metalele cristalizează în matrice cel mai apropiat ambalate cu numere de coordonare de 12., Metalele care cristalizează într-o structură HCP includ Cd, Co, Li, Mg, Na și Zn, iar metalele care cristalizează într-o structură CCP includ Ag, Al, Ca, Cu, Ni, Pb și Pt.
Exercițiu \(\PageIndex{2}\)
de Argint cristalizează în structura FCC. Lungimea marginii celulei sale este de 409 pm.
- care este raza atomică a Ag în această structură?
- calculați densitatea Ag.
Răspunde
144 pm
Răspunsul b
10,5 g/cm3
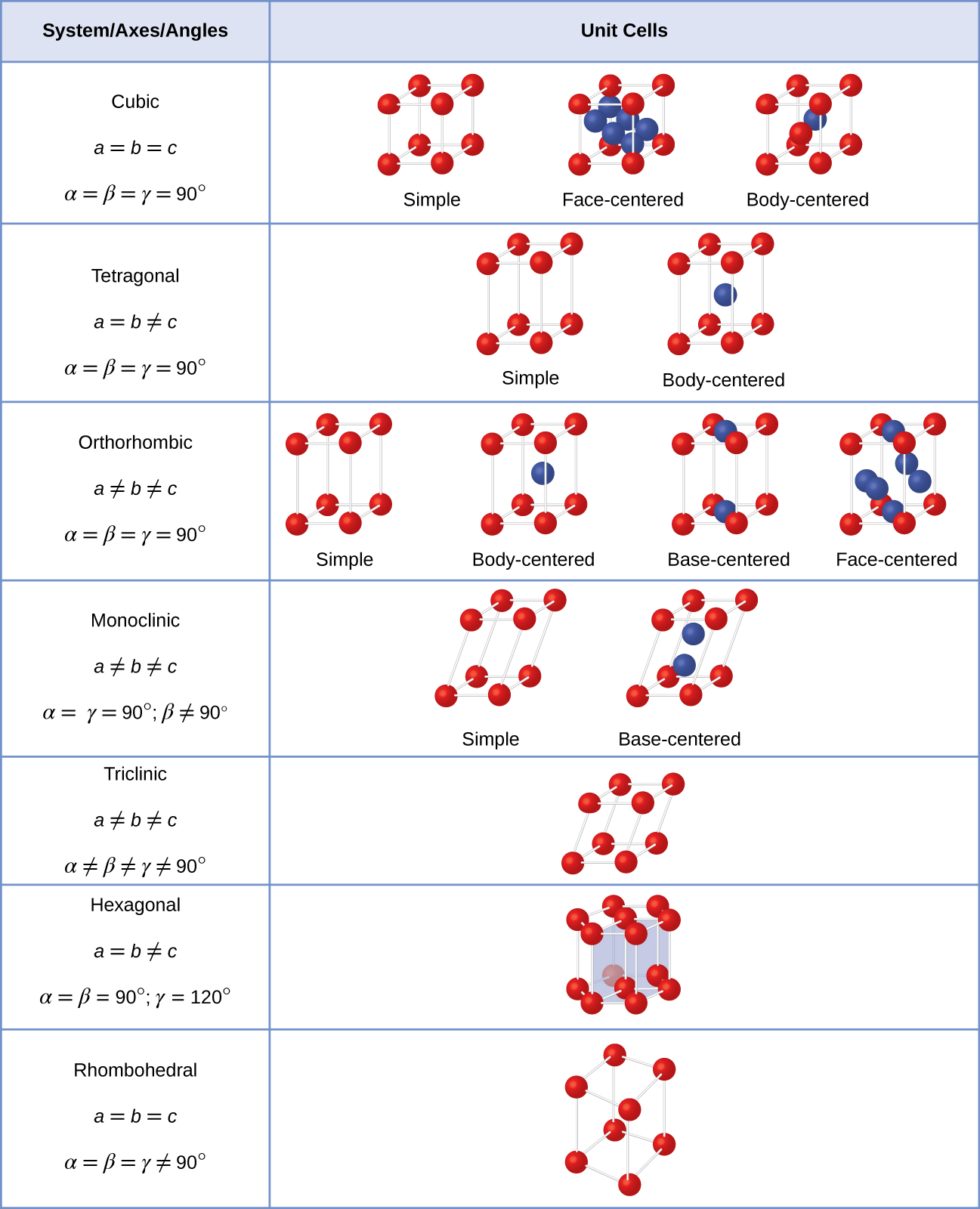
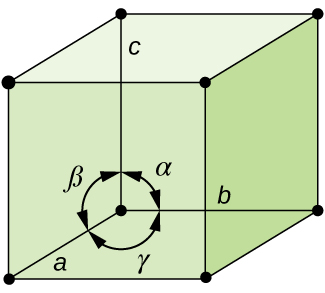
În general, o unitate de celule este definit de lungimi de trei axe (a, b, și c) și pentru unghiurile (α, β, și γ) între ele, după cum este ilustrat în Figura \(\PageIndex{10}\)., Axele sunt definite ca fiind lungimile dintre punctele din rețeaua spațială. În consecință, axele celulelor unitare unesc puncte cu medii identice.
Există șapte tipuri diferite de sisteme de grilaj, dintre care unele au mai mult de un tip de grilaj, pentru un total de paisprezece unități diferite de celule, care au forme prezentate în Figura \(\PageIndex{11}\).