6.3: configuratiei Absolute și (R) și (S) Sistem
Absolută Configurații din Perspectiva Formule
Chimiști nevoie de un mod convenabil de a distinge unul de stereoizomeri la altul. La Cahn-Ingold-Prelog sistem este un set de reguli care ne permite să definească fără echivoc stereochimice de configurare de orice stereocenter, folosind denumirile „R’ (din Latin rectus, sensul dreptaci) sau ” S ‘ (din latinescul sinister, adică stângaci)., regulile pentru acest sistem de nomenclatură stereochimică sunt, la suprafață, destul de simple.
reguli pentru atribuirea unei desemnări R / S unui centru chiral
1: atribuirea priorităților celor patru substituenți, #1 fiind cea mai mare prioritate și # 4 cea mai mică. Prioritățile se bazează pe numărul atomic.
2: trasați un cerc de la #1 la #2 la #3.
3: determinați orientarea grupului prioritar # 4. Dacă este orientat în planul paginii (departe de dvs.), mergeți la Pasul 4a. dacă este orientat în afara planului paginii (spre dvs.) mergeți la Pasul 4b.,
4a: (grupul # 4 îndreptat spre dvs.): un cerc în sensul acelor de ceasornic din partea 2 corespunde configurației R, în timp ce un cerc în sens invers acelor de ceasornic corespunde configurației S.
4b: (grupul # 4 îndreptat spre dvs.): un cerc în sensul acelor de ceasornic în partea 2 corespunde configurației S, în timp ce un cerc în sens invers acelor de ceasornic corespunde configurației R.
vom folosi gliceraldehida de zahăr 3-carbon ca primul nostru exemplu. Primul lucru pe care trebuie să-l facem este să atribuim o prioritate fiecăruia dintre cei patru substituenți legați de centrul chiral., Ne uităm mai întâi la atomii care sunt legați direct de centrul chiral: aceștia sunt H, O (în hidroxil), C (în aldehidă) și C (în grupul CH2OH).
Atribuirea de R/S de configurare pentru a gliceraldehid:

Două priorități sunt ușor: hidrogen, cu un număr atomic de 1, este cel mai mic (#4) prioritate, și hidroxil de oxigen, cu numărul atomic 8, este prioritatea #1. Carbonul are un număr atomic de 6. Care dintre cele două grupuri ” C ” este prioritatea #2, aldehida sau CH2OH?, Pentru a determina acest lucru, mutăm încă o legătură departe de centrul chiral: pentru aldehidă avem o legătură dublă cu un oxigen, în timp ce pe grupul CH2OH avem o singură legătură cu un oxigen. Dacă atomul este același, legăturile duble au o prioritate mai mare decât legăturile unice. Prin urmare, grupului Aldehidic i se atribuie prioritatea #2, iar grupului CH2OH prioritatea #3. cu prioritățile noastre atribuite, ne uităm în continuare la grupul prioritar #4 (hidrogenul) și vedem că acesta este îndreptat înapoi de la noi, în planul paginii – astfel se aplică Pasul 4a din procedura de mai sus., Apoi, urmărim un cerc definit de grupurile Prioritare #1, #2 și #3, în ordine crescătoare. Cercul este în sensul acelor de ceasornic, care prin pasul 4a ne spune că acest carbon are configurația ” R ” și că această moleculă este (R)-gliceraldehidă. Enantiomerul său, prin definiție, trebuie să fie (s)-gliceraldehidă.apoi, să ne uităm la unul dintre enantiomerii acidului lactic și să determinăm configurația Centrului chiral. În mod clar, H este substituentul #4 și OH este #1. Datorită celor trei legături cu oxigenul, carbonul din grupul acid are prioritatea # 2, iar gruparea metil are prioritatea #3., Grupul #4, hidrogenul, se întâmplă să fie desenat arătând spre noi (din planul paginii) în această figură, așa că folosim pasul 4b: cercul trasat de la #1 la #2 la #3 este în sensul acelor de ceasornic, ceea ce înseamnă că centrul chiral are configurația S.talidomida de droguri este un studiu de caz interesant – dar tragic-în importanța stereochimiei în proiectarea medicamentelor., Primul fabricat de o companie germană de droguri și prescris pe scară largă în Europa și Australia la sfârșitul anilor 1950″s ca un sedativ și remediu pentru boala de dimineata la femeile gravide, thalidomida a fost curând implicat ca cauza malformații congenitale devastatoare la copii născuți la femeile care au luat-o. Thalidomida conține un centru chiral și există astfel în două forme enantiomerice. Acesta a fost comercializat ca un amestec racemic:cu alte cuvinte, un amestec 50: 50 al ambilor enantiomeri.
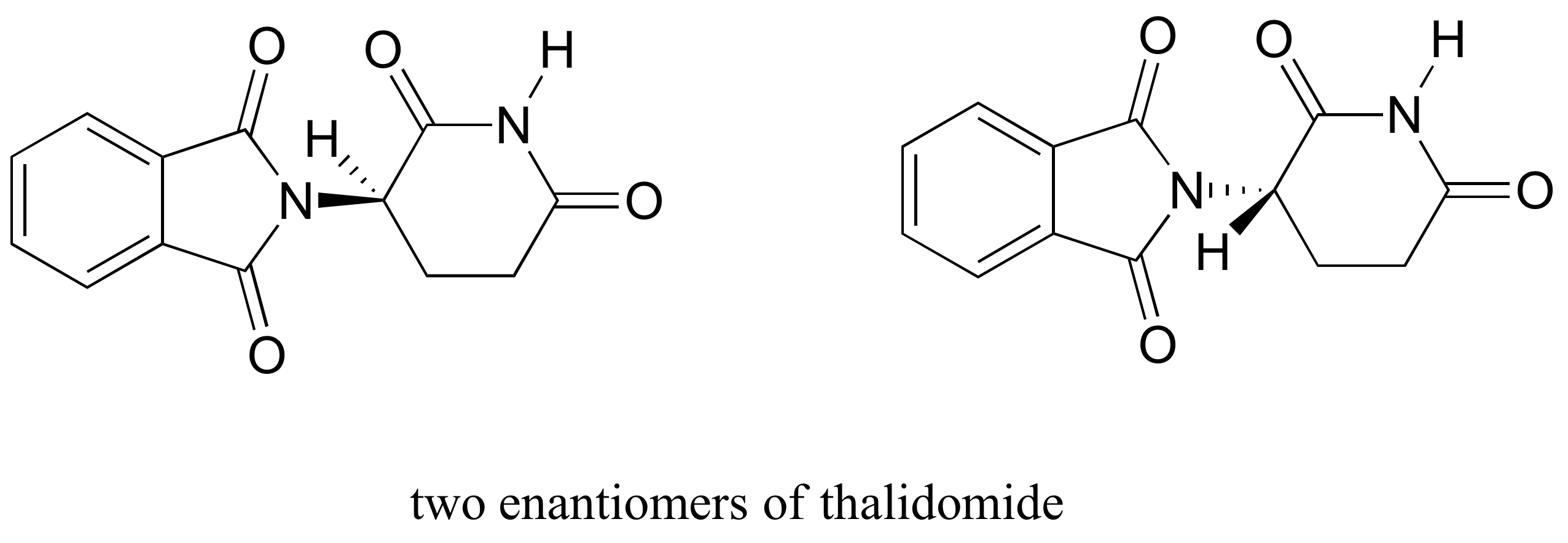
Să încercăm să determinăm configurația stereochimică a enantiomerului din stânga., Dintre cele patru legături cu Centrul chiral, prioritatea #4 este hidrogenul. Grupul de azot este #1, partea carbonilică a inelului este #2, iar partea-CH2 a inelului este #3.
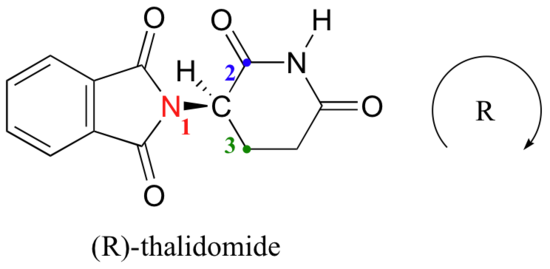
hidrogenul este arătat arătând spre noi, iar substituenții prioritizați trasează un cerc în sensul acelor de ceasornic: acesta este enantiomerul r al talidomidei. Celălalt enantiomer, desigur, trebuie să aibă configurația S.,deși oamenii de știință nu sunt încă siguri astăzi cum funcționează talidomida, dovezile experimentale sugerează că de fapt enantiomerul R a avut efectele medicale dorite, în timp ce enantiomerul S a cauzat defectele congenitale. Chiar și cu această cunoaștere, totuși, pur (R)-talidomida nu este sigură, deoarece enzimele din organism se convertesc rapid între cei doi enantiomeri – vom vedea cum se întâmplă acest lucru în capitolul 12. ca o notă istorică, talidomida nu a fost niciodată aprobată pentru utilizare în Statele Unite. Acest lucru s-a datorat în mare parte eforturilor depuse de Dr., Frances Kelsey, un ofițer de alimente și droguri care, în pericol pentru cariera ei, a blocat aprobarea sa din cauza preocupărilor sale cu privire la lipsa unor studii de siguranță adecvate, în special în ceea ce privește capacitatea medicamentului de a intra în fluxul sanguin al unui făt în curs de dezvoltare. Din păcate, însă, la acel moment studiile clinice pentru noi medicamente au implicat o distribuție pe scară largă și nereglementată către medici și pacienții lor din întreaga țară, astfel încât familiile din SUA nu au fost scutite de daunele cauzate.,foarte recent, un derivat apropiat al talidomidei a devenit legal să se prescrie din nou în Statele Unite, cu aplicarea unor măsuri stricte de siguranță, pentru tratamentul unei forme de cancer de sânge numit mielom multiplu. În Brazilia, talidomida este utilizată în tratamentul leprei – dar, în ciuda măsurilor de siguranță, copiii se nasc încă cu defecte legate de talidomidă.
Exercițiul 1.: Determinați configurațiile stereochimice ale centrelor chirale în biomoleculele prezentate mai jos.
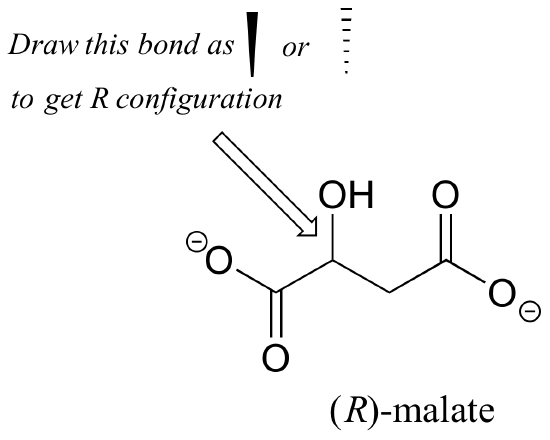
Exercițiul 2.,: În cazul în care (R) enantiomerul malatului are o pană solidă sau punctată pentru legătura C-O din figura de mai jos?
Exercițiul 3.: Folosind pene solide sau punctate pentru a arăta stereochimia, desenați enantiomerul (R) al ibuprofenului și enantiomerul (S) al 2-metileritritol-4-fosfatului (structurile sunt prezentate mai devreme în acest capitol fără stereochimie).pentru a determina configurația absolută a unui centru chiral într-o proiecție Fisher, utilizați următoarea procedură în două etape.,
Pasul 1
atribuiți numere de prioritate celor patru liganzi (grupuri) legați la Centrul chiral folosind sistemul de prioritate CIP.
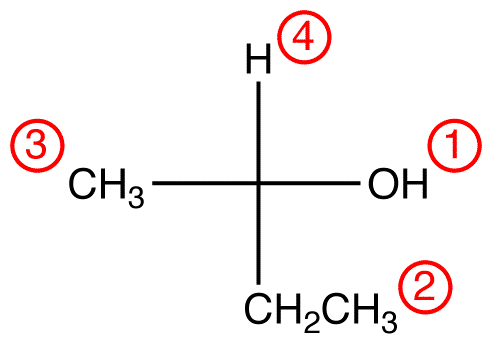
Pasul 2 – opțiunea verticală
dacă ligand-ul cu cea mai mică prioritate este pe o legătură verticală, atunci este îndreptat departe de vizualizator.urmăriți cei trei liganzi cu cea mai mare prioritate începând de la ligandul cu cea mai mare prioritate (① → ② → ③) în direcția care va da un răspuns foarte corect.

în compusul de mai jos, mișcarea este în sensul acelor de ceasornic indicând o configurație R., Numele complet IUPAC pentru acest compus este (R)-butan-2-ol.

Pasul 2 – opțiunea orizontală
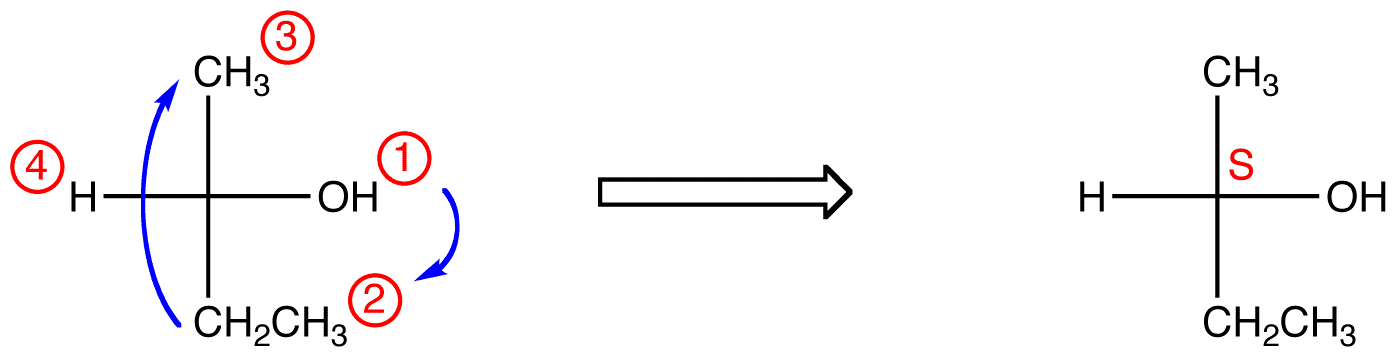
dacă ligand-ul cu cea mai mică prioritate este pe o legătură orizontală, atunci este îndreptat spre vizualizator.
urmăriți cei trei liganzi cu cea mai mare prioritate începând de la ligandul cu cea mai mare prioritate (① → ② → ③) în direcția care va da un răspuns oribil greșit. Rețineți în tabelul de mai jos că configurațiile sunt inversate din primul exemplu.,
în compusul de mai jos, mișcarea este în sensul acelor de ceasornic (R), ceea ce este oribil greșit, deci configurația reală este S. numele complet IUPAC pentru acest compus este (s)-butan-2-ol.
manipularea proiecțiilor Fischer fără modificarea configurației
o proiecție Fischer restricționează o moleculă tridimensională în două dimensiuni. În consecință, există limitări în ceea ce privește operațiile care pot fi efectuate pe o proiecție Fischer fără a schimba configurația absolută la centrele chirale., Operațiunile care nu schimbă configurația absolută la un centru chiral într-o proiecție Fischer pot fi rezumate ca două reguli.
Regula 1: rotirea proiecției Fischer cu 180º în ambele direcții fără a o ridica de pe planul hârtiei nu schimbă configurația absolută la Centrul chiral.
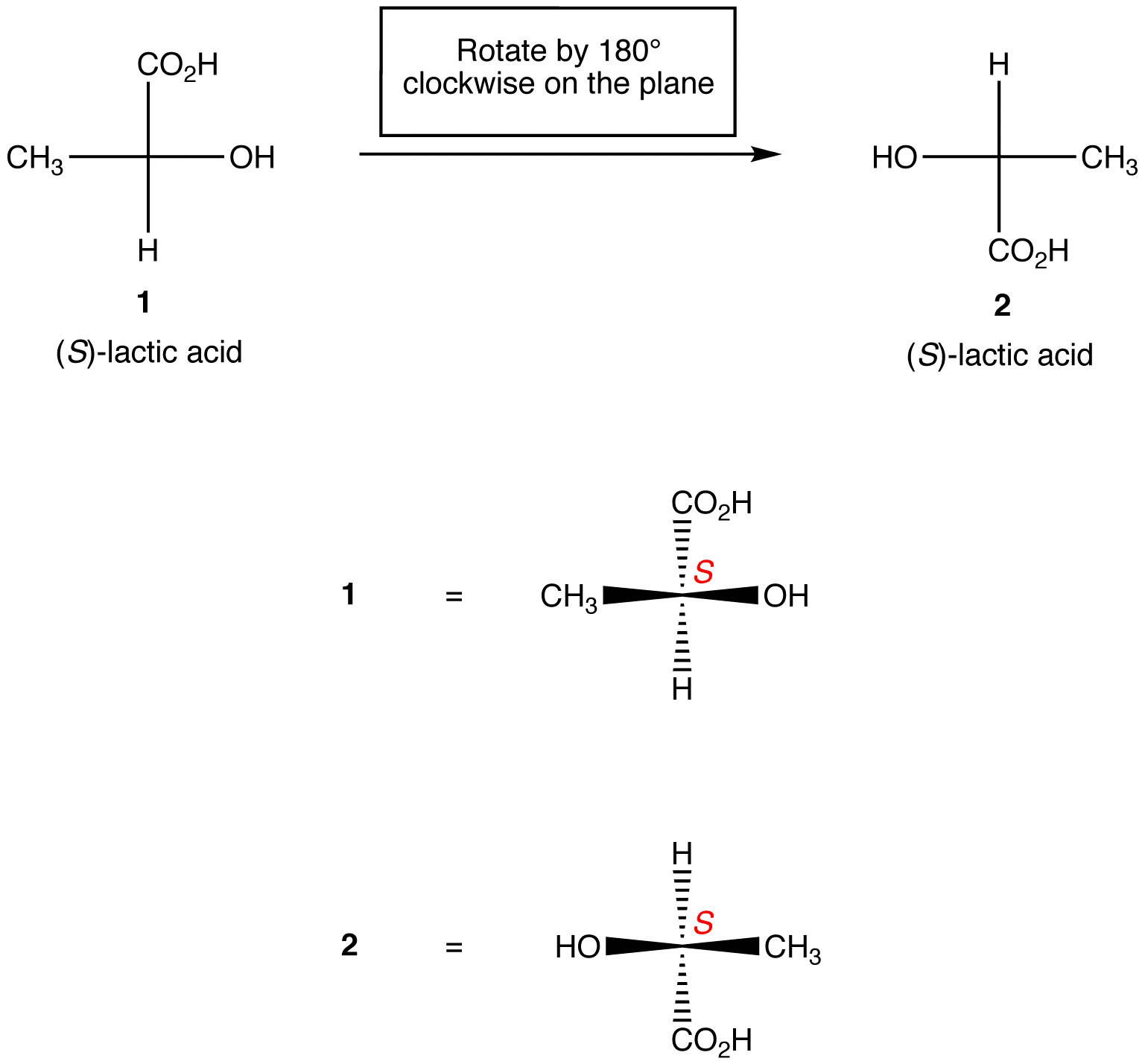
Regula 2: rotirea a trei liganzi pe centrul chiral în ambele direcții, păstrând ligandul rămas în loc, nu schimbă configurația absolută la Centrul chiral.,
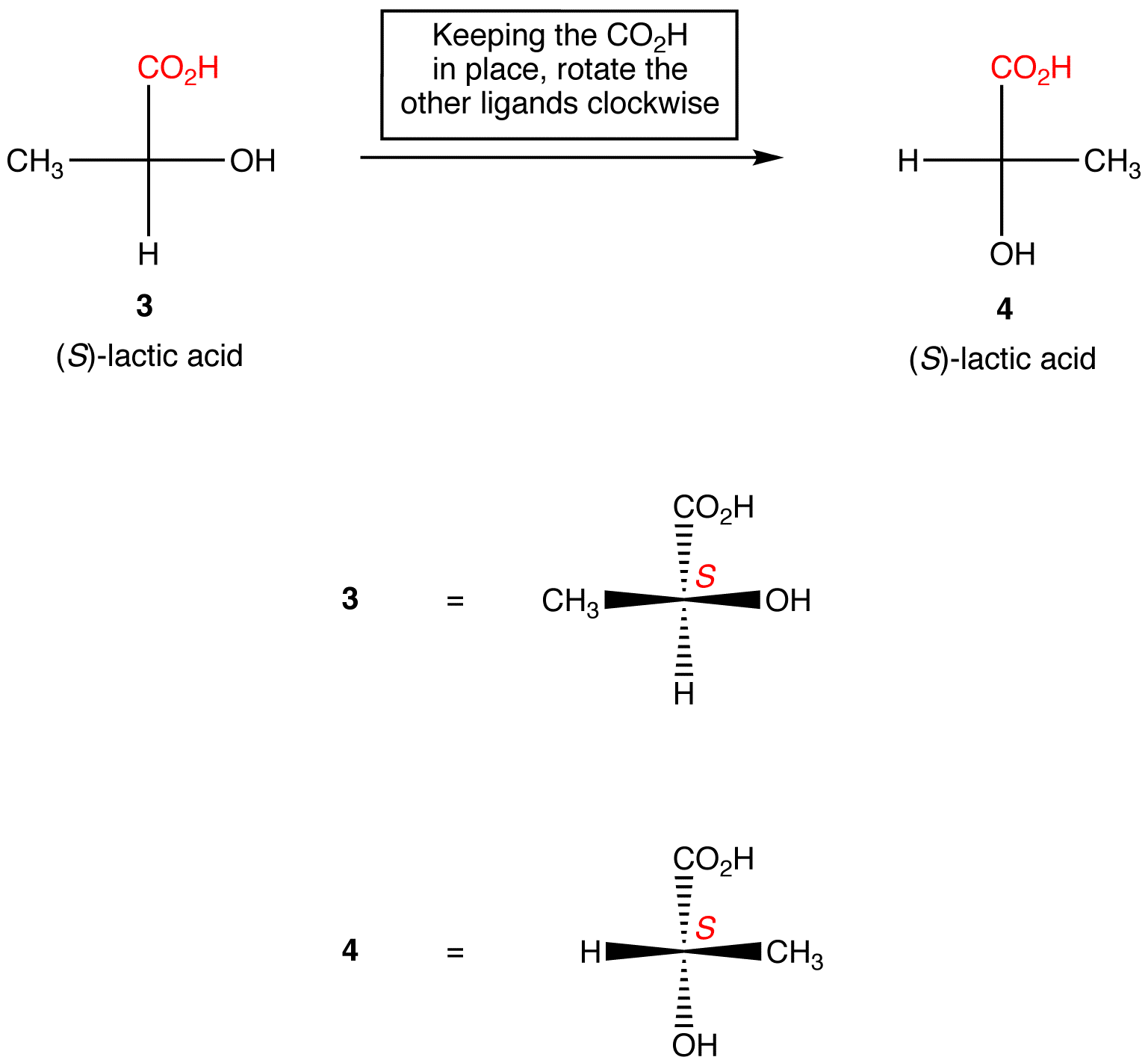
manipularea proiecțiilor Fischer cu schimbarea configurației
operațiile care schimbă configurația absolută la un centru chiral într-o proiecție Fischer pot fi rezumate ca două reguli.
Regula 1: rotirea proiecției Fischer cu 90º în ambele direcții schimbă configurația absolută la Centrul chiral.
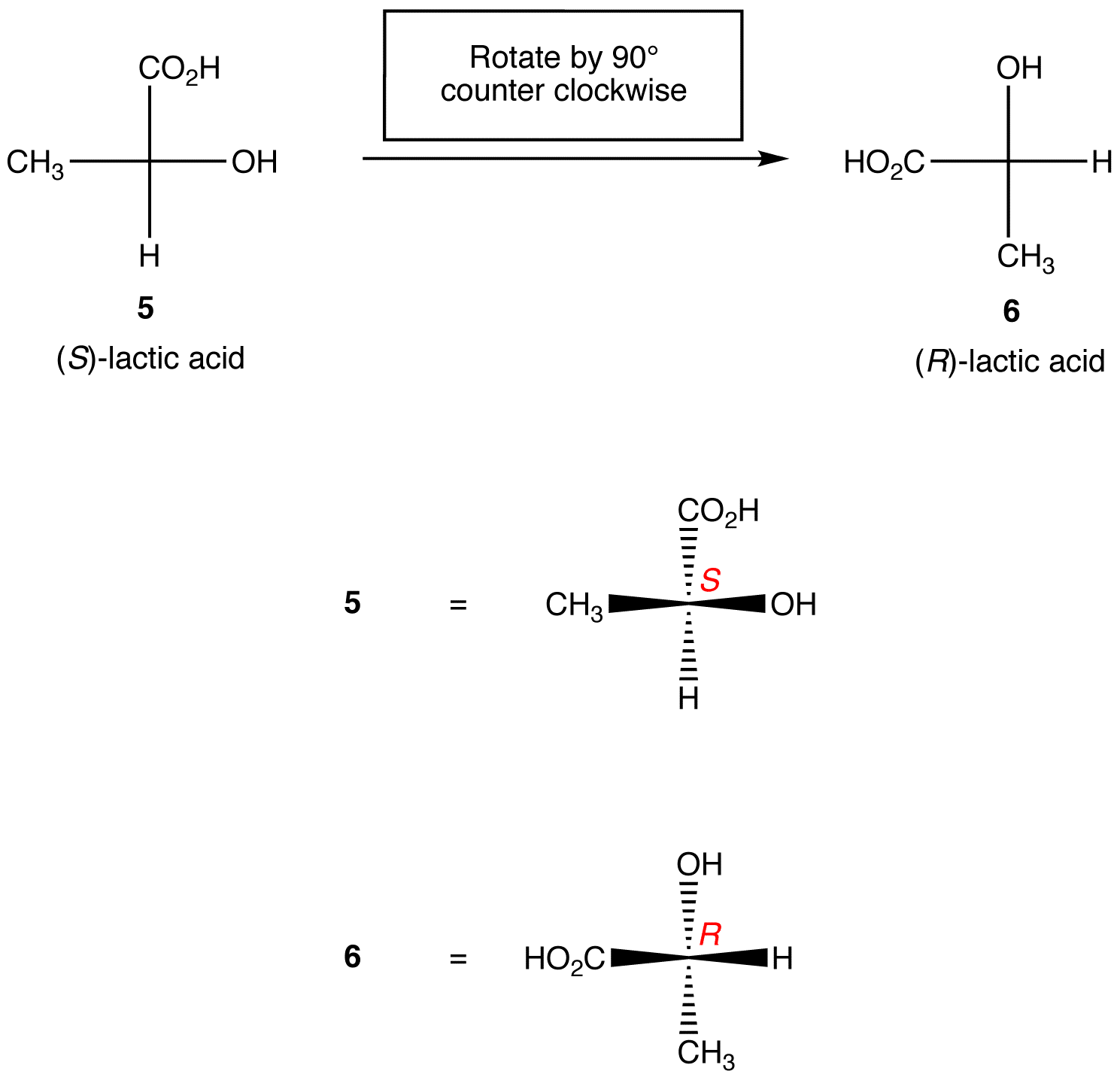
Regula 2: schimbarea oricăror doi liganzi pe centrul chiral schimbă configurația absolută la Centrul chiral.,
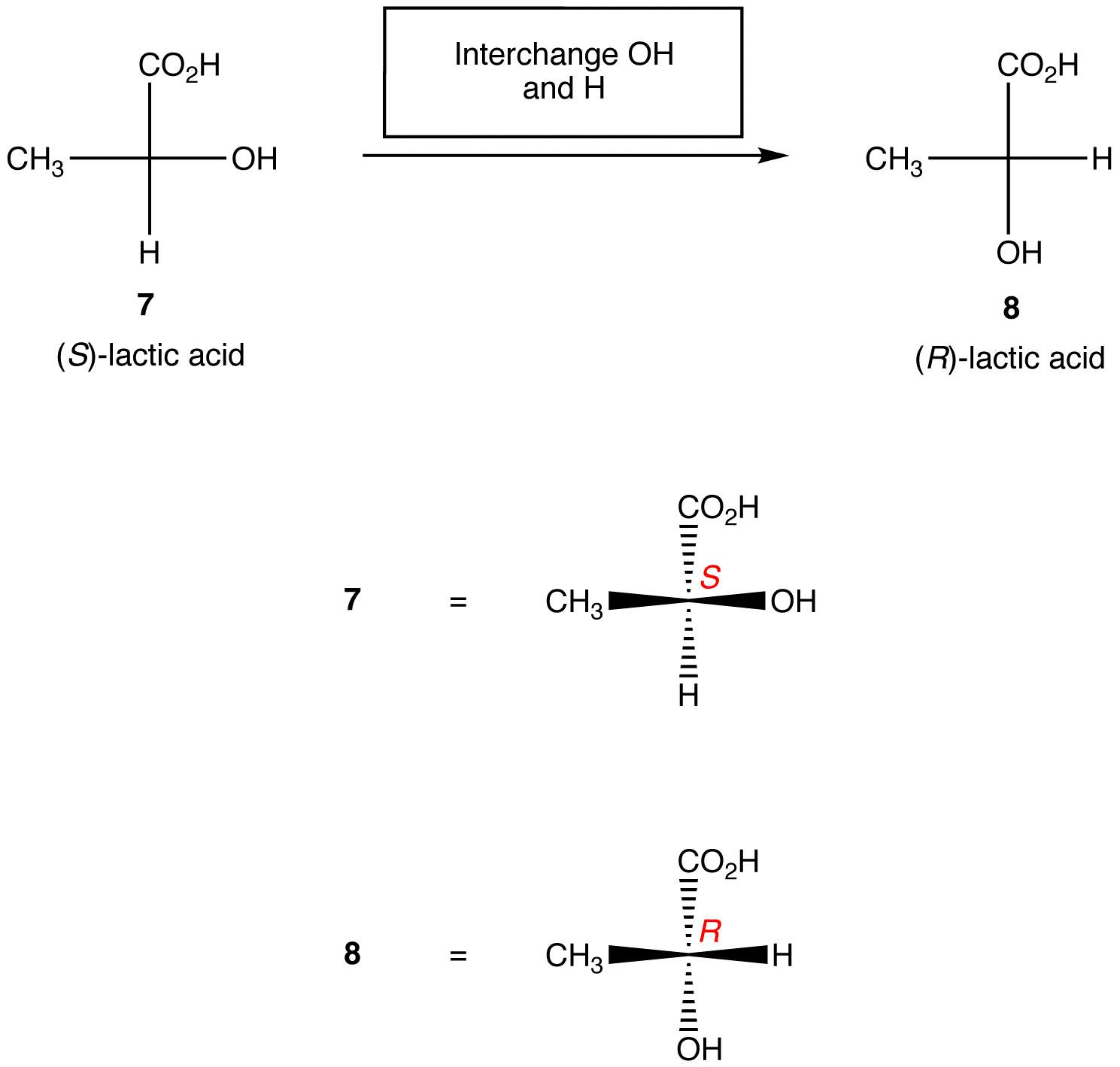
regulile de mai sus presupun că proiecția Fischer luată în considerare conține un singur centru chiral. Cu toate acestea, cu grijă, ele pot fi aplicate proiecțiilor Fischer care conțin orice număr de centre chirale.
Exercițiul 1
clasificați următorii compuși ca R sau s?
Soluție
- S: I > Br > F > H. Cea mai mică prioritate substituent, H, este deja o spre spate., Se pare părăsit merge de la I la Br la F, astfel încât acesta”s o S.
- R: Br > Cl > CH3 > H. Aveți pentru a comuta H și Br, în scopul de a plasa H, cea mai mică prioritate, în spate. Apoi, trecând de la Br la Cl, CH3 se întoarce spre dreapta, oferindu-vă un R.
- nici R sau S: această moleculă este achirală. Numai molecule chirale poate fi numit R sau S.
- R: OH > NC > CH2NH2 > H. H, cea mai mică prioritate, trebuie să fie trecut la spate., Apoi, mergând de la OH la CN pentru a CH2NH2, vă sunt de cotitură la dreapta, oferindu-vă un R.
- (5) S: \(\ce{-COOH}\) > \(\ce{-CH_2OH}\) > \(\ce{C#CH}\) > \(\ce{H}\). Apoi, mergând de la \(\ce {- COOH}\) la \(\ce{-CH_2OH}\) la \(\ce{-c#CH}\) virați la stânga, oferindu-vă o configurație S.
exerciții
6. Orientați următoarele astfel încât cel mai mic atom de prioritate (4) să fie în urmă, apoi atribuiți stereochimia (R sau S).

7. Desenați (R)-2-brombutan-2-ol.
8., Atribuiți R / S următoarei molecule.
.png?revision=1)
Soluții

O = S; B = R
8. Stereo centru este R.
Alte Resurse
Kahn Academy tutorial video pe R-S sistem de denumire
- Schore și Vollhardt. Structura și funcția chimiei organice. New York:W. H. Freeman and Company, 2007.
- McMurry, John și Simanek, Eric. Bazele chimiei organice. A 6-a Ed. Brooks Cole, 2006.,
Contribuabili și Atribuții
- Ekta Patel (UCD), Ifemayowa Aworanti (Universitatea din Maryland, Baltimore County)
- Chimia Organică Cu o Biologică Accent de Tim Soderberg (Universitatea din Minnesota, Morris)