Terapia combinată în neonatală hipoxic-ischemică encefalopatie | Anales de Pediatría (Ediție în limba engleză)
Introducere
Cu o incidență de 1-3 cazuri la 1000 la termen, nasteri,1 hipoxico-ischemice perinatale (HIE) este una dintre cele mai frecvente cauze de leziuni ale creierului la nou-nascuti. Având în vedere numărul tot mai mare de nașteri cu risc ridicat din cauza tendințelor crescânde ale vârstei materne și a frecvenței sarcinilor multiple, printre alți factori, HIE continuă să fie o problemă relevantă în mediul spitalicesc pentru care nu există încă o soluție definitivă.,cercetările privind fiziopatologia asfixiei perinatale ne-au permis să înțelegem procesul complex care are loc la nivel celular și țesut, pe măsură ce leziunile cerebrale se dezvoltă din cauza lipsei de oxigen. Multe dintre mecanismele implicate de vătămare sunt grupate pe baza calendarului scurs pentru dezvoltarea lor și au fost descrise 4 faze principale (Fig. 1): faza primară sau episodul acut de ischemie hipoxică (IH), faza latentă, faza secundară și faza terțiară., În faza primară, deteriorarea provine dintr-o reducere a livrării de oxigen către celule și țesuturi, ceea ce duce la eșecul energiei primare. Aceasta este urmată de o recuperare aparentă a nivelurilor compușilor fosforilați cu energie înaltă, cunoscuți sub numele de faza latentă., Cu toate acestea, această îmbunătățire este doar temporară și dă loc fazei secundare, când intră în joc Multe dintre mecanismele patofiziologice implicate în dezvoltarea leziunilor cerebrale la nou-născuți, dintre care șef sunt excitotoxicitatea, un aflux masiv de ioni de calciu în celule, stresul oxidativ, inflamația și, în majoritatea cazurilor, moartea celulară datorată necrozei sau apoptozei. În cele din urmă, faza terțiară se caracterizează prin persistența leziunilor cerebrale la săptămâni, luni sau chiar ani după insultă hipoxic-ischemică inițială.,înțelegerea fiziopatologiei de bază a HIE a permis identificarea potențialelor ținte terapeutice care ar putea ajuta la reducerea leziunilor cerebrale cauzate de asfixie și la dezvoltarea a numeroase strategii de tratament. Unele dintre aceste tratamente, aflate în prezent în studii, sunt menite să funcționeze sinergic cu hipotermia terapeutică, singurul tratament împotriva HIE care a fost adoptat în general în cadrul terapiei intensive neonatale.,
hipotermia
hipotermia a început să fie utilizată ca strategie neuroprotectivă la sugari după descoperirea unui mecanism endogen de răcire care sa manifestat la sugarii care au suferit un anumit tip de leziune în timpul nașterii.2 efectele sale neuroprotectoare sunt în principal legate de scăderea activității metabolice a creierului, de 5% cu fiecare scădere a temperaturii de 1°C,3 care modulează unele dintre căile metabolice dăunătoare declanșate de asfixie, care sunt rezumate în Fig. 2.
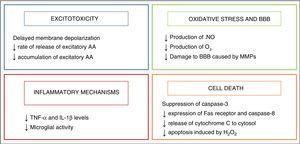
efectul hipotermiei asupra mecanismelor de afectare a creierului.
Combinație de terapie
Deoarece dovezile sugerează că actuala hipotermie protocoale sunt optimal4 încă sunt de o eficacitate limitată în practica clinică,5 trebuie să se extindă sunt arsenalul terapeutic pentru managementul ILIE.,6 cercetările recente s-au concentrat pe dezvoltarea și implementarea tratamentelor care pot fi utilizate în combinație cu hipotermia, concepute pentru a acționa la diferite niveluri ale cascadei fiziopatologice și pentru a promova sinergia ambelor terapii (Fig. 3).

Melatonina
Melatonina (N-acetil-5-metoxitriptamina) este un neurohormonul sintetizat de glanda pineala a căror secreție urmează o noapte/zi de ciclu și al cărui rol principal este în reglarea ritmului circadian. Aspectele cheie care permit utilizarea sa în gestionarea HIE sunt activitatea sa puternică antioxidantă și antiinflamatoare7 și capacitatea sa de a traversa bariera hemato-encefalică și de a ajunge la sistemul nervos central.,8
înainte de a fi încercat la nou-născuți, s-a dovedit că melatonina crește nivelul de protecție oferit de hipotermie prin optimizarea metabolismului energetic al creierului într-un model de asfixie a purceilor.9 în cadrul clinic, un studiu publicat de Aly și colab.10 a alocat jumătate din nou-născuții asfixiați la hipotermie și 5 doze de 10 mg/kg/zi de melatonină administrate pe cale orală., Autorii au descoperit o reducere a nivelurilor serice de superoxid dismutază și oxid nitric la pacienții tratați cu terapie combinată comparativ cu cei tratați numai cu răcire, demonstrând astfel efectele benefice ale combinării ambelor strategii împotriva stresului oxidativ.un studiu recent realizat de Balduini și colab., pentru a evalua siguranța, farmacocinetica, doza și eficacitatea de melatonina folosit în combinație cu hipotermie a constatat că răcire nu a afectat farmacocinetica melatonin11 și că a fost posibil să se obțină concentrații plasmatice mari de hormon administrarea de doze care au fost mai mici comparativ cu cele utilizate în modele experimentale. În prezent, studiul clinic MELPRO (NCT03806816) recrutează pacienți, vizând un eșantion de 100 de nou-născuți., Acest lucru și alte studii similare sunt indispensabile pentru dezvoltarea viitoare a studiilor clinice de fază III și utilizarea ulterioară a melatoninei în practica clinică de zi cu zi.motivul pentru utilizarea alopurinolului în gestionarea HIE este efectul său inhibitor asupra xantin oxidazei, o enzimă implicată în stresul oxidativ. În plus, acest medicament acționează ca un chelator de fier liber și sechestrează radicalii hidroxil.,12,13 a studiului preclinic la puii de șobolan în cazul în care animalele au fost alocate 1 din 5 grupuri (grupul de control, HI, lotul tratat cu hipotermie, grupul tratat cu alopurinol și grupul tratat cu terapie combinată) a constatat că 72 de ore după HI insultă, o combinație de terapie de grup expuse cele mai mici volumului infarctului.,14
Când e vorba de caracteristicile sale farmacologice, alopurinol poate de repede traversa placenta și atinge concentrații terapeutice la nou-nascuti, cum s-a demonstrat într-un studiu efectuat pe femeile gravide care au primit 500 mg alopurinol intravenos, cu dovezi de nivelurile optime de alopurinol 5min mai târziu, în cordonul ombilical probe de sânge.15 Un studiu realizat de van Bel și colab., în 1998, care a analizat potențialul său efect antioxidant la nou-născuții asfixiați cu HIE severă, a constatat că administrarea intravenoasă de 40 mg/kg de alopurinol a obținut o reducere a formării radicalilor liberi.13 Cu toate acestea, un studiu realizat ulterior de Benders et al. în 2006 nu a găsit diferențe între grupul tratat cu alopurinol și grupul de control.16 în concluzii, acești autori au identificat severitatea extremă a HIE la nou-născuții incluși în eșantion ca o posibilă explicație pentru lipsa diferențelor semnificative., De asemenea, au emis ipoteza că perioada care a trecut la administrarea de alopurinol (3–4h după reperfuzie) ar fi putut fi prea lungă pentru a obține rezultate favorabile. În legătură cu acest din urmă punct, Gunes și colab. administrat aceeași doză de alopurinol administrat în 2 studii anterioare, dar în termen de 2 ore de la naștere, și a constatat îmbunătățiri în rezultatele neurodevelopmental în grupul de tratament.,17 de-a Lungul aceleași linii, administrarea intravenoasă a alopurinol pentru mame în timpul nașterii de feți cu hipoxie sau hipoxie incipientă a crescut eficacitatea tratamentului, reducerea cordonul ombilical nivelurile de proteine S-100β, care este un marker de leziuni ale creierului.18 Un studiu clinic sub numele de Efect de Alopurinol pentru Hipoxic-ischemice Cerebrale Prejudiciu pe Neurocognitive Rezultatul (NCT03162653) este în prezent în curs de desfășurare pentru a evalua potențialele efecte terapeutice de administrare a acestui inhibitor al enzimei în primele minute după naștere.,
eritropoietina
eritropoietina (EPO) este o citokină care măsoară 30, 4 kDa sintetizată de ficat în viața fetală și după naștere de rinichi și creierul în curs de dezvoltare, unde acționează ca factor de creștere și agent neuroprotector.19 utilizarea atât a OEB și uman recombinant EPO (rhEPO) în HIE se bazează pe activitatea sa, prin angajarea de EPO receptorii prezente în neuroni și celulele gliale,20 ca un puternic antiapoptotic agent (stimularea transcriere a antiapoptotic genele BCL-2 și BCL-XL), și ca un anti-inflamator și antioxidant.,19,21 pe lângă efectul său neuroprotector, EPO poate promova procese de reparare pe termen lung, cum ar fi angiogeneza, oligodendrogeneza și neurogeneza.22,23
studiile preclinice care au evaluat efectul sinergic al combinării administrării EPO sau rhEPO cu hipotermia au dat rezultate contradictorii. Într-un model similar de șobolan de leziuni cerebrale hipoxic-ischemice în ziua 7 post naștere, Fang și colab. nu s-au găsit efecte neuroprotectoare semnificative ale utilizării lor combinate.24 cu toate acestea, într-un alt studiu realizat de Fan et al.,, 25 autorii au observat un efect benefic ușor asupra funcției senzorimotorii la puii de șobolan, deși această diferență nu a fost reflectată în caracteristicile histologice ale probelor de țesut cerebral.studiile la nou–născuții cu HIE au arătat că utilizarea rhEPO este sigură la doze de 300-2500 UI/kg. Dozele mici de rhEPO s-au dovedit eficace la pacienții cu leziuni moderate și par să fie asociate cu un risc scăzut de invaliditate sau deces.26 doze mai mari (de până la 2500 UI/kg) pot reduce incidența convulsiilor și a anomaliilor neurologice la 6 luni.,27
Azi, trei studii clinice de fază III sunt în curs de desfășurare cu o planificate de recrutare dintr-un total de 840 de nou-născuți pentru a evalua siguranța și eficacitatea unor doze mari de EPO (1000IU/kg), combinate cu hipotermie (Eritropoietina pentru Hipoxic Ischemică, Encefalopatie la nou-Nascuti, NCT03079167; doze de Eritropoietină de Asfixie și Encefalopatie, NCT02811263; Eritropoietină în Gestionarea Neonatală Hipoxic Ischemice perinatale, NCT03163589). Scopul principal al primului 2 este de a reduce mortalitatea sau dizabilitatea de 2 ani, în timp ce al treilea va evalua aceste două rezultate după 1 an., Așteptăm rezultatele acestor studii și ale altor studii pentru a determina dacă EPO sau oricare dintre derivații săi sunt eficienți și modul în care trebuie utilizați în practica clinică, evaluând factori precum doza minimă eficientă, calea de administrare, durata tratamentului etc.
celule Stem
utilizarea celulelor stem pentru tratamentul tuturor tipurilor de boli, inclusiv HIE, este un domeniu de cercetare care continuă să crească., Această abordare terapeutică ar putea ajuta la repararea și regenerarea țesutului cerebral deteriorat după insulta hipoxico-ischemică prin interacțiunea celulelor stem cu celulele imune în organe îndepărtate de creier, cum ar fi splina, modificând astfel răspunsul imun/inflamator. În mod similar, recuperare funcțională realizat cu administrarea lor poate fi parțial explicat prin interacțiunea dintre celulele transplantate și țesutul cerebral, cu care a urmat producția de factori de creștere a căror efect final se va reflecta în creșterea neurogeneza și proliferarea celulară.,deși mai trebuie să ne aprofundăm cunoștințele pentru a putea folosi celulele stem ca terapie eficientă, studiile experimentale pe animale au demonstrat că diferite tipuri de celule stem sunt capabile să supraviețuiască în creierul deteriorat, să se diferențieze în neuroni sau glia, să se integreze în țesutul țintă și să modifice favorabil rezultatele comportamentale (revizuite în Bennet et al.28)., Studii recente au raportat că administrarea de celule stem mezenchimale, combinate cu 24h de răcire la puii de șobolan 7 zile după naștere a obținut rezultate mai bune față să fie un tratament în mod izolat,29 și, de asemenea, au constatat că hipotermia se extinde terapeutice fereastra de timp pentru administrarea de celule stem mezenchimale până la 2 zile după hipoxic-ischemică eveniment.,30 În plus, celulele stem pot reglarea răspunsului imun prin interacțiunile lor cu celulele imune efectoare situat în organe îndepărtate din creier, cum ar fi splina, a căror mobilizare este cunoscut de a avea potențialul de a exacerba răspunsul inflamator și leziuni ischemice în creierul imatur, îmbunătățindu-le astfel efect neuroprotector.,31,32
terapia cu celule Stem, singur sau în combinație cu hipotermie, este un domeniu promițător de cercetare care necesită încă studii clinice pentru a determina, printre alte aspecte, cel mai eficient tip de celule stem și doza optimă și durata tratamentului pentru a obține cele mai bune rezultate de tratament.,28 Unul dintre proiectele-ului privat în curs de desfășurare în faza de recrutare (Studiu de hCT-MSC la Nou-născuți Cu Moderată sau Severă ILIE, NCT03635450) va include 6 copii nascuti la o varsta gestationala de 36 sau mai multe săptămâni, cu moderată până la severă, HIE să fie tratați cu hipotermie și 2 doze intravenoase de celulele stromale mezenchimale derivate din tesutul cordonului ombilical (hCT-MSC). Principalele obiective ale acestui studiu de fază I sunt evaluarea siguranței hCT-MSC și analizarea rezultatelor supraviețuirii și neurodezvoltării la participanți la 6 și respectiv 16 luni., Un alt studiu de fază I (NCT00593242) a obținut rezultate promițătoare cu transplant autolog de sânge din cordonul ombilical celule, cu 74% din nou-născuții care au primit celule stem supraviețuitor cu zeci de 85 sau mai mare în Bayley scale în comparație cu 41% din nou-născuți tratați cu răcire singur.33
N-acetilcisteina
N-acetilcisteina (NAC) este un precursor al cisteinei care elimină radicalii liberi și este implicată în menținerea glutationului,34 reglând astfel stresul oxidativ., Dovezile provenite de la modelele animale au arătat o reducere mai mare a volumului infarctului cerebral la animalele tratate cu o combinație de NAC și hipotermie, comparativ cu animalele tratate doar cu una dintre aceste intervenții. De asemenea, animalele tratate cu terapie combinată au arătat rezultate similare în reflexe și substanță albă daune celor din grupul de control.35 deoarece administrarea sa în timpul sarcinii nu are efecte teratogene și poate traversa placenta,36 NAC a ajuns să fie considerat unul dintre cei mai promițători agenți terapeutici pentru utilizare ulterioară în unitățile de terapie intensivă neonatală., Cu toate acestea, din cunoștințele noastre nu au fost concepute până în prezent studii clinice pentru a evalua utilizarea sa în managementul HIE, iar dovezile disponibile sunt limitate la studii legate de inflamația intra-amniotică, corioamnionita sau sindromul de detresă respiratorie.gazele nobile gazele nobile precum xenonul și radonul au prezentat efecte neuroprotectoare la modelele animale de HI neonatal. Numeroase studii au analizat posibilitatea utilizării xenonului ca agent terapeutic (pentru o revizuire a dovezilor, a se vedea articolul lui Lobo et al.,37) datorită capacității sale de a reduce excitotoxicitatea după o insultă HI prin modularea receptorilor de glutamat NMDA.38,39
multicentric Totală a Corpului hipotermie plus Xenon (TOBY-Xe) folosit gaz xenon in combinatie cu hipotermie într-un eșantion de 92 de sugari născuți între 36 și 43 de săptămâni de gestație., Deși nu a găsit diferențe semnificative între grupuri,de 40 de ani, cu scopul de a obține informații mai detaliate asupra unor variabile care ar putea avea un impact asupra rezultatelor de tratament cu acest gaz nobil, cum ar fi doza sau durata, un studiu clinic de fază II este în prezent în curs de desfășurare (CoolXenon3 Studiu, NCT02071394).,pe de altă parte, nu au existat studii clinice cu argon până în prezent, dar sa demonstrat că argonul îmbunătățește rezultatele răcirii în ceea ce privește nivelurile markerului N-acetil-aspartat/lactat, care a fost asociat cu creșterea valorilor medii ale morții celulare și dezvoltarea sechelelor neurologice la nou-născuții afectați.41 aceste rezultate promițătoare, împreună cu biodisponibilitatea sa mai mare și costul mai mic în comparație cu xenonul, fac din argon o moleculă cu un potențial ridicat de traducere de la bancă la noptieră în tratamentul HIE.,realizarea unui tratament eficient pentru HIE este una dintre marile provocări cu care se confruntă medicina modernă. Din acest motiv, s-au făcut eforturi substanțiale de ani de zile pentru a analiza mecanismele care duc la deteriorarea celulelor cerebrale după asfixia perinatală, cu scopul de a dezvolta tratamente eficiente pentru a le bloca. În prezent, pediatrii și neurologii încearcă să dezvolte noi compuși care ar putea lucra în sinergie cu hipotermia, cu scopul de a reduce la minimum sechelele neurologice ale HIE., Pe de altă parte, studii recente au început să includă sex dintre variabile să ia în considerare în managementul de HIE, ca dimorfism sexual s-au constatat diferențe atât în mecanismele de prejudiciu (pe modele experimentale, animale de sex feminin au prezentat mai mari deficite de memorie, în timp ce masculii au arătat o mai mare susceptibilitate la stres oxidativ), și în căile de tratamente diferite în considerare., În ciuda progreselor promițătoare făcute cu utilizarea melatoninei sau a compușilor precum EPO, sunt încă necesare studii preclinice pentru a elucida în continuare mecanismele de acțiune ale acestor molecule și sunt necesare studii clinice cu probe mai mari pentru a determina doza optimă și căile de administrare a acestor și a altor tratamente.studiul a fost susținut printr-un grant acordat de UPV/EHU ca parte a programului de finanțare a grupului de cercetare al Universității (GIU 17/018).
conflicte de interese
autorii nu au conflicte de interese de declarat.