10.6: Gitterstrukturer i kristallina fasta ämnen
enhetsceller av metaller
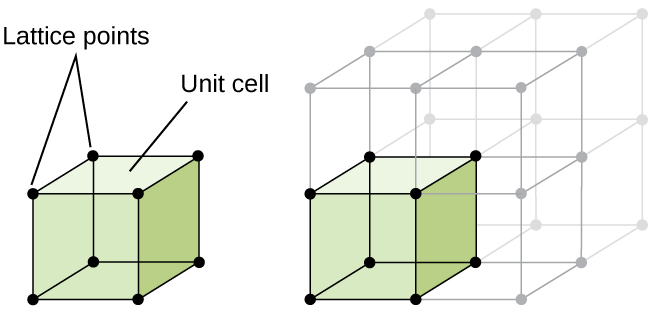
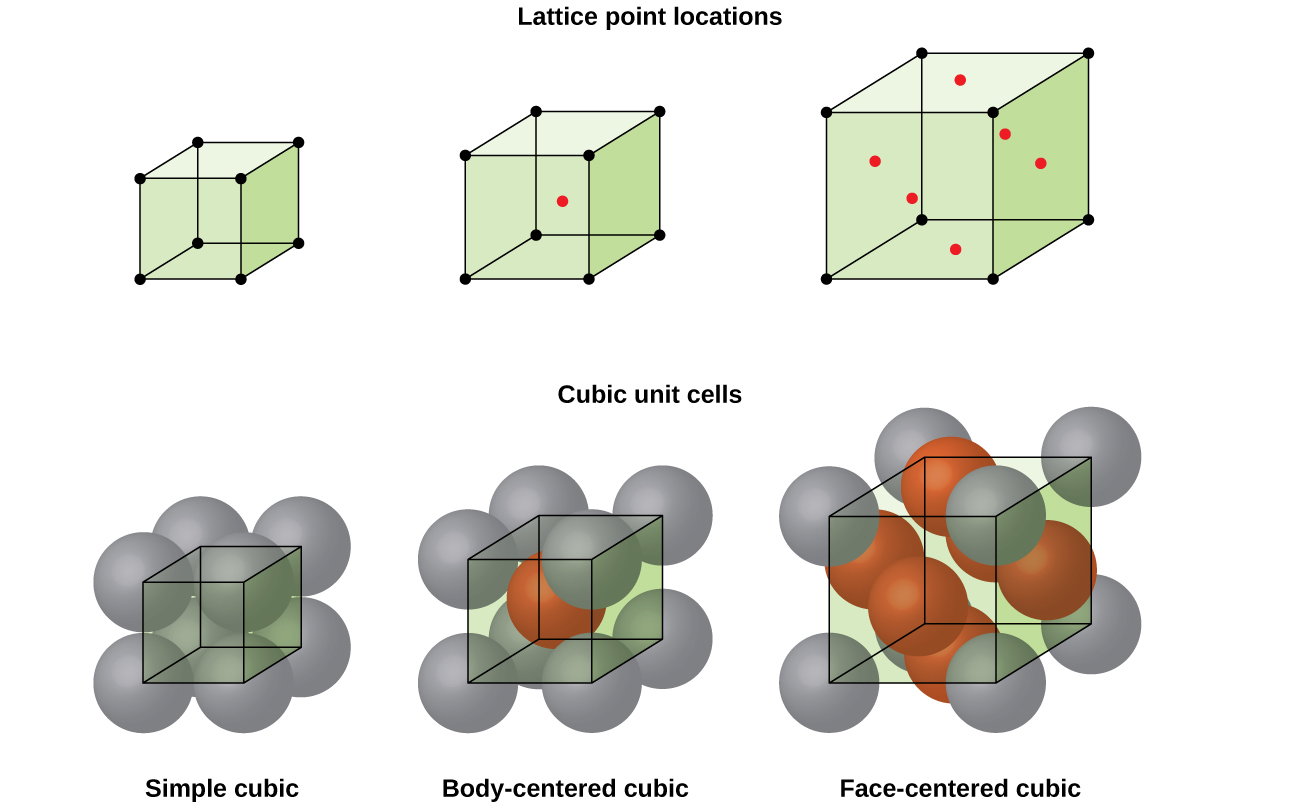
strukturen hos ett kristallint fast ämne, oavsett om det är en metall eller inte, beskrivs bäst genom att överväga dess enklaste repeterande enhet, som kallas dess enhetscell. Enhetscellen består av gitterpunkter som representerar platserna för atomer eller joner. Hela strukturen består sedan av den här enhetscellen som upprepas i tre dimensioner, som illustreras i Figur \(\PageIndex{1}\).,
låt oss börja vår undersökning av kristallgitterstruktur och enhetsceller med den enklaste strukturen och den mest grundläggande enhetscellen. För att visualisera detta, tänk dig att ta ett stort antal identiska sfärer, såsom tennisbollar, och ordna dem jämnt i en behållare., Det enklaste sättet att göra detta skulle vara att göra lager där sfärerna i ett lager ligger direkt ovanför dem i lagret nedan, som illustreras i Figur \(\PageIndex{2}\). Detta arrangemang kallas enkel kubisk struktur,och enhetscellen kallas den enkla kubiska enhetscellen eller primitiva kubiska enhetscellen.
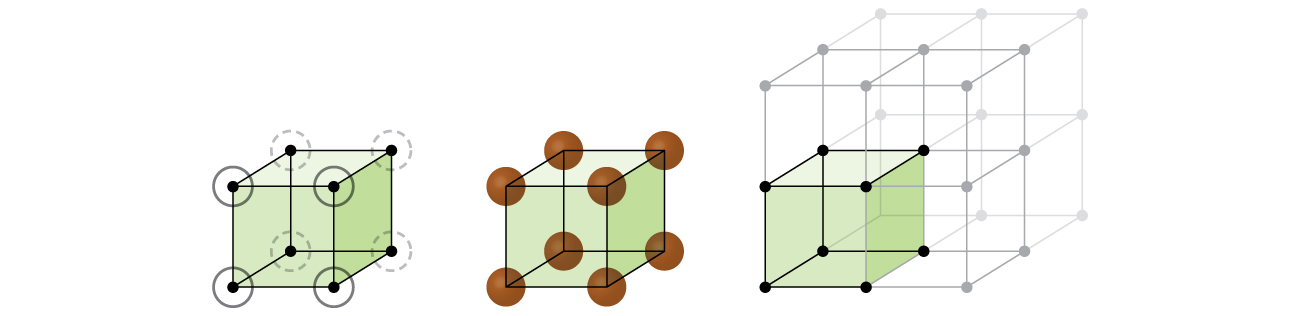
i en enkel kubisk struktur packas inte sfärerna så nära som de kunde vara, och de” fyller ” bara om 52% av behållarens volym. Detta är ett relativt ineffektivt arrangemang, och endast en metall (polonium, Po) kristalliserar i en enkel kubisk struktur. Som visas i Figur \(\PageIndex{3}\) består ett fast ämne med denna typ av arrangemang av plan (eller lager) där varje atom endast kontaktar de fyra närmaste grannarna i sitt lager; en atom direkt ovanför det i skiktet ovan; och en atom direkt under det i skiktet nedan., Antalet andra partiklar som varje partikel i en kristallin fasta kontakter är känd som dess koordinationsnummer. För en poloniumatom i en enkel kubisk array är koordinationsnumret därför sex.

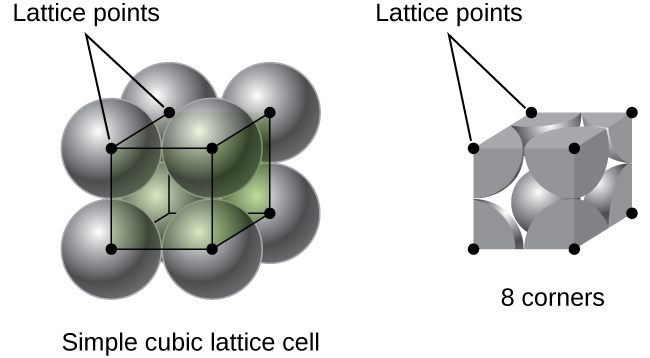
i en enkel kubisk gitter är enhetscellen som upprepas i alla riktningar en kub som definieras av centra för åtta atomer, som visas i Figur \(\PageIndex{4}\). Atomer vid intilliggande hörn av denna enhet cell kontakt med varandra, så kanten längden på denna cell är lika med två atomradier, eller en atomdiameter. En kubisk enhetscell innehåller endast de delar av dessa atomer som finns inom den. Eftersom en atom i ett hörn av en enkel kubisk enhetscell finns av totalt åtta enhetsceller, ligger endast en åttondel av den atomen inom en specifik enhetscell., Och eftersom varje enkel kubisk enhetscell har en atom vid var och en av sina åtta ”hörn” finns det \(8× \ dfrac{1}{8}=1\) atom inom en enkel kubisk enhet cell.
de flesta metallkristaller är en av de fyra huvudtyperna av enhetsceller., För nu kommer vi att fokusera på de tre kubiska enhetscellerna: enkel kubik (som vi redan har sett), kroppscentrerad kubisk enhetscell och ansiktscentrerad kubisk enhetscell-som alla illustreras i Figur \(\PageIndex{5}\). (Observera att det faktiskt finns sju olika gittersystem, av vilka några har mer än en typ av gitter, för totalt 14 olika typer av enhetsceller. Vi lämnar de mer komplicerade geometrierna för senare i denna modul.,)
vissa metaller kristalliserar i ett arrangemang som har en kubisk enhetscell med atomer i alla hörn och en atom i mitten, som visas i Figur \(\PageIndex{6}\). Detta kallas en kroppscentrerad kubisk (BCC) fast., Atomer i hörnen av en BCC-enhetscell kontaktar inte varandra utan kontaktar atomen i mitten. En BCC-enhetscell innehåller två atomer: en åttondel av en atom vid var och en av de åtta hörnen (\(8× \ dfrac{1}{8}=1\) atom från hörnen) plus en atom från mitten. Varje atom i denna struktur berör fyra atomer i skiktet ovanför det och fyra atomer i skiktet under det. Således har en atom i en BCC-struktur ett samordningsnummer på åtta.,
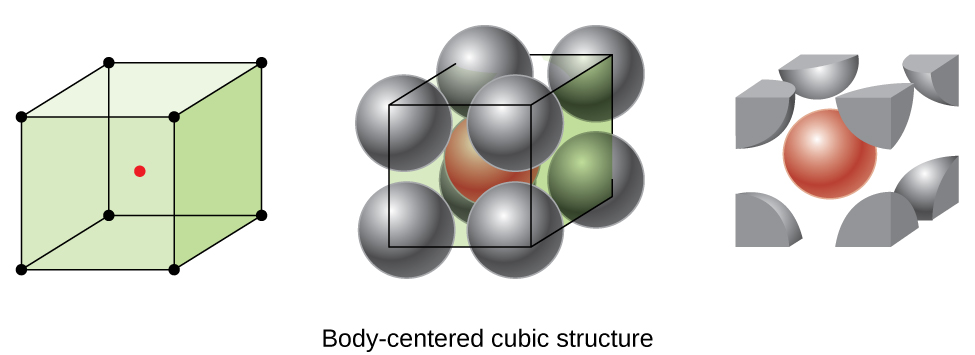
atomer i BCC-arrangemang är mycket mer effektivt förpackade än i en enkel kubisk struktur, som upptar cirka 68% av den totala volymen. Isomorfa metaller med en BCC struktur inkluderar K, Ba, Cr, Mo, W och Fe vid rumstemperatur., (Element eller föreningar som kristalliserar med samma struktur sägs vara isomorfa.)
många andra metaller, såsom aluminium, koppar och bly, kristalliserar i ett arrangemang som har en kubisk enhetscell med atomer vid alla hörn och vid mitten av varje ansikte, som illustreras i Figur \(\PageIndex{7}\). Detta arrangemang kallas en ansiktscentrerad kubisk (FCC) fast., En FCC-enhetscell innehåller fyra atomer: en åttondel av en atom vid var och en av de åtta hörnen (\(8× \ dfrac{1}{8}=1\) atom från hörnen) och hälften av en atom på var och en av de sex ansikten (\(6× \ dfrac{1}{2}=3\) atomer från ansikten). Atomerna i hörnen berör atomerna i mitten av de intilliggande ansikten längs kubens diagonaler. Eftersom atomerna är på identiska gitterpunkter har de identiska miljöer.
atomer i ett FCC-arrangemang packas så nära varandra som möjligt, med atomer som upptar 74% av volymen., Denna struktur kallas också kubisk närmaste förpackning (CCP). I CCP finns tre upprepande lager av hexagonalt anordnade atomer. Varje atom kontaktar sex atomer i sitt eget lager, tre i skiktet ovan och tre i skiktet nedan. I detta arrangemang berör varje atom 12 nära grannar, och har därför ett samordningsnummer på 12. Det faktum att FCC-och CCP-arrangemang är likvärdiga kanske inte är omedelbart uppenbart, men varför de faktiskt är samma struktur illustreras i Figur \(\PageIndex{8}\).,
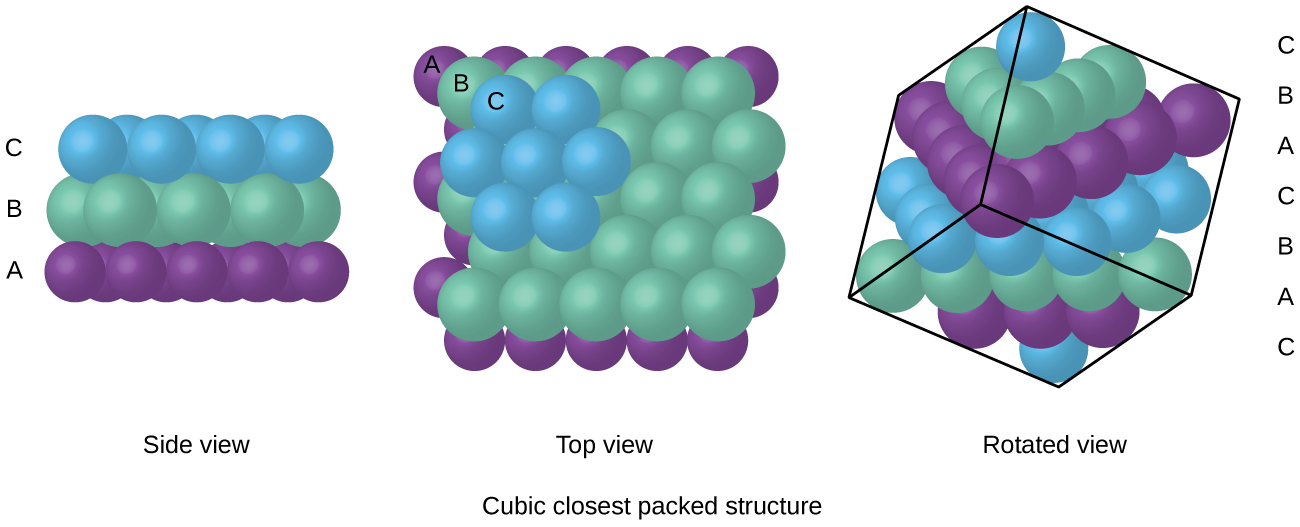
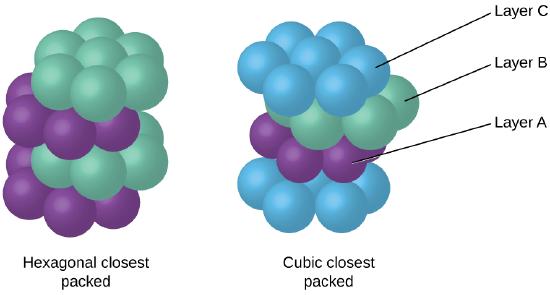
eftersom närmare förpackning maximerar de totala attraktionerna mellan atomer och minimerar den totala intermolekylära energin, packar atomerna i de flesta metaller på detta sätt., Vi hittar två typer av närmaste förpackning i enkla metalliska kristallina strukturer: CCP, som vi redan har stött på, och hexagonal closest packing (HCP) som visas i Figur \(\PageIndex{9}\). Båda består av upprepade lager av hexagonalt anordnade atomer. I båda typerna placeras ett andra skikt (B) på det första skiktet (a) så att varje atom i det andra skiktet är i kontakt med tre atomer i det första skiktet. Det tredje skiktet är placerat på ett av två sätt. I HCP är atomer i det tredje skiktet direkt ovanför atomer i det första skiktet (dvs,, det tredje skiktet är också Typ A), och staplingen består av alternerande typ A och typ B tätt packade lager (dvs ABABAB). I CCP är atomer i det tredje skiktet inte över atomer i något av de två första skikten (dvs det tredje skiktet är typ C), och staplingen består av alternerande typ A, typ B och typ c-tätt packade lager (dvs ABCABC). Omkring två tredjedelar av alla metaller kristalliserar i närmast förpackade matriser med koordinationsnummer på 12., Metaller som kristalliserar i en HCP-struktur inkluderar Cd, Co, Li, Mg, Na och Zn och metaller som kristalliserar i en CCP-struktur inkluderar Ag, Al, Ca, Cu, Ni, Pb och Pt.
övning \(\Pageindex{2}\)
Silver kristalliserar i en FCC-struktur. Kanten längden på dess enhet cell är 409 pm.
- vad är Ag: s atomradie i denna struktur?
- beräkna tätheten av Ag.
svara a
144 pm
svara b
10,5 g/cm3
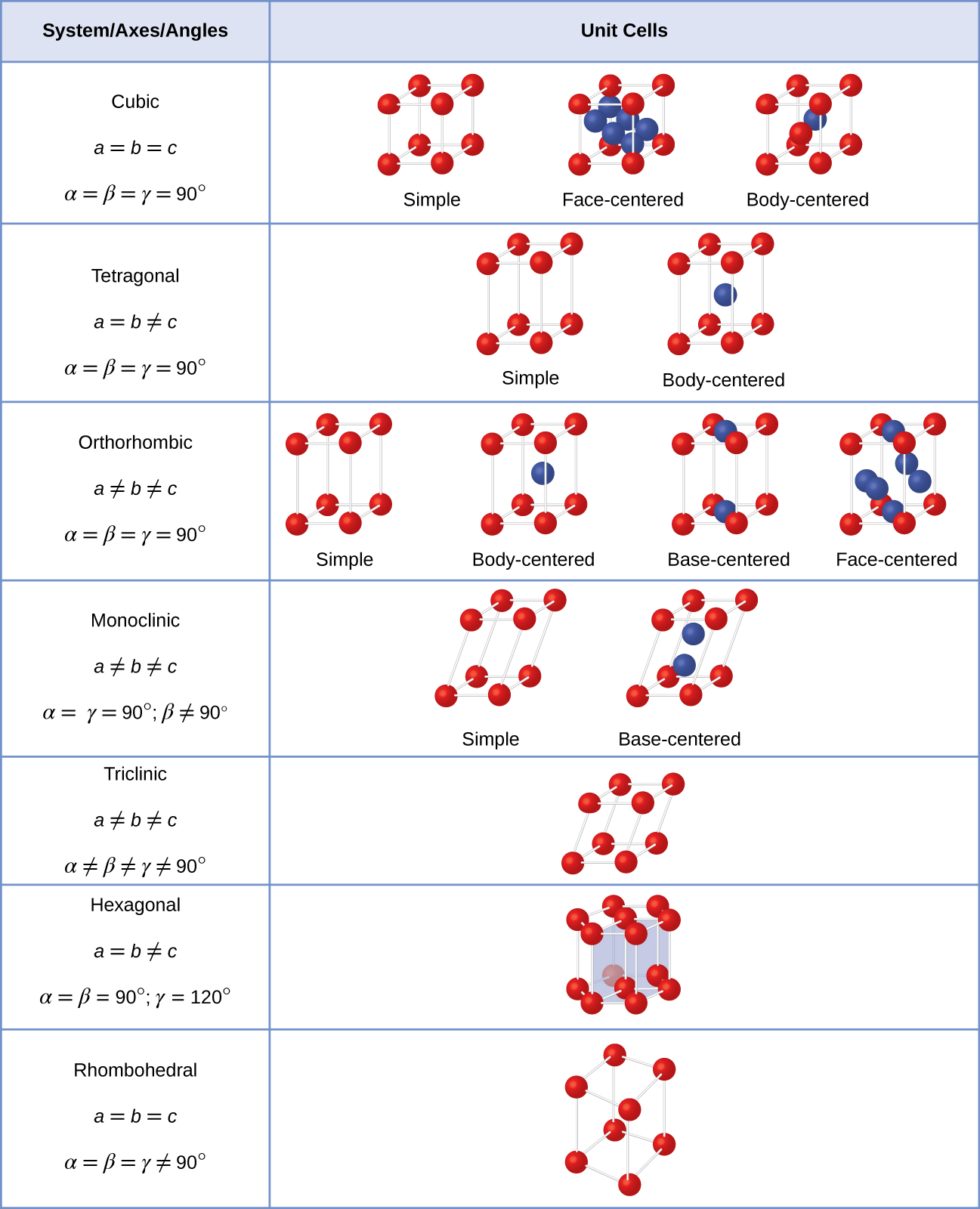
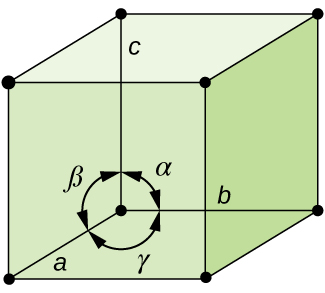
i allmänhet definieras en enhetscell av längderna på tre axlar (A, B och c) och vinklarna (α, β Och γ) mellan dem, vilket illustreras i Figur \(\PageIndex{10}\)., Axlarna definieras som längderna mellan punkterna i rymdgitteret. Följaktligen förenar enhetscellsaxlar punkter med identiska miljöer.
det finns sju olika gittersystem, av vilka några har mer än en typ av gitter, för totalt fjorton olika enhetsceller, som har de former som visas i Figur \(\Pageindex{11}\).