6.3: Absolute Configuration and The (R) And (s) System
Absolute Configurations of Perspective Formulas
Chemists behöver ett bekvämt sätt att skilja en stereoisomer från en annan. Cahn-Ingold-Prelog-systemet är en uppsättning regler som gör det möjligt för oss att entydigt definiera stereokemisk konfiguration av någon stereocenter, med hjälp av beteckningarna ” R ”(från latinska rectus, vilket betyder högerhänt) eller ” S ” (från latinska sinister, vilket betyder vänsterhänt).,
reglerna för detta system av stereokemisk nomenklatur är på ytan ganska enkla.
regler för att tilldela en r/s-beteckning till ett chiralcenter
1: tilldela prioriteringar till de fyra substituenterna, med #1 som högsta prioritet och #4 den lägsta. Prioriteringarna bygger på atomnumret.
2: spåra en cirkel från #1 till #2 till #3.
3: Bestäm orienteringen för #4-prioriteringsgruppen. Om den är orienterad i sidans plan (bort från dig), gå till steg 4a. om den är orienterad ut ur sidans plan (mot dig) gå till steg 4b.,
4a: (#4-gruppen pekar bort från dig): en medurs cirkel i del 2 motsvarar r-konfigurationen, medan en moturs cirkel motsvarar s-konfigurationen.
4b: (#4-gruppen pekar mot dig): en medurs cirkel i del 2 motsvarar s-konfigurationen, medan en moturs cirkel motsvarar r-konfigurationen.
vi använder 3-kolsocker glyceraldehyd som vårt första exempel. Det första vi måste göra är att prioritera var och en av de fyra substituenterna som är bundna till chiral center., Vi tittar först på de atomer som är direkt bundna till det chirala centret: det här är H, O (i hydroxyl), C (i aldehyden) och C (i CH2OH-gruppen).
tilldela r/s-konfiguration till glyceraldehyd:

två prioriteringar är enkla: väte, med ett atomnummer 1, är den lägsta (#4) prioriteringen, och hydroxylsyret, med atomnummer 8, är prioritet #1. Kol har ett atomnummer på 6. Vilken av de två C-grupperna är prioritet # 2, aldehyden eller CH2OH?, För att bestämma detta flyttar vi ytterligare en bindning från chiralcentret: för aldehyden har vi en dubbelbindning till ett syre, medan vi på CH2OH-gruppen har en enda bindning till ett syre. Om atomen är densamma har dubbelbindningar en högre prioritet än enskilda obligationer. Därför tilldelas aldehydgruppen # 2-prioritet och CH2OH-gruppen #3-prioriteringen.
med våra prioriteringar tilldelade ser vi nästa på # 4-prioriteringsgruppen (väte) och ser att den pekar tillbaka bort från oss, in i sidans plan – således gäller steg 4a från proceduren ovan., Sedan spårar vi en cirkel som definieras av #1, # 2 och # 3 prioriterade grupper, i ökande ordning. Cirkeln är medurs, som i steg 4a berättar för oss att detta kol har R-konfigurationen och att denna molekyl är (R) – glykeraldehyd. Dess enantiomer, per definition, måste vara (S)-glyceraldehyd.
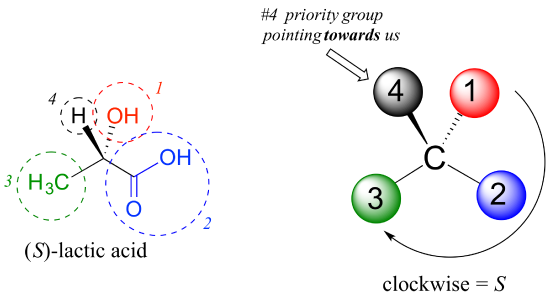
låt oss titta på en av enantiomererna av mjölksyra och bestämma konfigurationen av chiralcentret. Klart, H #4 snask och OH är #1. På grund av dess tre bindningar till syre tar kolet på syragruppen prioritet # 2, och metylgruppen tar #3., #4-gruppen, väte, råkar dras som pekar mot oss (ur sidans plan) i den här siffran, så vi använder Steg 4b: cirkeln spåras från #1 till #2 till #3 är medurs, vilket innebär att chiralcentret har s-konfigurationen.
läkemedlet talidomid är en intressant men tragisk fallstudie av betydelsen av stereokemi i drogdesign., Först tillverkas av ett tyskt läkemedelsföretag och ordineras allmänt i Europa och Australien i slutet av 1950″s som ett lugnande medel och botemedel mot graviditetsillamående hos gravida kvinnor, talidomid var snart inblandad som orsaken till förödande fosterskador hos barn födda till kvinnor som hade tagit det. Talidomid innehåller ett kiralt centrum, och finns sålunda i två enantiomeriska former. Det marknadsfördes som en racemisk blandning: med andra ord en 50:50 blandning av båda enantiomererna.
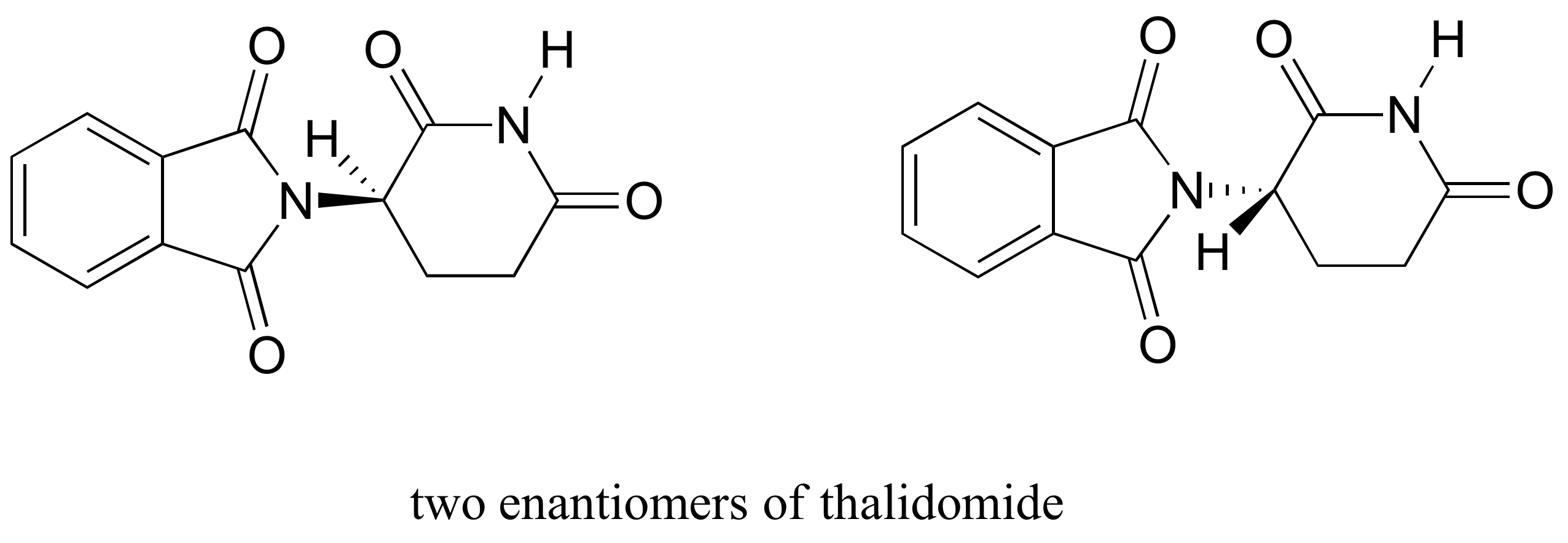
låt oss försöka bestämma stereokemisk konfiguration av enantiomeren till vänster., Av de fyra bindningarna till chiralcentret är #4-prioriteringen väte. Kvävegruppen är # 1, ringens karbonylsida är #2, och ringens CH2-sida är #3.
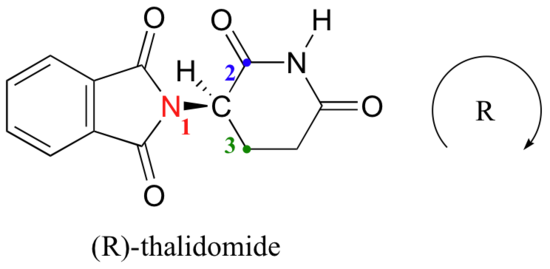
väte visas pekar bort från oss, och de prioriterade substituenter spåra en medurs cirkel: detta är R enantiomer av talidomid. Den andra enantiomeren måste naturligtvis ha s-konfigurationen.,
även om forskare fortfarande är osäkra idag hur talidomid fungerar, tyder experimentella bevis på att det faktiskt var R enantiomeren som hade de önskade medicinska effekterna, medan S enantiomeren orsakade fosterdefekterna. Även med denna kunskap är ren (R)-talidomid inte säker, eftersom enzymer i kroppen snabbt omvandlas mellan de två enantiomererna – vi kommer att se hur det händer i kapitel 12.
som en historisk anteckning godkändes aldrig talidomid för användning i USA. Detta var tack till stor del till ansträngningarna av Dr., Frances Kelsey, en mat-och Läkemedelsofficer som i fara för sin karriär blockerade sitt godkännande på grund av hennes oro över bristen på adekvata säkerhetsstudier, särskilt när det gäller läkemedlets förmåga att komma in i blodet hos ett utvecklande foster. Tyvärr var kliniska prövningar för nya droger vid den tiden omfattande och oreglerad distribution till läkare och deras patienter över hela landet, så familjer i USA skonades inte från de skador som orsakades.,
nyligen har ett nära derivat av talidomid blivit lagligt att förskriva igen i USA, med strikta säkerhetsåtgärder verkställda, för behandling av en form av blodcancer som kallas multipelt myelom. I Brasilien används talidomid vid behandling av spetälska – men trots säkerhetsåtgärder föds barn fortfarande med talidomidrelaterade defekter.
Övning 1.: Bestäm de stereokemiska konfigurationerna av de chirala centra i biomolekylerna som visas nedan.
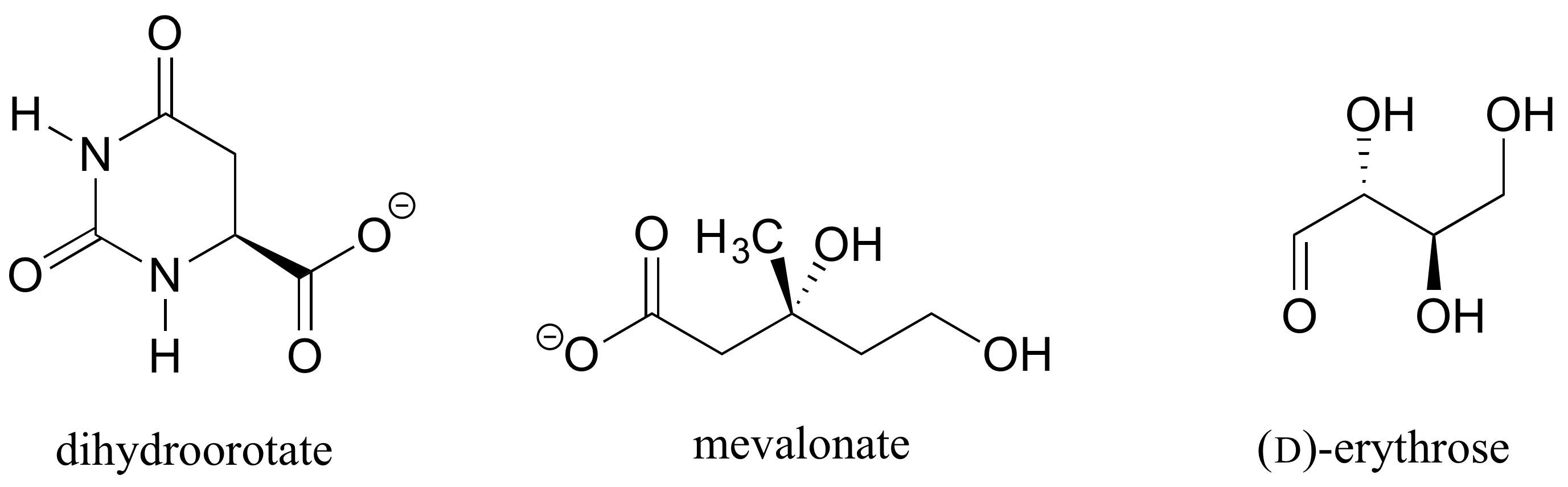
Övning 2.,: Ska (R) enantiomeren av malat ha en fast eller streckad kil för C-O-bindningen i figuren nedan?
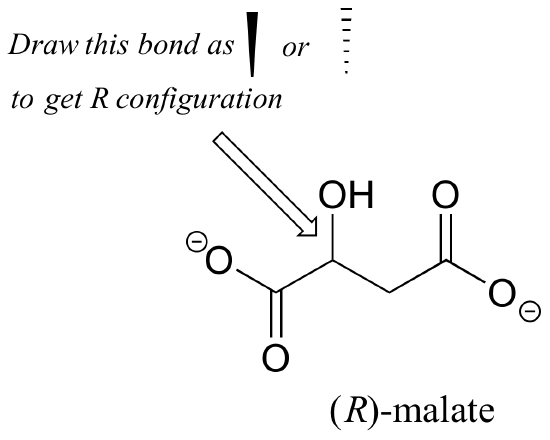
övning 3.: Använd fasta eller streckade kilar för att visa stereokemi, rita (R) enantiomeren av ibuprofen och (S) enantiomeren av 2-metylerytritol-4-fosfat (strukturer visas tidigare i detta kapitel utan stereokemi).
lösningar på övningar
absoluta konfigurationer av Fischer-projektioner
för att bestämma den absoluta konfigurationen av ett chiralt centrum i en Fisher-projektion, använd följande tvåstegsprocedur.,
Steg 1
tilldela prioritetsnummer till de fyra ligander (grupper) som är bundna till chiralcentret med hjälp av CIP-prioritetssystemet.
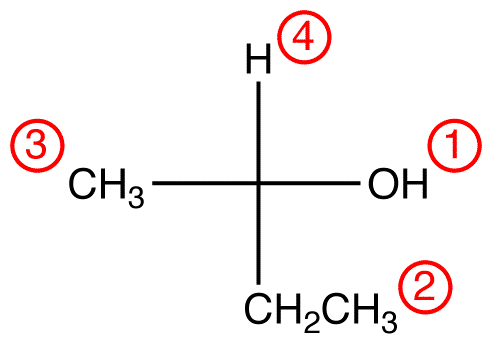
steg 2 – vertical option
om den lägsta prioriterade ligand är på en vertikal bindning, då det pekar bort från betraktaren.
spåra de tre ligander med högsta prioritet som börjar med högsta prioritet ligand (främst: ”Paradigm” (”Paradigm”) i den riktning som ger ett mycket korrekt svar.

i föreningen nedan indikerar rörelsen medurs en r-konfiguration., Det fullständiga IUPAC-namnet för denna förening är (R)-butan-2-ol.

steg 2 – horisontellt alternativ
om den lägsta prioriterade ligand är på en horisontell bindning, då den pekar mot betraktaren.
spåra de tre ligander med högsta prioritet som börjar med högsta prioritet ligand (”första prioritet”) i den riktning som kommer att ge ett fruktansvärt fel svar. Observera i tabellen nedan att konfigurationerna är omvända från det första exemplet.,
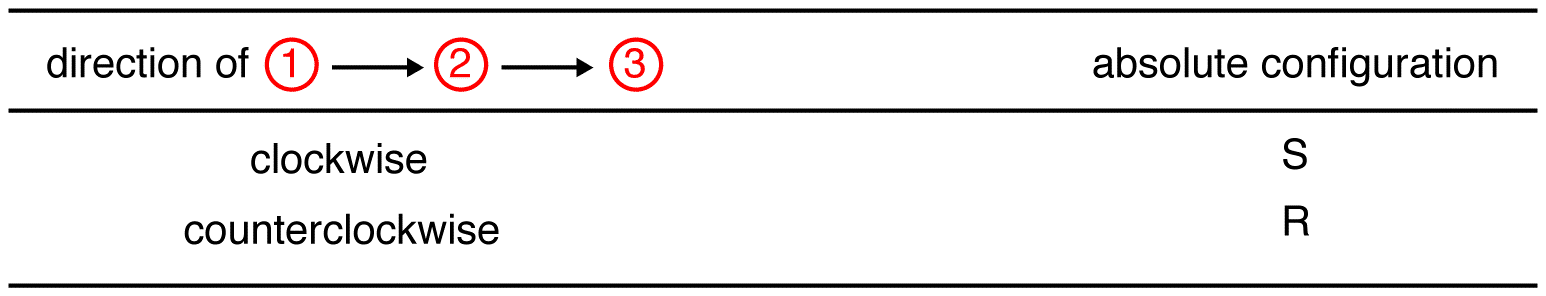
i föreningen nedan är rörelsen medurs (R) vilket är fruktansvärt fel, så den faktiska konfigurationen är S. Det fullständiga IUPAC-namnet för denna förening är (S)-butan-2-ol.
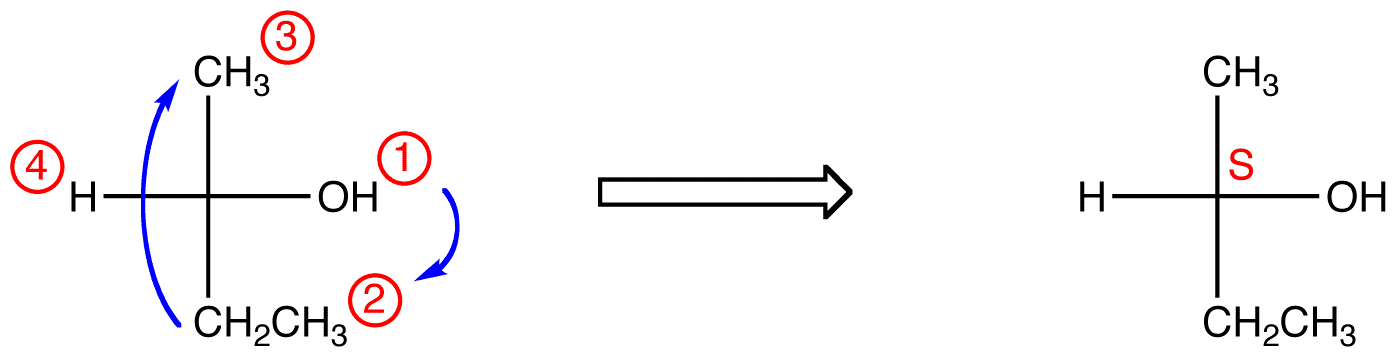
manipulera Fischer-projektioner utan att ändra konfigurationen
en Fischer-projektion begränsar en tredimensionell molekyl till två dimensioner. Följaktligen finns det begränsningar för de operationer som kan utföras på en Fischer-projektion utan att ändra den absoluta konfigurationen vid chirala centra., De operationer som inte ändrar den absoluta konfigurationen vid ett chiralt centrum i en Fischer-prognoser kan sammanfattas som två regler.
regel 1: Rotation av Fischer-projektionen med 180º i båda riktningarna utan att lyfta den från pappersplanet ändrar inte den absoluta konfigurationen vid chiralcentret.
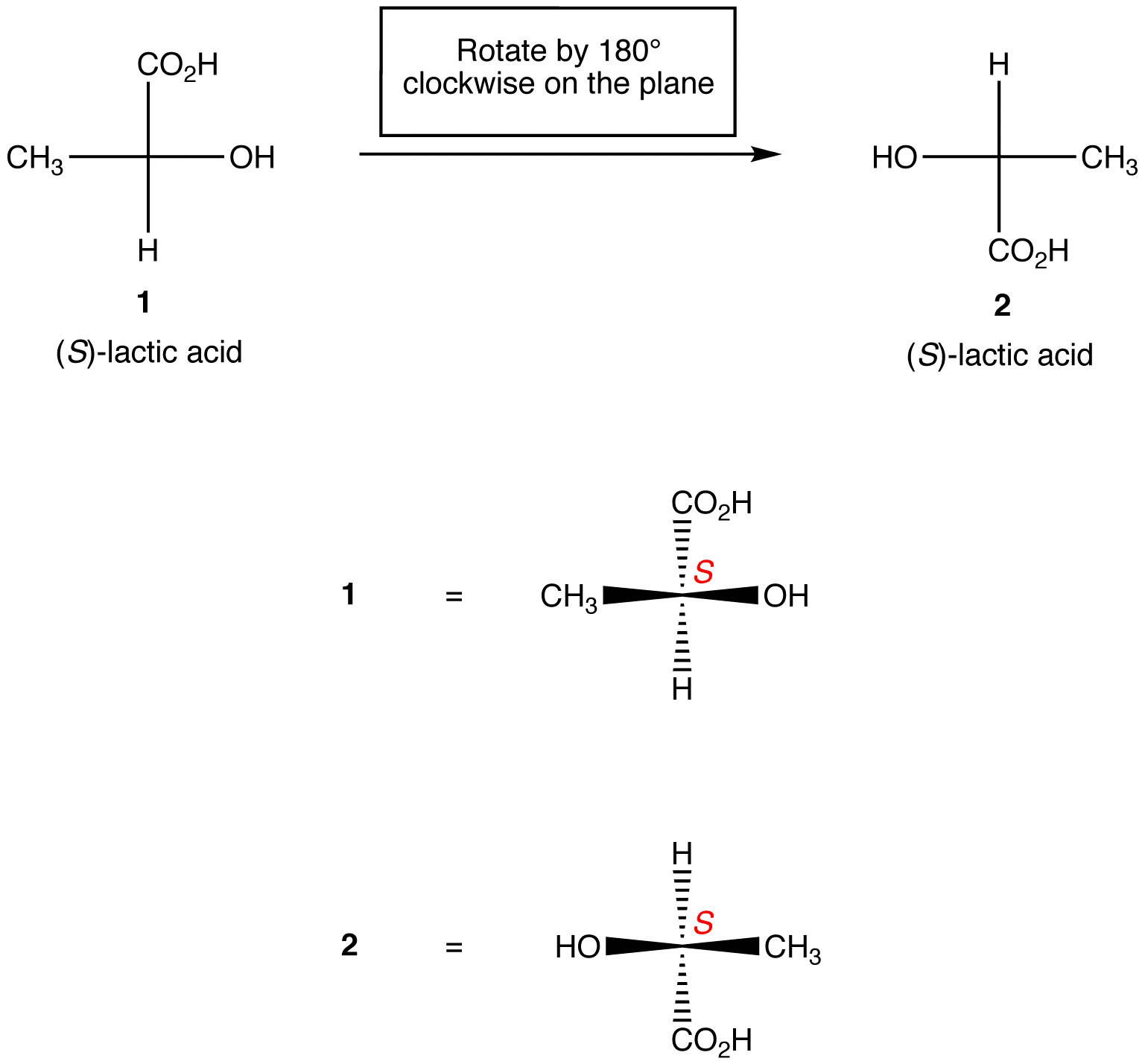
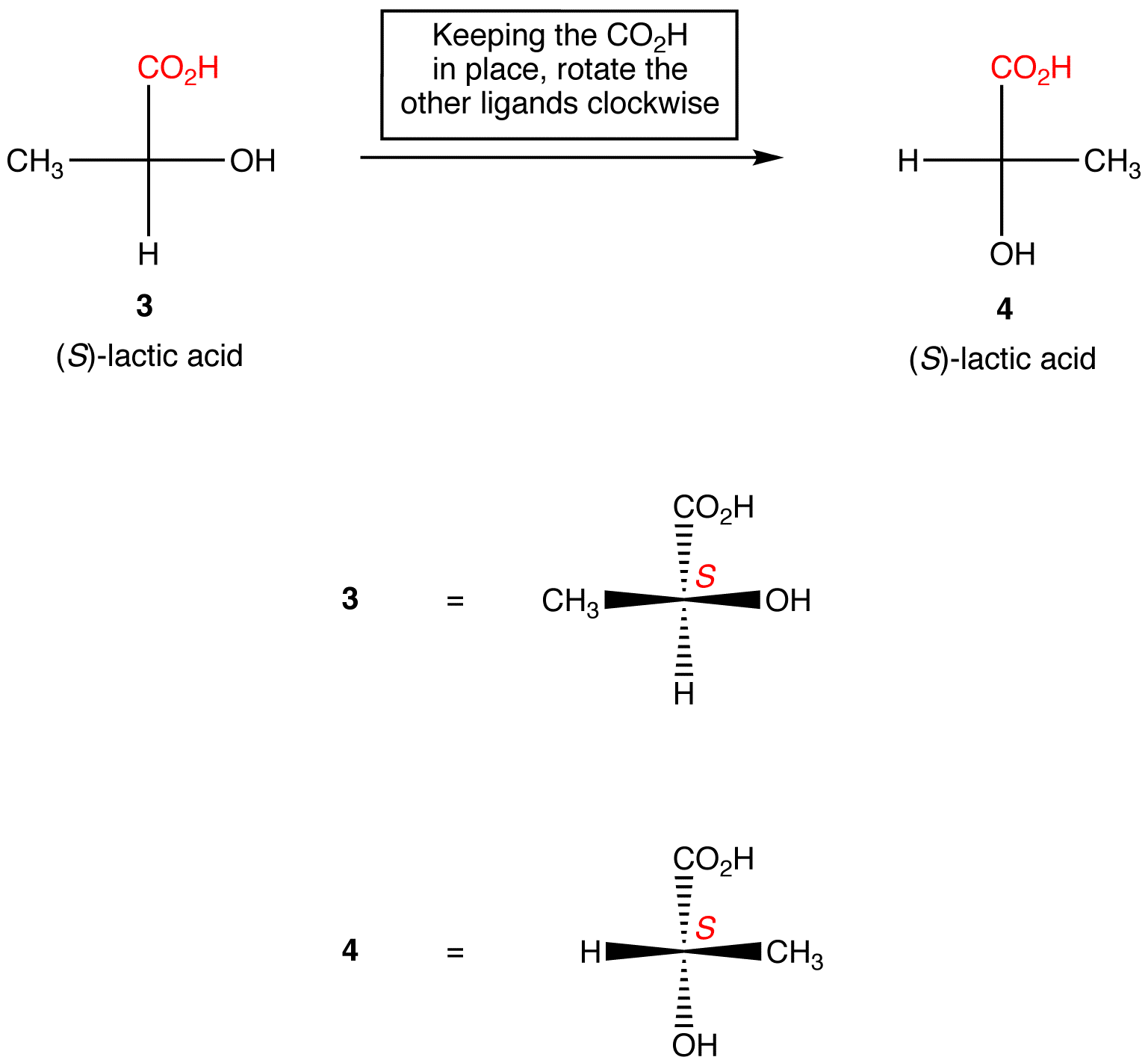
regel 2: Rotation av tre ligander på chiralcentret i båda riktningarna, vilket håller den återstående ligand på plats, ändrar inte den absoluta konfigurationen vid chiralcentret.,
manipulera Fischer-projektioner med förändring till konfiguration
de operationer som ändrar den absoluta konfigurationen vid ett chiralt centrum i en Fischer-projektion kan sammanfattas som två regler.
regel 1: Rotation av Fischer-projektionen med 90º i båda riktningarna ändrar den absoluta konfigurationen vid chiralcentret.
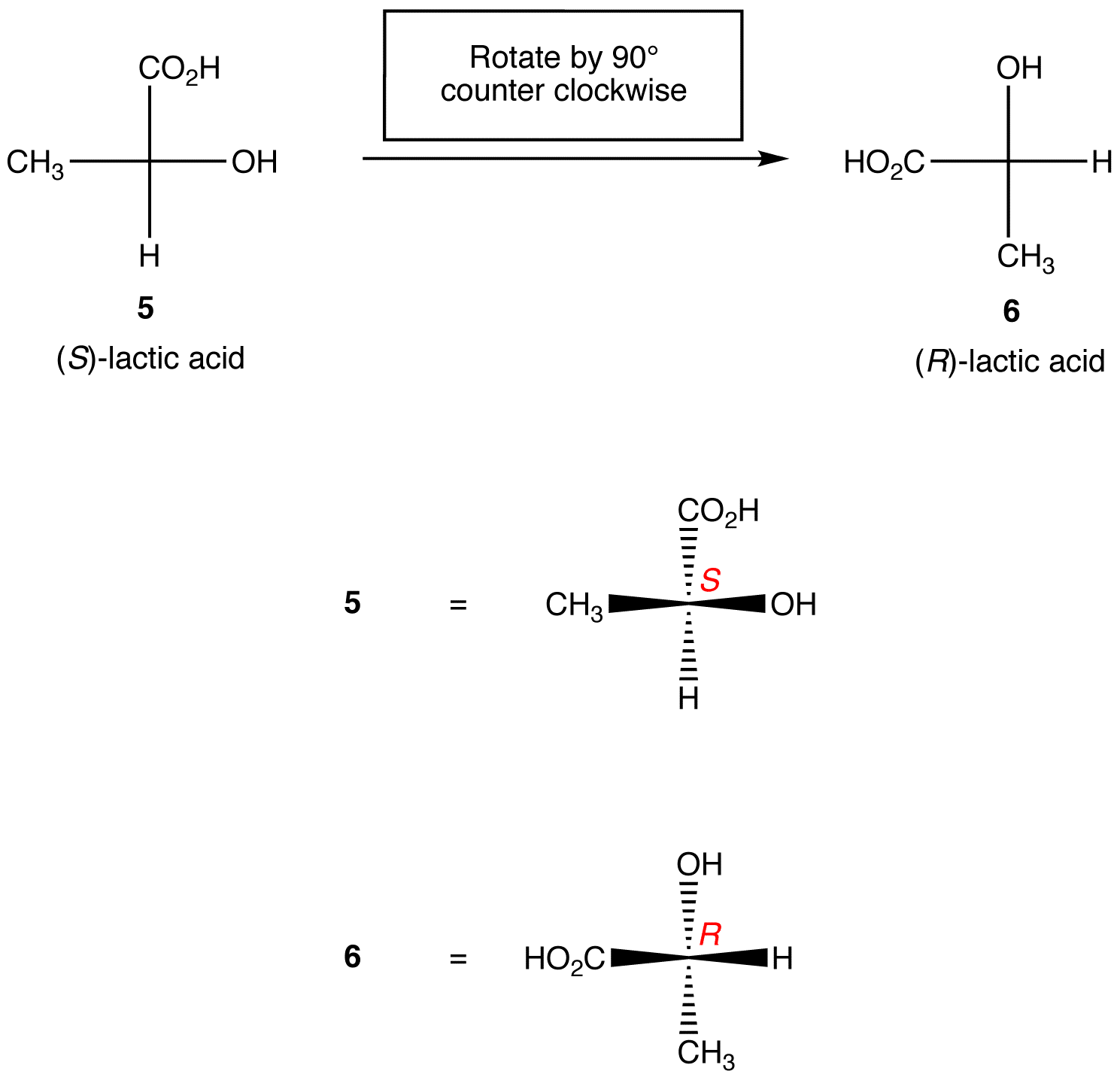
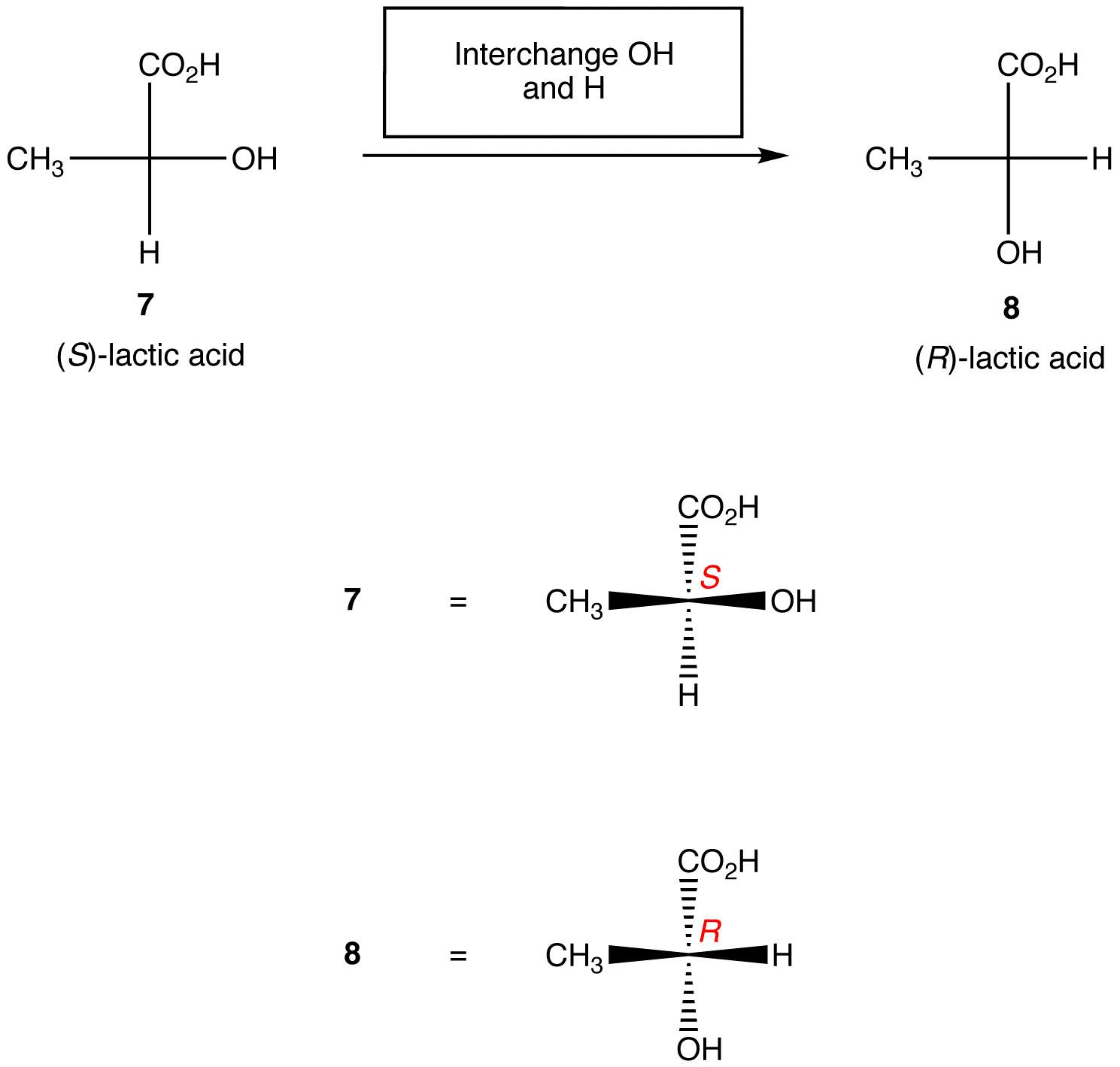
regel 2: byte av två ligander på chiralcentret ändrar den absoluta konfigurationen vid chiralcentret.,
ovanstående regler förutsätter att Fischer-projektionen i fråga endast innehåller ett chiralt centrum. Men med försiktighet kan de appliceras på Fischer-projektioner som innehåller valfritt antal chirala centra.
Övning 1
klassificera följande föreningar som R eller S?
lösning
- S: i> Br> f> H. den lägsta prioriterade substituenten, h, går redan bakåt., Det visar vänster går från I till Br till F, så det”s A S.
- r: Br > Cl > CH3 > H. du måste byta H och Br för att placera H, LÄGSTA prioritet, i ryggen. Sedan går från Br till Cl, CH3 vänder sig till höger, vilket ger dig en R.
- varken R eller S: denna molekyl är achiral. Endast Chirala molekyler kan namnges R eller S.
- R: OH > CN > CH2NH2 > H. H, den lägsta prioriteten, måste bytas till baksidan., Sedan går från OH till CN till CH2NH2, du svänger höger, vilket ger dig en R.
- (5) s: \(\ce{-COOH}\) > \(\ce{-CH_2OH}\) > \(\ce{c#CH}\) > \(\ce{h}\). Sedan går från \(\ce {- COOH}\) till\ (\ce{-CH_2OH}\) till\ (\ce{-c#CH}\) du svänger vänster, vilket ger dig en s-konfiguration.
övningar
6. Orientera följande så att minst prioritet (4) atom är paced bakom, tilldela sedan stereokemi (r eller s).

7. Rita (r)-2-bromobutan-2-ol.
8., Tilldela R / S till följande molekyl.
.png?revision=1)
lösningar

A = S; B = R
8. Stereocentret är R.
andra resurser
Kahn Academy video tutorial på R-S namngivningssystem
- Schore och Vollhardt. Organisk kemi struktur och funktion. New York:W. H. Freeman and Company, 2007.
- McMurry, John och Simanek, Eric. Grunden för organisk kemi. 6th Ed. Brooks Cole, 2006.,
bidragsgivare och Attributioner
- Ekta Patel (UCD), Ifemayowa Aworanti (University of Maryland Baltimore County)
- organisk kemi med biologisk betoning av Tim Soderberg (University of Minnesota, Morris)