Kombinerad terapi i neonatal hypoxisk-ischemisk encefalopati / Anales de Pediatría (engelsk utgåva)
introduktion
med en förekomst av 1-3 fall per 1000 heltidsfödda,1 hypoxisk-ischemisk encefalopati (HIE) är en av de vanligaste orsakerna till hjärnskador hos nyfödda. Med hänsyn till det ökande antalet högriskfödda på grund av den ökande utvecklingen i moderns ålder och frekvensen av flerbörd, bland andra faktorer, fortsätter HIE att vara ett relevant problem i sjukhusmiljön för vilken det ännu inte finns någon definitiv lösning.,
forskning om patofysiologi av perinatal asfyxi har gjort det möjligt för oss att förstå den komplexa processen som sker vid cell-och vävnadsnivåerna när hjärnskador utvecklas på grund av brist på syre. Många av de inblandade skademekanismerna är grupperade baserat på den tid som förflutit till deras utveckling, och 4 huvudfaser har beskrivits (Fig. 1): primär fas eller akut episod av hypoxisk ischemi (HI), latent fas, sekundär fas och tertiär fas., I den primära fasen härrör skador från en minskning av syretillförseln till celler och vävnader, vilket resulterar i primärenergifel. Detta följs av en uppenbar återhämtning i nivåerna av högenergifosforylerade föreningar, känd som latent fas., Denna förbättring är emellertid endast tillfällig och ger vika för sekundärfasen, när många av de patofysiologiska mekanismerna som är involverade i utvecklingen av hjärnskador hos nyfödda kommer in i bilden, vars chef är excitotoxicitet, en massiv tillströmning av kalciumjoner in i cellerna, oxidativ stress, inflammation och i de flesta fall celldöd på grund av nekros eller apoptos. För det sista kännetecknas den tertiära fasen av bestående hjärnskador veckor, månader eller till och med år efter den första hypoxiska ischemiska förolämpningen.,
förståelsen av HIE: s underliggande patofysiologi har gjort det möjligt att identifiera potentiella terapeutiska mål som kan bidra till att minska hjärnskadorna som orsakas av asfyxi och utvecklingen av många behandlingsstrategier. Några av dessa behandlingar, som för närvarande är i försök, är avsedda att fungera synergistiskt med terapeutisk hypotermi, den enda behandlingen mot HIE som allmänt har antagits i neonatal intensivvård.,
hypotermi
hypotermi började användas som en neuroprotektiv strategi hos spädbarn efter upptäckten av en endogen kylmekanism som manifesteras hos spädbarn som hade lidit någon typ av skada under födseln.2 dess neuroprotektiva effekter är huvudsakligen relaterade till minskningen av hjärnans metaboliska aktivitet, av 5% med varje 1 ° C minskning i temperatur, 3 som modulerar några av de skadliga metaboliska vägarna som utlöses av asfyxi, som sammanfattas i Fig. 2.
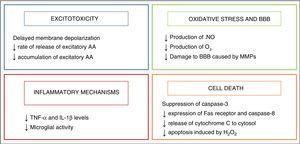
effekt av hypotermi på hjärnskador mekanismer.
kombinationsbehandling
eftersom bevisen tyder på att nuvarande hypotermi protokoll är optimal4 ännu är av begränsad effektivitet i klinisk praxis,5 Vi måste expandera är terapeutiskt armamentarium för hantering av HIE.,6 Ny forskning har fokuserat på utveckling och genomförande av behandlingar som kan användas i kombination med hypotermi, utformad för att fungera på olika nivåer av patofysiologisk kaskad och för att främja synergin mellan båda terapierna (Fig. 3).

möjliga terapeutiska mål och huvudsakliga neuroprotektiva strategier som för närvarande är föremål för studier för hantering av neonatal HIE.
Melatonin
Melatonin (N-acetyl-5-metoxitriptamina) är en neurohormon som syntetiseras av tallkottkörteln vars utsöndring följer en natt / dag cykel och vars huvudsakliga roll är att reglera dygnsrytmen. De viktigaste aspekterna som tillåter dess användning vid hantering av HIE är dess kraftfulla antioxidant och antiinflammatorisk aktivitet7 och dess förmåga att korsa blod–hjärnbarriären och nå centrala nervsystemet.,8
innan försöks hos nyfödda har melatonin visat sig öka skyddsnivån som ges av hypotermi genom optimering av hjärnans energimetabolism i en grismodell av asfyxi.9 i klinisk miljö, en studie publicerad av Aly et al.10 tilldelade hälften av asfyxierade nyfödda till hypotermi och 5 doser av 10 mg/kg/dag melatonin levererat via oral väg., Författarna fann en minskning av serumnivåerna av superoxiddismutas och kväveoxid hos de patienter som behandlades med kombinationsbehandling jämfört med de som behandlades med kylning ensam, vilket visade de positiva effekterna av kombinationen av båda strategierna mot oxidativ stress.
en nyligen genomförd studie utförd av Balduini et al., för att utvärdera säkerhet, farmakokinetik, dosering och effektivitet av melatonin som används i kombination med hypotermi fann att kylning inte påverkade farmakokinetiken för melatonin11 och att det var möjligt att erhålla höga serumnivåer av hormonet administrerande doser som var lägre jämfört med de som används i experimentella djurmodeller. För närvarande rekryterar den kliniska prövningen MELPRO (nct03806816) patienter, som syftar till ett urval av 100 nyfödda., Denna och andra liknande studier är oumbärliga för den framtida utvecklingen av fas III kliniska prövningar och den efterföljande användningen av melatonin i daglig klinisk praxis.
Allopurinol
grunden för användningen av allopurinol vid hanteringen av HIE är dess hämmande effekt på xantinoxidas, ett enzym som är involverat i oxidativ stress. Dessutom fungerar detta läkemedel som en fri-järnkelator och sekvestrerar hydroxylradikaler.,12, 13 en preklinisk studie på råttvalpar där djuren tilldelades 1 av 5 grupper (kontrollgrupp, HI-Grupp, Grupp behandlad med hypotermi, grupp behandlad med allopurinol och grupp behandlad med kombinationsbehandling) fann att 72h efter Hi-förolämpningen uppvisade kombinationsbehandlingsgruppen den lägsta infarktvolymen.,14
när det gäller dess farmakologiska egenskaper kan allopurinol snabbt passera placentan och uppnå terapeutiska koncentrationer hos nyfödda, vilket framgår av en studie utförd på gravida kvinnor som fick 500 mg allopurinol intravenöst, med tecken på optimala nivåer av allopurinol 5min senare i navelsträngsblodprover.15 En studie utförd av van Bel et al., i 1998 som analyserade sin potentiella antioxidant effekt i asfyxierade nyfödda med svår HIE fann att den intravenösa administreringen av 40 mg / kg allopurinol uppnådde en minskning av bildandet av fria radikaler.13 En studie som senare genomfördes av Benders et al. under 2006 fanns det inga skillnader mellan den grupp som behandlades med allopurinol och kontrollgruppen.16 i slutsatserna identifierade dessa författare den extrema svårighetsgraden av HIE hos de nyfödda som ingår i provet som en möjlig förklaring till bristen på signifikanta skillnader., De antog också att den period som förflutit till administrering av allopurinol (3-4h efter reperfusion) kunde ha varit för lång för att uppnå gynnsamma resultat. I förhållande till den senare punkten, Gunes et al. administreras samma dos av allopurinol ges i de 2 tidigare studierna, men inom 2h från födseln, och fann förbättringar i neurodevelopmental resultat i behandlingsgruppen.,17 i samma linje, administrering av intravenös allopurinol till mödrar under leverans av foster med hypoxi eller begynnande hypoxi ökade effektiviteten av behandlingen, vilket minskar blodkordnivåerna av protein S-100β, vilket är en markör för hjärnskador.En klinisk studie under namnet effekt av Allopurinol för hypoxisk-ischemisk hjärnskada på Neurokognitivt utfall (NCT03162653) pågår för närvarande för att bedöma de potentiella terapeutiska effekterna av administrering av denna enzymhämmare under de första minuterna efter födseln.,
erytropoietin
erytropoietin (EPO) är ett cytokin som mäter 30, 4 kDa syntetiserat i levern i fosterlivet och efter födseln av njurarna och den utvecklande hjärnan, där det verkar som en tillväxtfaktor och ett neuroprotektivt medel.19 användningen av både EPO och rekombinant humant EPO (rhEPO) i HIE är baserad på dess aktivitet, genom engagemang av EPO-receptorer närvarande i neuroner och glia,20 som ett potent antiapoptotiskt medel (stimulerande transkription av antiapoptotiska gener BCL-2 och BCL-XL), och som en antiinflammatorisk och antioxidant.,19,21 förutom dess neuroprotektiva effekt kan EPO främja långsiktiga reparationsprocesser, såsom angiogenes, oligodendrogenesis och neurogenes.22,23
prekliniska studier som har bedömt den synergiska effekten av att kombinera administreringen av EPO eller rhEPO med hypotermi har givit motsägelsefulla resultat. I en liknande råttmodell av hypoxisk ischemisk hjärnskada dag 7 efter födseln, Fang et al. fann inga signifikanta neuroprotektiva effekter av deras kombinerade användning.24 Men i en annan studie utförd av Fan et al.,, 25 författarna observerade en mild fördelaktig effekt på sensorimotorfunktionen hos råttvalparna, även om denna skillnad inte återspeglades i de histologiska egenskaperna hos hjärnvävnadsprover.
studier hos nyfödda med HIE har visat att användningen av rhEPO är säker vid doser på 300–2500IU/kg. Låga doser rhEPO har visat sig vara effektiva hos patienter med måttlig skada och verkar ha en minskad risk för invaliditet eller dödsfall.Högre doser (upp till 2500IU / kg) kan minska förekomsten av anfall och neurologiska abnormiteter vid 6 månader.,27
i Dag, tre fas III kliniska prövningar pågår med planerad rekrytering av totalt 840 nyfödda för att utvärdera säkerhet och effekt av höga doser av EPO (1000IU/kg) i kombination med hypotermi (Erytropoietin för Hypoxisk Ischemisk Encefalopati hos Nyfödda, NCT03079167; Hög-dos Erytropoietin för Syrebrist och Encefalopati, NCT02811263; Erytropoietin i Förvaltningen av Neonatal Hypoxisk Ischemisk Encefalopati, NCT03163589). Huvudmålet för de första 2 är att minska 2-årig dödlighet eller funktionshinder, medan den tredje kommer att bedöma dessa två resultat efter 1 år., Vi väntar på resultaten av dessa och andra studier för att avgöra om EPO eller något av dess derivat är effektiva och hur de ska användas i klinisk praxis, bedöma faktorer som minsta effektiva dos, administreringsväg, behandlingstid etc.
stamceller
användningen av stamceller för behandling av alla typer av sjukdomar, inklusive HIE, är ett forskningsområde som fortsätter att växa., Detta terapeutiska tillvägagångssätt kan hjälpa till att reparera och regenerera skadad hjärnvävnad efter den hypoxisk-ischemiska förolämpningen genom interaktionen mellan stamceller och immunceller i organ som är avlägsna från hjärnan, såsom mjälten, vilket förändrar det immun – /inflammatoriska svaret. På samma sätt kan den funktionella återhämtningen som uppnås med deras administrering delvis förklaras av interaktionen mellan de transplanterade cellerna och hjärnvävnaden, med den efterföljande produktionen av tillväxtfaktorer vars slutliga effekt skulle återspeglas i ökad neurogenes och cellulär proliferation.,
även om vi fortfarande behöver fördjupa vår kunskap för att kunna använda stamceller som en effektiv terapi, har experimentella studier på djur visat att olika typer av stamceller kan överleva i den skadade hjärnan, differentiera till neuroner eller glia, integrera i målvävnaden och positivt ändra beteenderesultat (granskat i Bennet et al.28)., Nyligen genomförda studier har rapporterat att administrering av mesenkymala stamceller i kombination med 24h kylning i råttpups 7 dagar efter födseln uppnådde bättre resultat jämfört med antingen behandling i isolering,29 och har också funnit att hypotermi utökar det terapeutiska tidsfönstret för administrering av mesenkymala stamceller till upp till 2 dagar efter den hypoxiska ischemiska händelsen.,30 dessutom kan stamceller reglera immunsvaret genom deras interaktioner med effektors immunceller belägna i organ som är avlägsna från hjärnan, såsom mjälten, vars mobilisering är känd för att ha potential att förvärra det inflammatoriska svaret och ischemiska skador i den omogna hjärnan, vilket ökar deras neuroprotektiva effekt.,31,32
stamcellsterapi, ensam eller i kombination med terapeutisk hypotermi, är ett lovande forskningsområde som fortfarande kräver kliniska prövningar för att bland annat bestämma den mest effektiva typen av stamceller och optimal dosering och behandlingstid för att få bästa möjliga behandlingsresultat.,28 ett av de projekt som för närvarande pågår i rekryteringsfasen (studie av hCT-MSC hos nyfödda barn med måttlig eller svår HIE, NCT03635450) kommer att omfatta 6 spädbarn födda vid en graviditetslängd av 36 eller fler veckor med måttlig till svår HIE som ska behandlas med hypotermi och 2 intravenösa doser av mesenkymala stromala celler härledda från navelsträngsvävnad (hCT-MSC). Huvudmålen för denna fas I-studie är att bedöma säkerheten hos hCT-MSC och analysera överlevnad och neurodevelopmental resultat hos deltagare vid 6 respektive 16 månader., En annan fas I-studie (nct00593242) erhöll lovande resultat med autolog transplantation av navelsträngsblodceller, med 74% av de nyfödda som fick stamceller som överlevde med poäng på 85 eller högre i Bayley-skalorna jämfört med 41% av de nyfödda som behandlades med kylning ensam.33
N-acetylcystein
N-acetylcystein (NAC) är en föregångare till cystein som rensar fria radikaler och deltar i glutationunderhåll,34 sålunda reglerar oxidativ stress., Bevis från djurmodeller visade en större minskning av hjärninfarktvolymen hos djur som behandlades med en kombination av NAC och hypotermi jämfört med djur som behandlades med endast en av dessa ingrepp. Vidare visade djur som behandlades med kombinationsbehandling liknande resultat i reflexer och skador på vit substans som de som hittades i kontrollgruppen.35 eftersom dess administrering under graviditeten inte har teratogena effekter och det kan passera placentan,har 36 NAC kommit att betraktas som ett av de mest lovande terapeutiska ämnena för framtida användning i neonatala intensivvårdsenheter., Men enligt vår kunskap har inga kliniska prövningar hittills utformats för att bedöma dess användning vid hantering av HIE, och de tillgängliga bevisen är begränsade till studier relaterade till intra-amniotisk inflammation, korioamnionit eller andnödssyndrom.
ädelgaser
ädelgaser som xenon och radon har uppvisat neuroprotektiva effekter i djurmodeller av neonatal HI. Många studier har analyserat möjligheten att använda xenon som ett terapeutiskt medel (för en granskning av bevisen, se artikeln av Lobo et al.,37) på grund av dess förmåga att minska excitotoxicitet efter en hi-förolämpning genom modulering av NMDA-glutamatreceptorer.38,39
den multicenter kliniska prövningen Total Body hypotermi plus Xenon (TOBY-Xe) använde xenongas i kombination med hypotermi i ett urval av 92 spädbarn födda mellan 36 och 43 veckors graviditet., Även om det inte fann signifikanta skillnader mellan grupper,40 i syfte att få mer detaljerad information om några av de variabler som kan ha haft en inverkan på resultaten av behandling med denna ädelgas, såsom dess dosering eller varaktighet, pågår en fas II klinisk studie för närvarande (CoolXenon3 studie, nct02071394).,
å andra sidan har det inte förekommit några kliniska prövningar av argon hittills, men argon har visat sig förbättra resultaten av kylning när det gäller nivåerna av N-acetyl-aspartat/laktat-markören, som har associerats med ökningar i genomsnittliga celldödsvärden och utvecklingen av neurologiska följdsjukdomar hos drabbade nyfödda.41 dessa lovande resultat, tillsammans med dess högre biotillgänglighet och lägre kostnad jämfört med xenon, gör argon till en molekyl med hög potential för bänk till sängöversättning vid behandling av HIE.,
slutsatser
att uppnå en effektiv behandling för HIE är en av de stora utmaningarna för modern medicin. Av denna anledning har betydande ansträngningar gjorts i flera år för att analysera de mekanismer som leder till hjärncellskador efter perinatal asfyxi i syfte att utveckla effektiva behandlingar för att blockera dem. För närvarande försöker barnläkare och neuroforskare att utveckla nya föreningar som kan fungera i synergi med hypotermi i syfte att minska till ett minimum de neurologiska följden av HIE., Å andra sidan har nya studier börjat inkludera sex bland variablerna för att ta hänsyn till i hanteringen av HIE, eftersom dimorfa sexuella skillnader har hittats både i skademekanismerna (i experimentella modeller har kvinnliga djur uppvisat större minnesunderskott, medan manliga djur har visat större känslighet för oxidativ stress) och i vägarna för de olika behandlingarna som behandlas., Trots de lovande framstegen med användning av melatonin eller föreningar som EPO behövs fortfarande prekliniska studier för att ytterligare belysa verkningsmekanismerna för dessa molekyler, och kliniska prövningar med större prover behövs för att bestämma optimal dosering och administreringsvägar för dessa och andra behandlingar.
finansiering
studien stöddes av ett bidrag från UPV / EHU som en del av universitetets forskargruppsfinansieringsprogram (GIU 17/018).
intressekonflikter
författarna har inga intressekonflikter att förklara.