Mitkä ovat erot FDA: n lääkinnällisten laitteiden luokissa?
YHDYSVALTAIN FDA säätelee kaikkia lääkinnällisiä laitteita markkinoidaan yhdysvalloissa, jotka on ryhmitelty kolmeen laajaan luokkaan. Kaikki FDA: n hyväksymät lääketieteelliset laitteet luokitellaan joko luokkaan I, II tai III riippuen laitteen”riski, invasiivisuus ja vaikutus potilaan yleiseen terveyteen. Mutta missä ovat näiden kolmen luokan välille piirretyt viivat ja miksi?,
Yhdysvaltain FDA: n luokitteluohjeet voivat hämmentää suuresti lääkinnällisten laitteiden valmistajia, joiden altistus järjestelmälle on vähäistä. On valtava ero siinä, optimaalinen polku markkinoille valmistajien riippuen siitä, miten laite on ryhmitelty. Luokan I laitteisiin sovelletaan huomattavasti vähemmän lakisääteisiä vaatimuksia kuin luokan II tai III laitteisiin.
ymmärtämällä erot FDA: n lääkinnällisten laitteiden luokat, voit ymmärtää, miten laite on ryhmitelty., Kun tämä tieto on käsillä, lääkinnällisten laitteiden valmistajat voivat paremmin valmistautua ja kohdentaa tarvittavat resurssit sääntelyn hyväksymiseen.
Erot FDA: n Lääkinnällisten laitteiden Luokat
FDA on luokitellut yli 1700 eri tyyppisiä lääketieteellisten laitteiden. Laitteet on järjestetty Code of Federal Regulations (CFR) mukaan 16 erikoisuuksia, kuten Sydän-tai Hematologian laitteet., Luokittelussa lääketieteellisen laitteen mukaan yksi 16 erikoisuuksia on ensimmäinen askel ymmärtää, onko olet valmistus Luokka I, II, tai III lääkinnällisen laitteen.
sen Jälkeen, kun luokittelussa laitteen mukaan erikoisuus, FDA kehottaa valmistajat edetä premarket notification tietoa onko niiden laite on vapautettu tai ei. Luokan i lääkinnälliset laitteet, vähiten riskialttiit ja invasiiviset laitteet, on vapautettu ennakkomarkkinoinnin ilmoitusprosesseista. Erityiset luokan II laitteet on myös vapautettu perusmarkkinahyväksynnästä.,
Kuitenkin, kaikki laitteet säännelty FDA sovelletaan nykyisen Hyvän valmistuskäytännön (cGMP) rekisteröintivaatimukset, merkinnöistä ja laatua. Mutta mistä tiedät, onko laitteesi I-vai II-luokka ja onko sinun tehtävä ennakkoilmoitus? 
Luokka 1
YHDYSVALTAIN FDA määrittelee Luokan I laitteet laitteet, jotka ovat ”ei ole tarkoitettu käytettäväksi tukea tai ylläpitää elämää tai merkittävää estämään heikkeneminen ihmisten terveyden, ja he voivat ei läsnä potentiaalinen kohtuutonta sairauden tai loukkaantumisen vaaraan.,”
Nämä laitteet ovat yleisimpiä Luokan laitteet säännelty FDA, jotka muodostavat 47 prosenttia hyväksyttyjen laitteiden markkinoille.
luokan i laitteilla on vähäinen kontakti potilaisiin ja vähäinen vaikutus potilaan yleiseen terveyteen. Yleensä I-Luokan laitteet eivät ole kosketuksissa potilaan kanssa”s sisäelimissä, keskushermostossa, tai sydän-järjestelmä. Näihin laitteisiin sovelletaan vähiten lakisääteisiä vaatimuksia.,
Esimerkkejä Luokan I Laitteet:
- Sähköhammasharja
- Kielen Lastaan
- happinaamari
- Uudelleenkäytettäviä Kirurginen Leikkausveitsellä
- Siteet
- sairaalapaikkojen
Tuo Luokan I Lääkinnällisten Laitteiden Markkinoille
Luokan I laitteet ovat nopein ja helpoin tuoda markkinoille, koska ne aiheuttavat vähiten vaaraa potilaalle ja ovat harvoin kriittisiä elämää ylläpitäviä hoito. Suurin osa I-luokan laitteista on vapautettu FDA: n vaatimuksista, jotka koskevat Premarket-ilmoitusta (510k) ja Premarket-hyväksyntää (PMA).,
I-Luokan laitteet eivät ole vapautettu FDA yleinen valvonta, sarjan komentoja, joka koskee Luokan I, II, ja III lääkinnällisiä laitteita. Tämän lain säännöksissä käsitellään väärentämistä, väärentämistä, laiterekisteröintiä, kirjanpitoa ja hyviä valmistuskäytäntöjä. A-luokkaan kuuluvien lääkinnällisten laitteiden valmistajien on edelleen otettava käyttöön laadunhallintajärjestelmä ja noudatettava standardeja laatutuotteen varmistamiseksi.,
RELATED KÄSITTELYSSÄ: Ero Premarket Notification 510(k) ja Premarket Hyväksyntä
Luokka 2
Luokka II medical-laitteet ovat monimutkaisempia kuin Luokan I laitteet ja aiheuttaa suuremman luokan riski, koska ne ovat todennäköisesti tulla osaksi jatkuvaa yhteyttä potilaan kanssa. Tämä voi sisältää laitteita, jotka joutuvat kosketuksiin potilaan”s sydän-järjestelmä, tai sisäelimiin, ja diagnostisia työkaluja.,
FDA määrittelee Luokan II laitteita ”laitteet, joiden yleinen valvonta on riittämätöntä, on antaa kohtuullinen varmuus turvallisuus ja tehokkuus laitteen.,est Sarjat
Tuo II Luokan Lääkinnällisten Laitteiden Markkinoille
Ohjaa vaihdella riippuen laitteen, mutta mukaan FDA, voi sisältää:
- Laitteen suorituskykyä
- markkinoille saattamisen jälkeisiä valvonta
- Potilas rekisterien
- Erityisiä merkintöjä koskevat vaatimukset
- Premarket tietoja koskevat vaatimukset
- Ohjeet
suurin osa Luokan II laitteet ovat FDA-hyväksytty käytettäväksi markkinoiden kautta Premarket Notification, tai 510(k) prosessi.,
– Luokan II laitteet kuuluvat samaan Yleiseen Valvonta edellä on mainittu, mutta FDA määrittelee ne on ”laitteet, joiden yleinen valvonta on riittämätöntä, on antaa kohtuullinen varmuus turvallisuus ja tehokkuus laitteen.”Tästä syystä luokan II laitteisiin sovelletaan myös erityisvalvontaa. Nämä määräykset riippuvat laitteesta ja voivat sisältää erityisiä merkintävaatimuksia, potilasrekistereitä ja suorituskykystandardeja.
useimmat luokan II laitteet tulevat markkinoille Premarket-Ilmoitusprosessin (510k) avulla., 510(k) on monimutkainen sovellus, FDA, joka osoittaa, että laite on turvallinen ja tehokas osoittamalla, että laite vastaa toiseen laitteeseen, joka on markkinoilla.
Tämä prosessi liittyy osoittaa ”olennaisen vastaavuuden” toiseen laitteeseen, joka on tunnettu FDA kielenkäytössä kuin ”predikaatti.”Tämä ei tarkoita, että laitteiden on oltava identtisiä, mutta ne vaativat merkittäviä yhtäläisyyksiä käytössä, suunnittelussa, materiaaleissa, merkinnöissä, standardeissa ja muissa ominaisuuksissa.,
FDA julkaisi poikkeus lista alkuvuodesta 2018, joka vapauttaa yli 800 geneeristen I ja II Luokan lääkinnällisten laitteiden 510(k) prosessi. Jos sinulla on geneerinen luokan II lääketieteellinen laite, voit selvittää, onko se vapautettu 510(k) arkistointi etsimällä FDA tuoteluokitus tietokantaan.
aiheeseen liittyvä lukema: 5 syytä uudistaa FDA 510(k) on hieno siirto.
Luokan 3
FDA määrittelee Luokan III laitteiden, kuten tuotteita, jotka ”yleensä ylläpitää tai tukea elämää, istutetaan tai läsnä on mahdollisia kohtuutonta sairauden tai loukkaantumisen vaaraan.,”
Vain 10 prosenttia laitteiden säännelty FDA kuuluvat Luokkaan III. Tämä luokitus on yleensä laajennettu pysyvä implantit, älykkäät lääketieteelliset laitteet, ja elämää ylläpitäviä järjestelmiä.
Kun taas Luokan III on yleensä varattu kaikkein innovatiivisia ja huippuluokan lääketieteelliset laitteet, on olemassa muita laitteita, jotka kuuluvat III Luokan eri syistä., Joitakin laitteita, jotka on alun perin luokiteltu kuuluvaksi Luokkaan II voidaan törmätä jopa Luokkaan III, jos valmistaja ei pysty osoittamaan huomattavia vastaavuus predikaatti (olemassa olevan tuotteen) aikana PMA (510k) arkistointi prosessi.,
Esimerkkejä Luokan III Lääkinnällisten Laitteiden:
- rintaimplantit
- Sydämentahdistin
- Defibrillaattorit
- Korkea-taajuus tuulettimet
- Sisäkorvaistutteet
- Sikiön verinäytteen ottoa valvoo
- Istutettu proteeseja
Tuo Luokan III Lääkinnällisten Laitteiden Markkinoille
Luokan III laitteisiin kuuluvat kaikki FDA: n Yleinen Valvonta-ja FDA Premarket Hyväksyntä (PMA) prosessi., FDA kirjoitti, ”koska riskitaso Luokan III laitteiden, FDA on todennut, että yleiset ja erityiset tarkastukset eivät yksin riitä varmistamaan turvallisuutta ja tehokkuutta Luokan III laitteet.”
PMA on FDA: n vaatima intensiivisin laitemarkkinointisovellus. Jotkut FDA luokan III laitteet on vapautettu ja voi saada 510 (k) arkistointi, mutta suurin osa odotetaan saada Premarket hyväksyntää.,
PMA-prosessi edellyttää lääketieteellisen laitteen tarkkaa tutkimista turvallisuuden ja tehokkuuden osoittamiseksi kehittämällä datavetoista hyöty-riskiprofiilia. PMA-prosessiin kuuluu yleensä kliinisiä tutkimuksia ja merkittävää aikaa ja resursseja riittävään tiedonkeruuseen. Ainoat poikkeukset luokan III PMA-menettelyyn ovat laitteet, joilla on huomattava vastine. Voit selvittää, onko Luokan III laite voidaan myydä 510(k) etsimällä FDA Premarket Hyväksyntä (PMA) – tietokantaan ja 510(k) Premarket Notification tietokantaan.,
Miten Määrittää Luokka
ensimmäinen askel kohti luokittelussa Lääkärin Laite on navigoida FDA-Luokitus asetusten luettelo 16 luokat lääkinnällisten laitteiden mukaan lääketieteellinen erikoistuminen.
esimerkkinä”näytämme sinulle vaiheet verenpainehälytyksen luokittelun tunnistamiseksi. Laite luokitellaan luokkaan 870: sydän-ja verisuonilaitteet.,
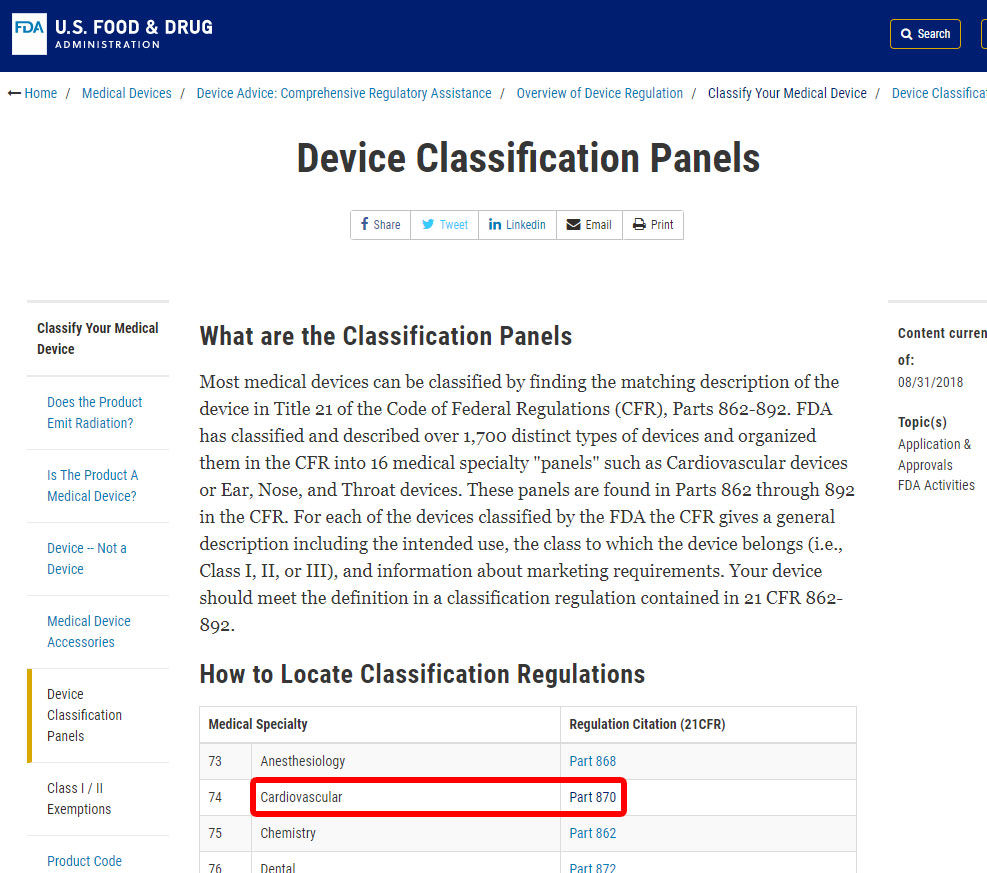
Kun olet”ve sijaitsee kyseisen lääketieteellisen erikoisuus, valitse luokka, ja navigoida luettelon laitteista, kunnes löydät vastaava ja liittyvä laite-koodi.
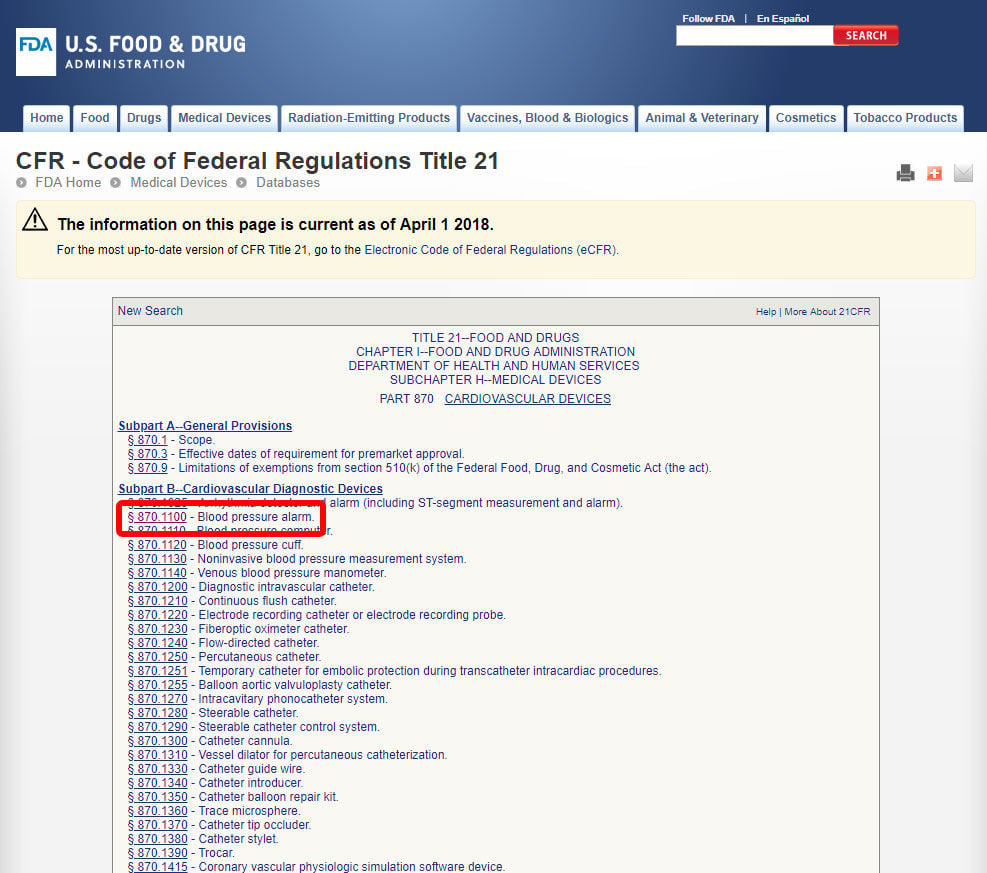
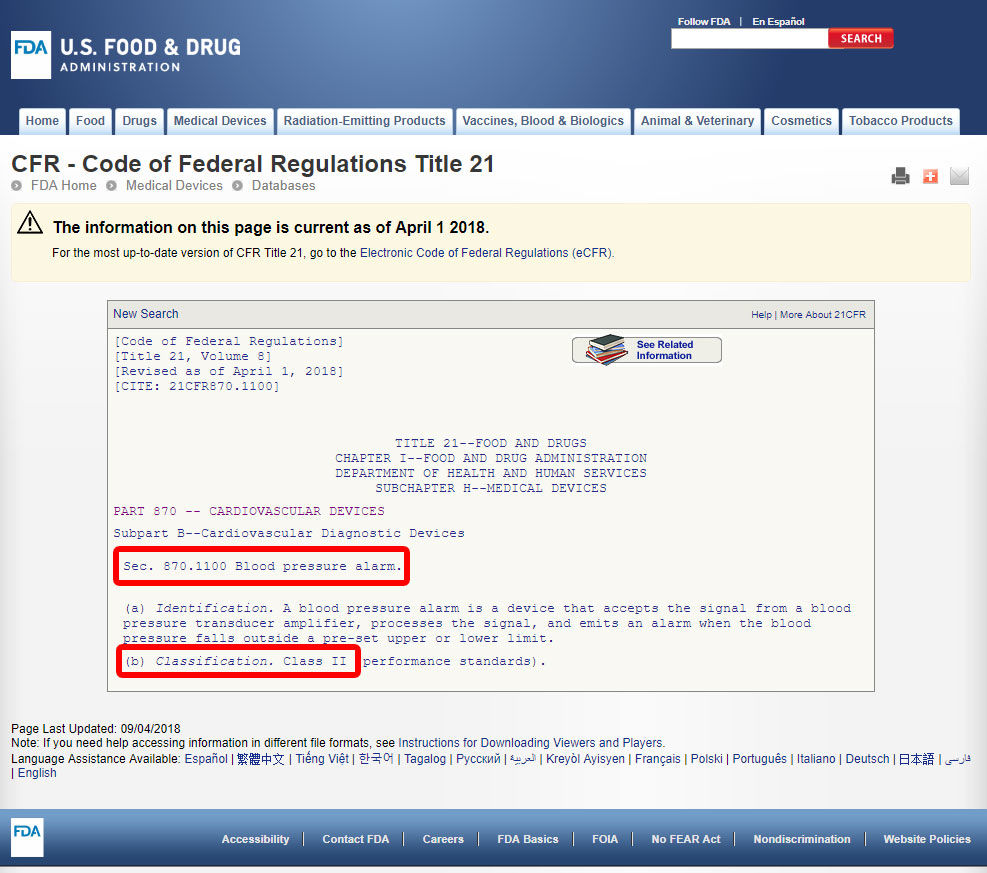
Napsauta laitteen koodin ja avaa ohjeet. Laiteluokitus on lueteltu kohdan b alakohdassa.,
Jos laite ei ole luettelossa vastaava keskuudessa 1700-laitteet luokitellaan FDA, se on todennäköisesti innovatiivinen laite ilman huomattavaa vastaava ja olisi luokiteltava Luokkaan III.
Ymmärrystä FDA: n Lääkinnällisten laitteiden Luokat
erot lääkinnälliset laitteet luokitellaan Luokkaan I, II tai III FDA on enimmäkseen riski, määrän yhteyttä potilaan kanssa ja niiden sisäisiä järjestelmiä, ja onko laite on kriittinen ylläpitämään elämää.,
näiden tekijöiden lisäksi FDA pitää merkittävää vastaavuutta määritettäessä, miten laite luokitellaan. Jos laitteesi on vähäriskinen ja minimaalisesti yhteydessä potilaaseen, olet todennäköisesti oikeutettu luokkaan I ja virtaviivaiseen markkinahyväksyntäprosessiin. Luokan II-ja III-laitteet on osoitettava turvallisuus kautta aineellisen vastaavuus, 510(k) hakemuksen, tai premarket hyväksyntä prosessi.
tietäen kuinka laite on luokiteltu, voit virtaviivaistaa teidän polku markkinoiden hyväksynnän ymmärtämällä prosessit ja asiakirjat, jotka ovat todennäköisesti tarvitaan FDA., Jos organisaatiosi on aihe, Luokan II tai Luokan III 510(k) tai PMA-vaatimus, tämä tieto voi auttaa sinua varata tarvittavat resurssit jo etukäteen ja suunnitella onnistuneen hakemuksen.
