Milyen különbségek vannak az FDA orvosi Eszközosztályaiban?
az amerikai FDA szabályozza az Egyesült Államokban forgalmazott összes orvosi eszközt, amelyek három széles osztályba sorolhatók. Az FDA által jóváhagyott bármely orvosi eszköz besorolása I., II. vagy III. osztályba sorolható, az eszköz kockázatától, invazivitásától és a beteg általános egészségi állapotára gyakorolt hatástól függően. De hol vannak a vonalak e három osztály között, és miért?,
az amerikai FDA osztályozási irányelvei nagyon zavaróak lehetnek az orvostechnikai eszközök gyártói számára, akiknek korlátozott a rendszer expozíciója. Óriási különbség van a gyártók számára a piac optimális elérési útján, attól függően, hogy az eszköz hogyan van csoportosítva. Az I. osztályú eszközökre sokkal kevesebb szabályozási követelmény vonatkozik, mint a II.vagy III. osztályú eszközökre.
az FDA orvosi eszközosztályainak különbségeinek megértésével megértheti, hogy a készülék hogyan lesz csoportosítva., Ezzel a tudással a premarket szakaszban lévő orvostechnikai eszközgyártók jobban felkészíthetik és eloszthatják a szabályozási jóváhagyáshoz szükséges erőforrásokat.
különbségek az FDA orvostechnikai Eszközosztályai között
az FDA több mint 1700 különböző típusú orvostechnikai eszközt sorolt be. Az eszközöket a szövetségi rendeletek kódexében (CFR) 16 specialitás, például kardiovaszkuláris vagy hematológiai eszköz szerint szervezik., Az orvosi eszköz osztályozása a 16 specialitás egyikének megfelelően az első lépés annak megértéséhez, hogy I., II.vagy III. osztályú orvostechnikai eszközt gyárt-e.
miután osztályozta az eszközt a specialitás szerint, az FDA arra utasítja a gyártókat, hogy folytassák a premarket értesítést azzal a tudattal, hogy eszközük mentes-e vagy sem. Az I. osztályú orvostechnikai eszközök-a legkevésbé kockázatos és invazív kategória-mentesülnek a piac előtti értesítési folyamatok alól. A speciális II. osztályú eszközök szintén mentesülnek a premarket-jóváhagyás alól.,
azonban az FDA által szabályozott összes eszközre a helyes gyártási gyakorlat (cGMP) jelenlegi követelményei vonatkoznak a regisztrációra, a címkézésre és a minőségre. De honnan tudod, hogy a készüléked I. vagy II. osztályú-e, és hogy premarket értesítésen kell-e átesned? 
Class 1
Az amerikai FDA meghatározza i. Osztályú eszközök olyan eszközök, amelyek “nem szánt a támogató, vagy az élet fenntartásához, vagy jelentős fontos, hogy megakadályozzák a károsodás az emberi egészséget, de lehet, hogy nem potenciálisan indokolatlan kockázatot a betegség vagy sérülés.,”
Ezek az eszközök az FDA által szabályozott eszközök leggyakoribb osztálya, amely a piacon jóváhagyott eszközök 47% – át teszi ki.
I. osztályú készülékek minimális mértékben érintkeznek a betegekkel, és kis mértékben befolyásolják a beteg általános egészségi állapotát. Általában az I. osztályú eszközök nem érintkeznek a beteg belső szerveivel, a központi idegrendszerrel vagy a kardiovaszkuláris rendszerrel. Ezek az eszközök a legkevesebb szabályozási követelménynek vannak kitéve.,
Példák az i. Osztályba sorolt Eszközök:
- Elektromos Fogkefe
- spatula
- Oxigén Maszkot
- Újrafelhasználható Sebészeti Szikével
- Kötés
- Kórházi Ágyak
Hozza i. Osztályú Orvostechnikai Eszközök Piaci
I. osztályú készülékek a leggyorsabb, valamint legegyszerűbb felhívni piacon, mivel ők jelenleg a legalacsonyabb összeget a veszélye, hogy a beteg, illetve ritkán fontos, hogy az életet fenntartó érdekel. Az I. osztályú készülékek többsége mentesül a Premarket értesítésre (510K) és a Premarket jóváhagyásra (PMA) vonatkozó FDA-követelmények alól.,
Az I. osztályú eszközök nem mentesülnek az FDA általános vezérlései alól, az I., II.és III. osztályú orvostechnikai eszközökre vonatkozó parancsok sorozata. E törvény rendelkezései a házasságtörésre, a hamis megjelölésre, az eszköz regisztrálására, a nyilvántartásokra és a helyes gyártási gyakorlatra vonatkoznak. Az A osztályba tartozó orvostechnikai eszközgyártóknak továbbra is minőségirányítási rendszert kell bevezetniük, és a minőségi termék biztosítása érdekében be kell tartaniuk a szabványokat.,
kapcsolódó olvasat: A Premarket Notification 510(k) és a Premarket jóváhagyás közötti különbség
2.osztály
II. osztályú orvostechnikai eszközök bonyolultabbak, mint az I. osztályú eszközök, és magasabb kockázati kategóriát mutatnak, mivel nagyobb valószínűséggel kerülnek tartós kapcsolatba a beteggel. Ez magában foglalhatja eszközök, amelyek érintkezésbe kerülnek a beteg kardiovaszkuláris rendszer vagy a belső szervek, valamint diagnosztikai eszközök.,
Az FDA a II.osztályú eszközöket “olyan eszközként határozza meg, amelyeknél az Általános vezérlők nem elegendőek az eszköz biztonságosságának és hatékonyságának ésszerű biztosításához.,est Készletek
Hozza II. Osztályú Orvosi Eszközök Piaci
Vezérlők változhat, attól függően, hogy a készülék, de az FDA szerint, a következők:
- a Készülék teljesítményét
- Postmarket felügyeleti
- Beteg nyilvántartások
- Speciális címkézési követelmények
- Premarket adatok követelmények
- Iránymutatás
A legtöbb Osztály II eszközök FDA által jóváhagyott, a piacon át a Premarket Értesítést, vagy 510(k) folyamat.,
A II. osztályú készülékekre a fent említett általános ellenőrzések vonatkoznak, de az FDA úgy határozza meg őket, hogy “olyan eszközök, amelyekre az Általános ellenőrzések nem elegendőek az eszköz biztonságának és hatékonyságának ésszerű biztosításához.”Ezért a II. osztályú eszközöket speciális vezérlők is alávetik. Ezek az előírások az eszköztől függenek, és tartalmazhatnak speciális címkézési követelményeket, betegnyilvántartásokat és teljesítményszabályokat.
a legtöbb II. osztályú eszköz a Premarket Notification (510K) eljárással kerül forgalomba., Az 510 (k) egy összetett alkalmazás az FDA számára, amely bizonyítja, hogy egy eszköz biztonságos és hatékony, bizonyítva, hogy az eszköz egyenértékű egy másik, a piacon lévő eszközzel.
Ez a folyamat magában foglalja a “jelentős egyenértékűség” bemutatását egy másik eszközzel, amelyet az FDA szóhasználatában “predikátumnak” neveznek.”Ez nem jelenti azt, hogy az eszközöknek azonosnak kell lenniük, de jelentős hasonlóságokat igényelnek a használat, a tervezés, az anyagok, a címkézés, a szabványok és más jellemzők terén.,
az FDA 2018 elején kiadott egy mentességi listát, amely több mint 800 általános I. és II. osztályú orvostechnikai eszközt mentesít az 510(k) eljárás alól. Ha van egy általános Class II orvostechnikai eszköz, akkor felfedezheti, hogy mentesül a 510 (k) bejelentés keresve az FDA termék osztályozási adatbázis.
kapcsolódó olvasmány: 5 ok az FDA 510(k) átdolgozása nagyszerű lépés.
3. osztály
az FDA a III. osztályú eszközöket olyan termékekként határozza meg, amelyek “általában fenntartják vagy támogatják az életet, beültetik vagy potenciálisan ésszerűtlen betegség vagy sérülés kockázatát jelentik.,”
Az amerikai FDA által szabályozott eszközök mindössze 10 százaléka tartozik a III. osztályba. ezt a besorolást általában kiterjesztik az állandó implantátumokra, az intelligens orvostechnikai eszközökre és az életmentő rendszerekre.
míg a III. osztályt általában a leginnovatívabb és legmodernebb orvostechnikai eszközök számára tartják fenn, vannak más eszközök is, amelyek különböző okokból a III.osztályba tartozhatnak., Egyes, kezdetben II. osztályba sorolt eszközök a III. osztályba sorolhatók, ha a gyártó a PMA (510K) bejelentési folyamat során nem képes jelentős egyenértékűséget mutatni egy predikátummal (meglévő termékkel).,
Példa III. Osztályú Orvosi Eszközök:
- Mell implantátumok
- szívritmus-szabályozók
- Defibrillátorok
- Magas frekvenciájú ventilátorok
- a Cochlearis implantátumok
- a Magzati vérvétel, monitorok
- a Beültetett protézis
Hozza III. Osztályú Orvosi Eszközök Piaci
Osztály III. eszközökre vonatkoznak, minden FDA Általános Ellenőrzések, valamint az FDA Premarket Jóváhagyása (PMA) folyamat., Az FDA azt írja: “mivel a kockázat szintje kapcsolódó Class III eszközök, FDA megállapította, hogy az általános és speciális ellenőrzések önmagukban nem elegendőek, hogy biztosítsa a biztonságot és hatékonyságát Class III eszközök.”
a PMA az FDA által megkövetelt legintenzívebb eszközmarketing alkalmazás. Egyes FDA III. osztályú készülékek mentesek, és jogosultak lehetnek egy 510 (k) bejelentés, de a többség várhatóan szerezni Premarket jóváhagyás.,
a PMA-folyamat megköveteli egy orvostechnikai eszköz szigorú vizsgálatát a biztonság és a hatékonyság bizonyítására egy adatvezérelt előny / kockázat profil kifejlesztése révén. A PMA-folyamat általában magában foglalja a klinikai vizsgálatokat, valamint a megfelelő adatgyűjtéshez szükséges jelentős időt és erőforrásokat. Az egyetlen kivétel a PMA folyamat belül Class III eszközök jelentős egyenértékű. Az FDA Premarket jóváhagyási(PMA) adatbázisának és az 510 (k) Premarket értesítési adatbázisnak a segítségével meghatározható, hogy egy III.osztályú eszköz forgalmazható-E 510(k) értékkel.,
Hogyan állapítható meg az osztály
az orvosi eszköz osztályozásának első lépése az FDA osztályozási előírásainak navigálása, az orvosi eszközök 16 kategóriájának listája az orvosi specializáció szerint.
példaként, megmutatjuk a lépéseket, hogy azonosítsa a besorolás a vérnyomás riasztás. A készüléket a 870. kategóriába sorolják: kardiovaszkuláris eszközök.,
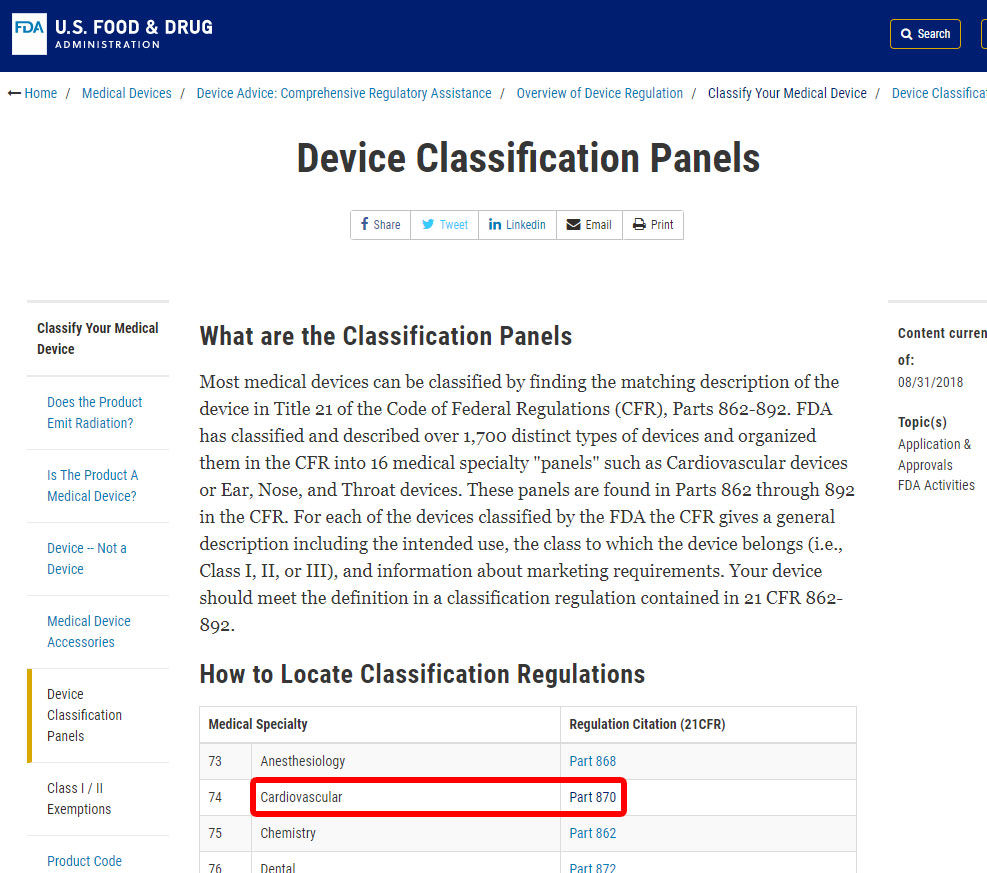
miután megtalálta a megfelelő orvosi specialitást, kattintson a kategóriára, és keresse meg az eszközök listáját, amíg meg nem találja az egyenértéket és a kapcsolódó eszközkódot.
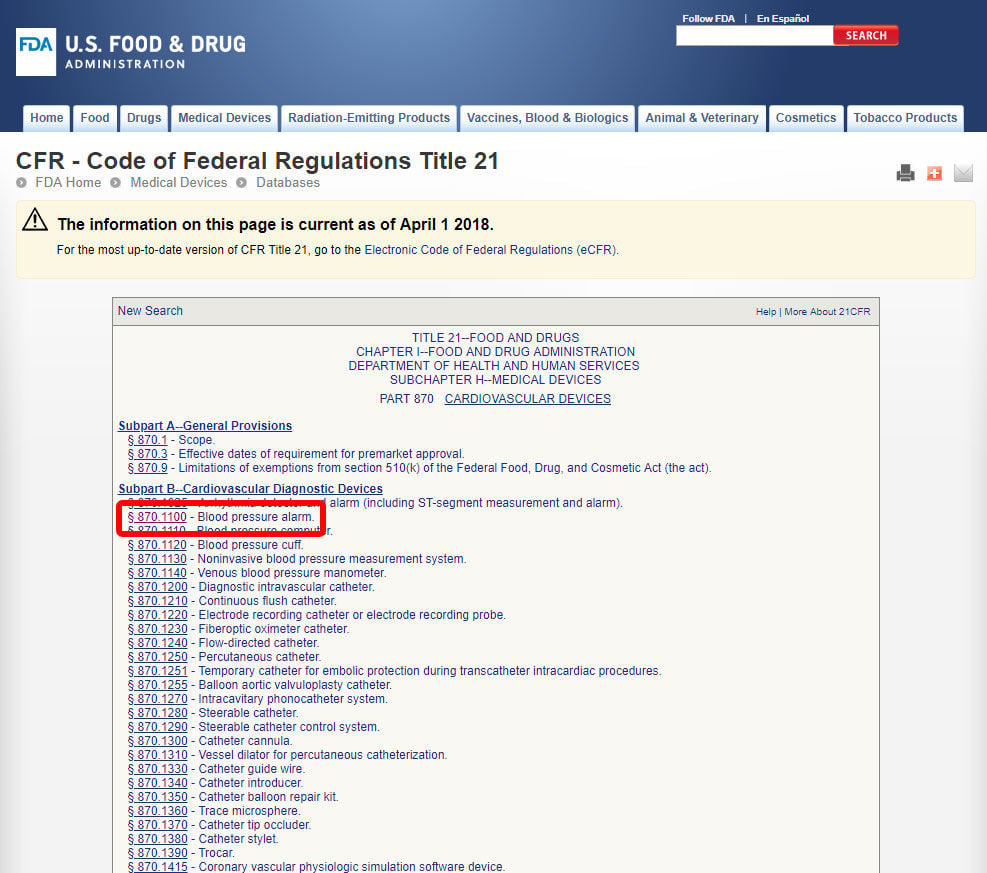
kattintson az eszköz kódjára és nyissa meg az irányelveket. Az eszköz osztályozása A B) pontban található.,
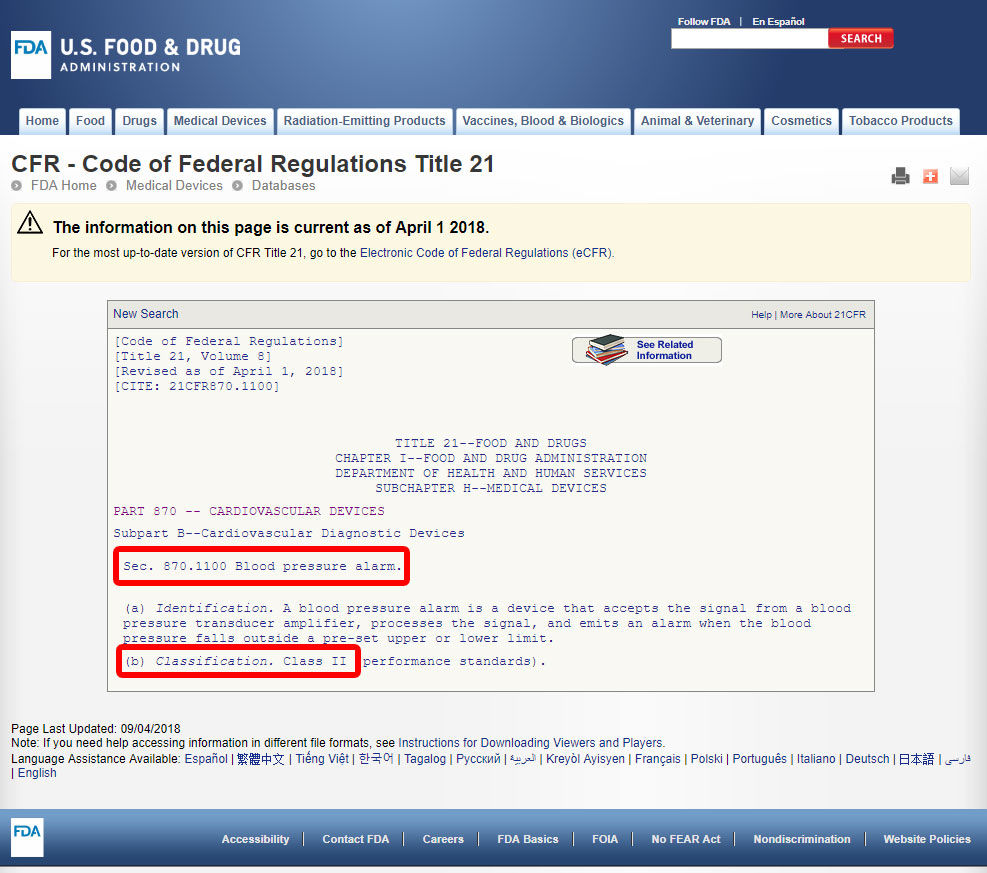
Ha a készülék nem rendelkezik a felsorolt egyenértékű között a 1,700 eszközök besorolni, az FDA, az a legvalószínűbb, hogy egy innovatív eszköz nélkül jelentős egyenértékű lenne Osztályba sorolt III.
Megértése FDA Orvostechnikai Eszköz Osztályok
A különbség Osztályba sorolt orvostechnikai eszközök i., II., vagy III., az FDA, az a leginkább kockázat összegét a kapcsolatot egy beteg, valamint a belső rendszerek, valamint attól, hogy az eszköz kritikus, hogy az élet fenntartásához.,
ezen tényezők mellett az FDA jelentős egyenértékűséget is figyelembe vesz az eszköz besorolásának meghatározásakor. Ha a készülék alacsony kockázatú, és minimálisan érintkezik a beteggel, akkor valószínűleg jogosult lesz az I. osztályra és egy egyszerűsített piac-jóváhagyási eljárásra. A II. és III. osztályú berendezéseknek anyagi egyenértékűséggel, 510(k) bejelentéssel vagy a piac előtti jóváhagyási eljárással kell bizonyítaniuk a biztonságot.
a készülék besorolásának ismeretében egyszerűsítheti a piaci jóváhagyáshoz vezető utat az FDA által valószínűleg megkövetelt folyamatok és dokumentumok megértésével., Ha szervezete II. vagy III. osztályú 510(k) vagy PMA követelménynek van kitéve, ez a tudás segíthet a megfelelő erőforrások előzetes elosztásában, valamint a sikeres bejelentés megtervezésében.
