10.6: Roosterstructuren in kristallijne vaste stoffen
eenheidscellen van metalen
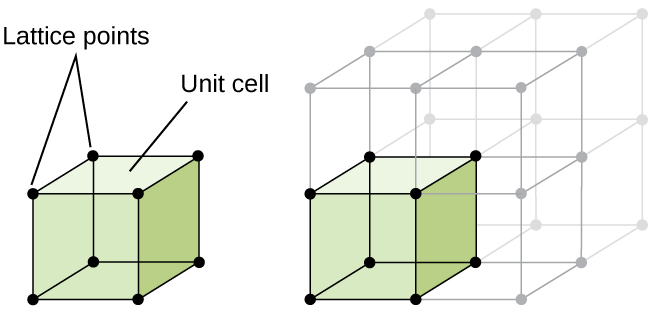
de structuur van een kristallijne vaste stof, al dan niet een metaal, kan het best worden beschreven door rekening te houden met de eenvoudigste herhalende eenheid, die de eenheidscel wordt genoemd. De eenheidscel bestaat uit roosterpunten die de locaties van atomen of ionen vertegenwoordigen. De gehele structuur bestaat dan uit deze eenheidscel die zich herhaalt in drie dimensies, zoals geïllustreerd in Figuur \(\Paginindex{1}\).,
laten we beginnen met ons onderzoek naar kristalrooster structuur en eenheid cellen met de meest eenvoudige structuur en de meest elementaire eenheid cel. Om dit te visualiseren, stel je voor dat je een groot aantal identieke bollen, zoals tennisballen, neemt en ze uniform in een container schikt., De eenvoudigste manier om dit te doen zou zijn om lagen te maken waarin de bollen in één laag zich direct boven die in de laag eronder bevinden, zoals afgebeeld in Figuur \(\Paginindex{2}\). Deze regeling wordt eenvoudige kubieke structuur genoemd, en de eenheidscel wordt de eenvoudige kubieke eenheidscel of primitieve kubieke eenheidscel genoemd.
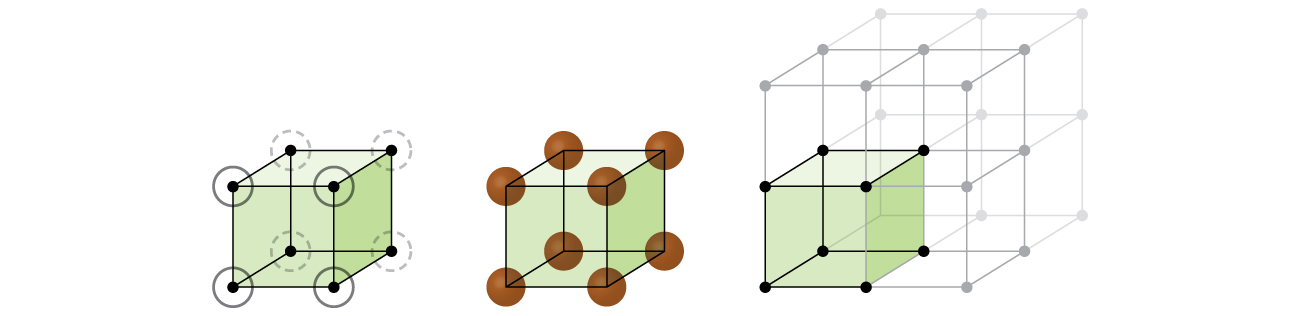
In een eenvoudige kubieke structuur zijn de bollen niet zo dicht verpakt als ze zouden kunnen zijn, en ze” vullen ” slechts ongeveer 52% van het volume van de container. Dit is een relatief inefficiënte opstelling, en slechts één metaal (polonium, Po) kristalliseert in een eenvoudige kubieke structuur. Zoals te zien is in Figuur \(\Paginindex{3}\), bestaat een vaste stof met dit soort opstelling uit vlakken (of lagen) waarin elk atoom slechts de vier dichtstbijzijnde buren in zijn laag raakt; één atoom direct erboven in de laag erboven; en één atoom direct eronder in de laag eronder., Het aantal andere deeltjes dat elk deeltje in een kristallijne vaste stof contacteert staat bekend als zijn coördinatiegetal. Voor een polonium-atoom in een eenvoudige kubieke array is het coördinatiegetal dus zes.

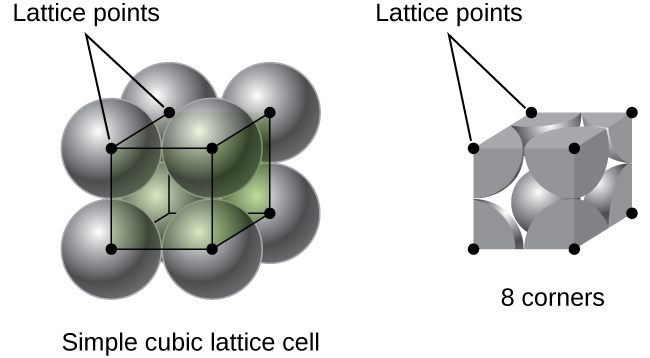
In een enkel kubisch rooster is de eenheidscel die zich in alle richtingen herhaalt een kubus die wordt gedefinieerd door de centra van acht atomen, zoals weergegeven in Figuur \(\Paginindex{4}\). Atomen op aangrenzende hoeken van deze eenheidscel contacteren elkaar, dus de randlengte van deze cel is gelijk aan twee atoomstralen, of een atoomdiameter. Een kubieke eenheidscel bevat alleen de delen van deze atomen die erin zitten. Aangezien een atoom in een hoek van een eenvoudige kubieke eenheidscel in totaal acht eenheidscellen bevat, bevindt slechts een achtste van dat atoom zich binnen een specifieke eenheidscel., En aangezien elke eenvoudige kubieke eenheidscel één atoom heeft op elk van zijn acht “hoeken”, is er \(8×\dfrac{1}{8}=1\) atoom binnen een eenvoudige kubieke eenheid cel.
De meeste metaalkristallen zijn een van de vier belangrijkste typen eenheidscellen., Voor nu zullen we ons richten op de drie kubieke eenheidscellen: eenvoudige kubieke (die we al hebben gezien), lichaam-gecentreerde kubieke eenheidscel, en gezicht-gecentreerde kubieke eenheidscel—die allemaal worden geïllustreerd in Figuur \(\Paginindex{5}\). (Merk op dat er eigenlijk zeven verschillende roostersystemen zijn, waarvan sommige meer dan één type rooster hebben, voor een totaal van 14 verschillende soorten eenheidscellen. We laten de meer ingewikkelde geometrieën voor later in deze module.,)
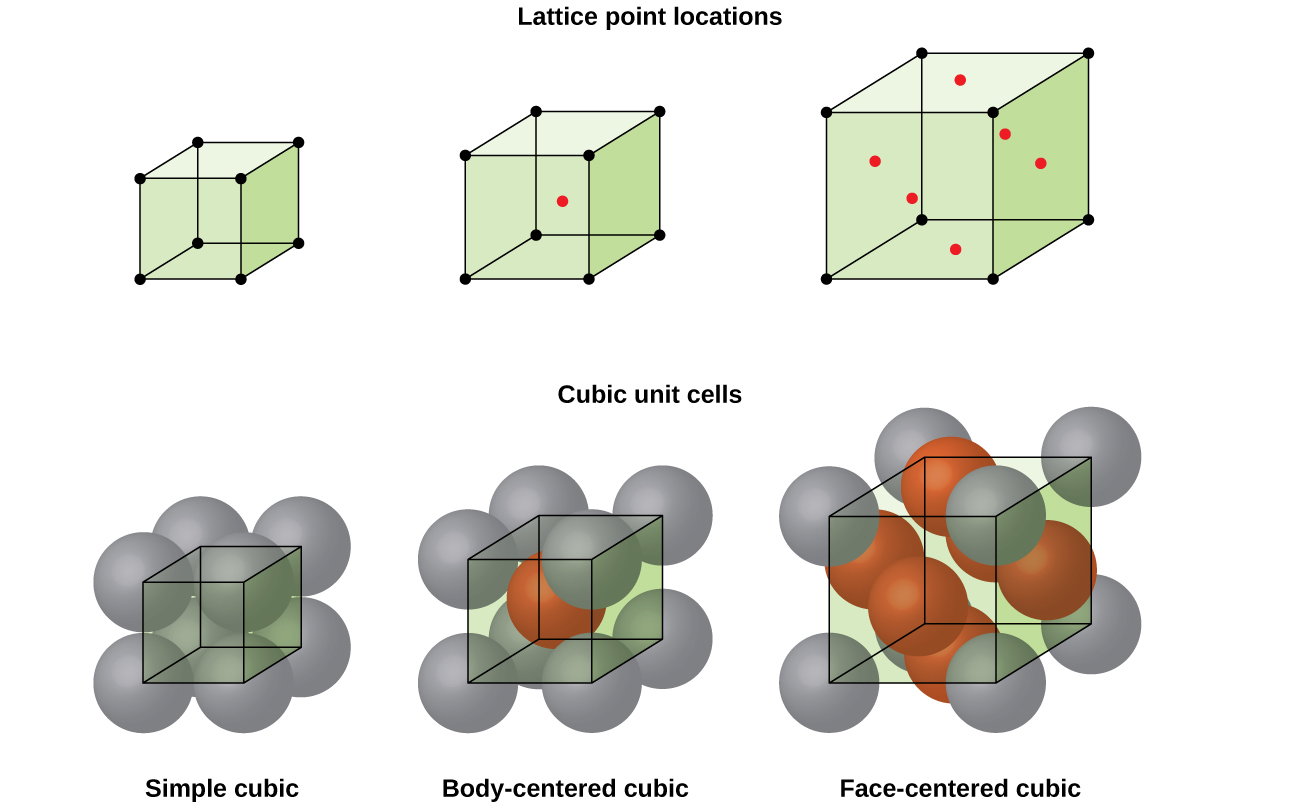
sommige metalen kristalliseren in een opstelling met een kubieke eenheidscel met atomen op alle hoeken en een atoom in het midden, zoals weergegeven in Figuur \(\Paginindex{6}\). Dit wordt een lichaam-gecentreerde kubieke (BCC) vaste stof genoemd., Atomen in de hoeken van een BCC-eenheidscel maken geen contact met elkaar, maar met het atoom in het midden. Een BCC-eenheidscel bevat twee atomen: een achtste atoom op elk van de acht hoeken (\(8×\dfrac{1}{8}=1\) atoom uit de hoeken) plus een atoom uit het midden. Elk atoom in deze structuur raakt vier atomen in de laag erboven en vier atomen in de laag eronder. Zo heeft een atoom in een BCC-structuur een coördinatiegetal van acht.,
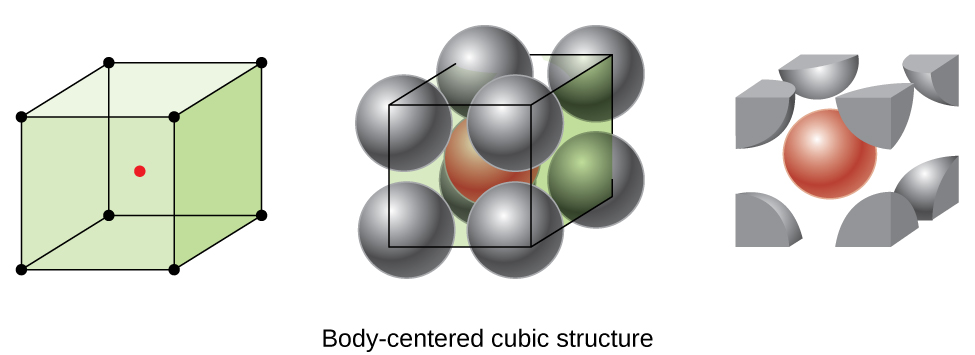
atomen in BCC-arrangementen zijn veel efficiënter verpakt dan in een eenvoudige kubieke structuur en nemen ongeveer 68% van het totale volume in beslag. Isomorfe metalen met een BCC-structuur omvatten K, Ba, Cr, Mo, W en Fe bij kamertemperatuur., (Elementen of samenstellingen die kristalliseren met dezelfde structuur worden gezegd dat ze isomorf zijn.)
vele andere metalen, zoals aluminium, koper en lood, kristalliseren in een opstelling die een kubieke eenheidscel heeft met atomen op alle hoeken en in het midden van elk vlak, zoals geïllustreerd in Figuur \(\Pagindex{7}\). Dit arrangement wordt een face-centered cubic (FCC) solid genoemd., Een FCC-eenheidscel bevat vier atomen: een achtste atoom op elk van de acht hoeken (\(8×\dfrac{1}{8}=1\) atoom uit de hoeken) en de helft van een atoom op elk van de zes vlakken (\(6×\dfrac{1}{2}=3\) atomen van de gezichten). De atomen in de hoeken raken de atomen in het centrum van de aangrenzende vlakken langs de diagonalen van de kubus. Omdat de atomen zich op identieke roosterpunten bevinden, hebben ze identieke omgevingen.
atomen in een FCC-opstelling zijn zo dicht mogelijk bij elkaar verpakt, waarbij atomen 74% van het volume innemen., Deze structuur wordt ook wel kubieke dichtstbijzijnde verpakking (CCP) genoemd. In CCP, zijn er drie zich herhalende lagen van hexagonaal gerangschikt atomen. Elk atoom komt in contact met zes atomen in zijn eigen laag, drie in de laag erboven en drie in de laag eronder. In deze opstelling raakt elk atoom 12 naaste buren, en heeft daarom een coördinatiegetal van 12. Het feit dat FCC-en CCP-regelingen gelijkwaardig zijn is misschien niet meteen duidelijk, maar waarom ze eigenlijk dezelfde structuur hebben wordt geïllustreerd in Figuur \(\Paginindex{8}\).,
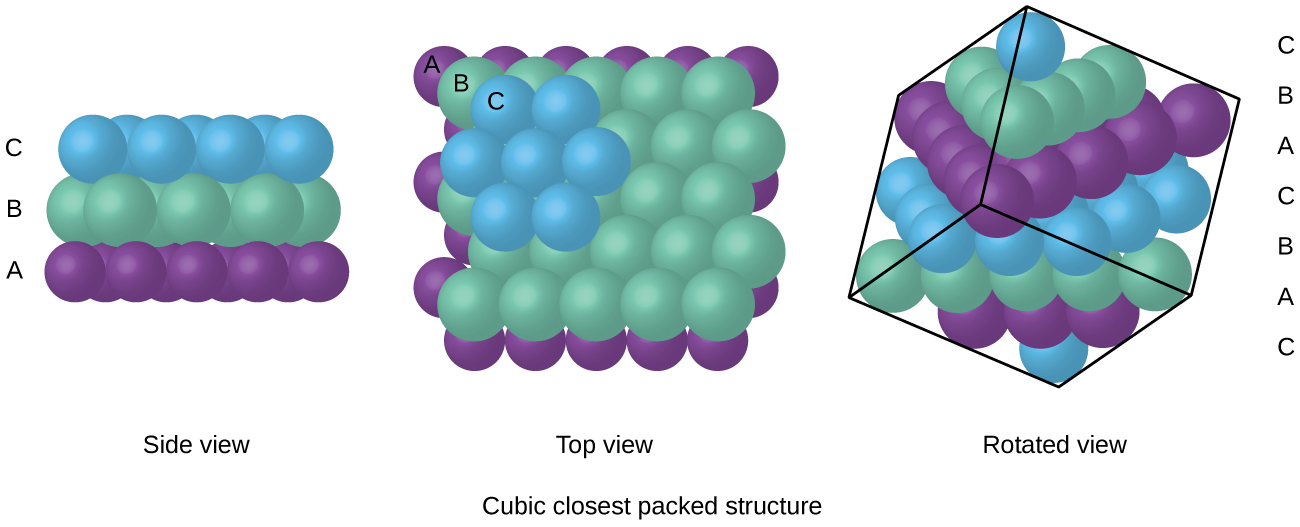
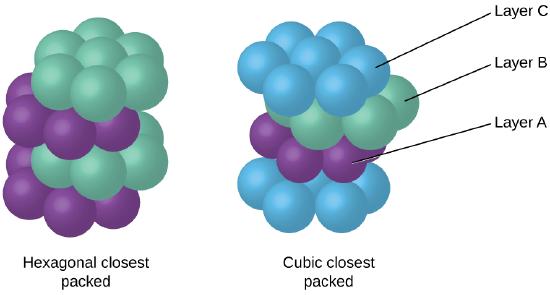
omdat dichterbij verpakken de totale aantrekkingskracht tussen atomen maximaliseert en de totale intermoleculaire energie minimaliseert, verpakken de atomen in de meeste metalen op deze manier., We vinden twee soorten dichtstbijzijnde verpakking in eenvoudige metallic kristallijne structuren: CCP, die we al hebben ontmoet, en hexagonale dichtstbijzijnde verpakking (HCP) weergegeven in Figuur \(\Paginindex{9}\). Beide bestaan uit herhalende lagen van zeshoekige geordende atomen. In beide typen wordt een tweede laag (B) op de eerste laag (A) geplaatst, zodat elk atoom in de tweede laag in contact komt met drie atomen in de eerste laag. De derde laag wordt op twee manieren geplaatst. In HCP zijn atomen in de derde laag direct boven atomen in de eerste laag (d.w.z.,, de derde laag is ook type A), en het stapelen bestaat uit afwisselend type A en type B close-packed lagen (dat wil zeggen, ABABAB⋯). In CCP, atomen in de derde laag zijn niet boven atomen in een van de eerste twee lagen (dat wil zeggen, de derde laag is type C), en het stapelen bestaat uit afwisselend type A, Type B, en Type C close-packed lagen (dat wil zeggen, ABCABCABC⋯). Ongeveer twee derde van alle metalen kristalliseren in dichtsbijzijnde arrays met coördinatiegetallen van 12., Metalen die kristalliseren in een HCP-structuur omvatten Cd, Co, Li, Mg, Na en Zn, en metalen die kristalliseren in een CCP-structuur omvatten Ag, Al, Ca, Cu, Ni, Pb en Pt.
oefening \(\Paginindex{2}\)
Zilver kristalliseert in een FCC-structuur. De randlengte van de eenheidscel is 409 pm.
- Wat is de atoomstraal van Ag in deze structuur?
- Bereken de dichtheid van Ag.
Antwoord a
144 pm
antwoord b
10.5 g / cm3
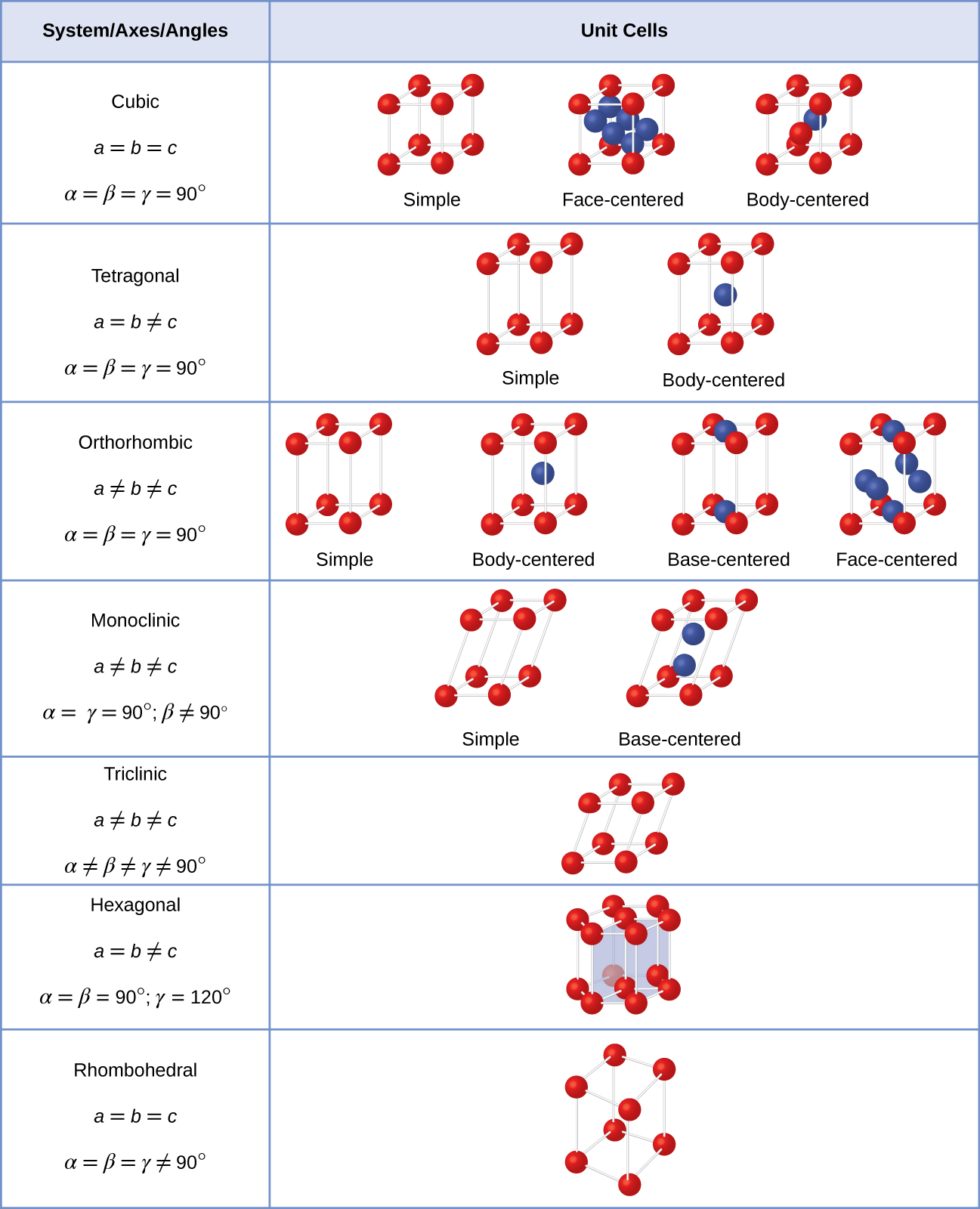
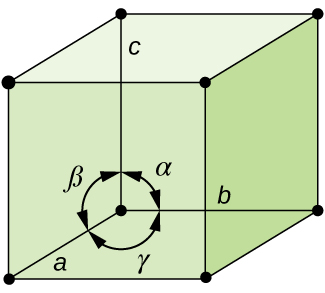
in het algemeen wordt een eenheidscel gedefinieerd door de lengtes van drie assen (a, b en c) en de hoeken (α, β en γ) daartussen, zoals geïllustreerd in Figuur \(\Paginindex{10}\)., De assen worden gedefinieerd als de lengtes tussen de punten in het ruimterooster. Bijgevolg verbinden eenheidscelassen punten met identieke omgevingen.
Er zijn zeven verschillende roostersystemen, waarvan sommige meer dan één type rooster hebben, voor een totaal van veertien verschillende eenheidscellen, die de vormen hebben die in Figuur \(\Paginindex{11}\) worden getoond.