onderste en Bovenste explosiegrens voor ontvlambare gassen en dampen


Wat is %LEL / %UEL / PID
voordat een brand of explosie kan plaatsvinden, moet aan drie voorwaarden tegelijkertijd worden voldaan.
Een brandstof (d.w.z. brandbaar gas) en zuurstof (lucht) moeten in bepaalde verhoudingen bestaan, samen met een ontstekingsbron, zoals een vonk of vlam., De verhouding brandstof en zuurstof die nodig is varieert met elk brandbaar gas of damp.
de minimumconcentratie van een bepaald brandbaar gas of damp die nodig is om de verbranding ervan in de lucht te ondersteunen, wordt gedefinieerd als De Onderste explosiegrens (Lel) voor dat gas. Onder dit niveau is het mengsel te “mager” om te verbranden. De maximale concentratie van een gas of damp die in de lucht zal branden, wordt gedefinieerd als de Upper Explosive Limit (UEL). Boven dit niveau is het mengsel te “rijk” om te verbranden. Het bereik tussen de LEL en UEL staat bekend als het brandbare bereik voor dat gas of damp.,
methaan – Lel: 5 volumeprocent in lucht / UEL: 17 volumeprocent in lucht
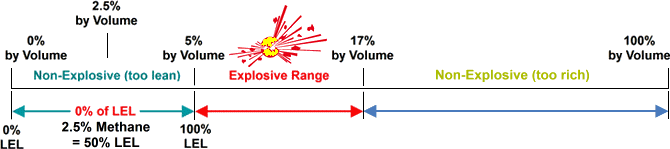
visueel voorbeeld om aan te geven waar op de schaal% van LEL wordt gemeten
onderste en bovenste Explosiegrenzen
de waarden in onderstaande tabel gelden alleen voor de omstandigheden waaronder zij werden bepaald (gewoonlijk kamertemperatuur en atmosferische druk met behulp van een 2 inch buis met vonkontsteking). Het ontvlambaarheidsbereik van de meeste materialen breidt uit naarmate de temperatuur, druk en de diameter van de container toenemen. Alle concentraties in volumeprocent.,
| Gas | LEL | UEL |
| Acetone | 2.6 | 13 |
| Acetylene | 2.5 | 100 |
| Acrylonitrile | 3 | 17 |
| Allene | 1.5 | 11.5 |
| Ammonia | 15 | 28 |
| Benzene | 1.3 | 7.9 |
| 1.3 Butadiene | 2 | 12 |
| Butane | 1.8 | 8.4 |
| n Butanol | 1.,7 | 12 |
| 1 Butene | 1.6 | 10 |
| Cis 2 Butene | 1.7 | 9.7 |
| Trans 2 Butene | 1.7 | 9.7 |
| Butyl Acetate | 1.4 | 8 |
| Carbon Monoxide | 12.5 | 74 |
| Carbonyl Sulfide | 12 | 29 |
| Chlorotrifluoro ethylene | 8.4 | 38.7 |
| Cumene | 0.9 | 6.5 |
| Cyanogen | 6.6 | 32 |
| Cyclohexane | 1.,3 | 7.8 |
| Cyclopropane | 2.4 | 10.4 |
| Deuterium | 4.9 | 75 |
| Diborane | 0.8 | 88 |
| Dichlorosilane | 4.1 | 98.8 |
| Diethylbenzene | 0.8 | |
| 1.1 Difluoro 1 Chloroethane | 9 | 14.8 |
| 1.1 Difluoroethane | 5.1 | 17.1 |
| 1.1 Difluoro ethylene | 5.5 | 21.3 |
| Dimethylamine | 2.8 | 14.,4 |
| Dimethyl Ether | 3.4 | 27 |
| 2.2 Dimethyl propane | 1.4 | 7.5 |
| Ethane | 3 | 12.4 |
| Ethanol | 3.3 | 19 |
| Ethyl Acetate | 2.2 | 11 |
| Ethyl Benzene | 1 | 6.7 |
| Ethyl Chloride | 3.8 | 15.4 |
| Ethylene | 2.7 | 36 |
| Ethylene Oxide | 3.6 | 100 |
| Gasoline | 1.2 | 7.,1 |
| Heptane | 1.1 | 6.7 |
| Hexane | 1.2 | 7.4 |
| Hydrogen | 4 | 75 |
| Hydrogen Cyanide | 5.6 | 40 |
| Hydrogen Sulfide | 4 | 44 |
| Isobutane | 1.8 | 8.4 |
| Isobutylene | 1.8 | 9.6 |
| Isopropanol | 2.2 | |
| Methane | 5 | 17 |
| Methanol | 6.,7 | 36 |
| Methylac etylene | 1.7 | 11.7 |
| Methyl Bromide | 10 | 15 |
| 3 Methyl 1 Butene | 1.5 | 9.1 |
| Methyl Cellosolve | 2.5 | 20 |
| Methyl Chloride | 7 | 17.4 |
| Methyl Ethyl Ketone | 1.9 | 10 |
| Methyl Mercaptan | 3.9 | 21.8 |
| Methyl Vinyl Ether | 2.6 | 39 |
| Monoethy lamine | 3.,5 | 14 |
| Monomethy lamine | 4.9 | 20.7 |
| Nickel Carbonyl | 2 | |
| Pentane | 1.4 | 7.8 |
| Picoline | 1.4 | |
| Propane | 2.1 | 9.5 |
| Propylene | 2.4 | 11 |
| Propylene Oxide | 2.8 | 37 |
| Styrene | 1.,1 | |
| Tetrafluoro ethylene | 4 | 43 |
| Tetrahydrofuran | 2 | |
| Toluene | 1.2 | 7.1 |
| Trichloro ethylene | 12 | 40 |
| Trimethylamine | 2 | 12 |
| Turpentine | 0.7 | |
| Vinyl Acetate | 2.6 | |
| Vinyl Bromide | 9 | 14 |
| Vinyl Chloride | 4 | 22 |
| Vinyl Fluoride | 2.6 | 21.,7 |
| xyleen | 1.1 | 6.6 | Gas | LEL | EL |
beginselen van gasdetectie
een van de vele vereisten voor het betreden van besloten ruimten is de meting van ontvlambare gassen. Voordat een afgesloten ruimte wordt betreden, moet het niveau van brandbare gassen lager zijn dan 10% van LEL.
De meest gebruikte sensor voor het meten van LEL is de Wheatstone bridge/catalytic bead/pellistor sensor (“Wheatstone bridge”).,
Lel sensoren uitgelegd
een Wheatstone bridge Lel sensor is gewoon een kleine elektrische kachel met twee branderelementen. Eén element heeft een katalysator (zoals platina) en één niet. beide elementen worden verwarmd tot een temperatuur die normaal gesproken geen verbranding zou ondersteunen.
echter, het element met de katalysator “verbrandt” gas op een laag niveau en warmt op ten opzichte van het element zonder de katalysator. Het hetere element heeft meer weerstand en de Wheatstone Brug meet het verschil in weerstand tussen de twee elementen, wat correleert met LEL.,

helaas falen Wheatstone-brugsensoren in een onveilige toestand; wanneer ze falen, geven ze veilige niveaus van ontvlambare gassen aan. Storing en / of vergiftiging van Wheatstone bridge LEL sensor kan alleen worden bepaald door uitdagende Wheatstone bridge sensoren met kalibratiegas.,
Lel-sensoren beperkingen
twee mechanismen beïnvloeden de prestaties van Wheatstone bridge Lel-sensoren en verminderen hun effectiviteit wanneer ze worden toegepast op alle sensoren behalve methaan:
- gassen branden met verschillende warmteafvoer
Sommige gassen branden heet en sommige branden relatief koel. Deze verschillende fysieke kenmerken leiden tot problemen bij het gebruik van Lel-sensoren. Bijvoorbeeld, 100% LEL methaan (5% methaan in volume) brandt met tweemaal de warmte van 100% LEL propaan (2,0 propaan in volume).,zwaardere koolwaterstofdampen hebben moeite met diffunderen in Lel-sensoren en verminderen hun output sommige zwaardere koolwaterstofdampen hebben moeite met diffunderen door de gesinterde metalen vlamdover op Lel-sensoren. Deze vlamdover is nodig om te voorkomen dat de sensor zelf brand veroorzaakt en voorkomt niet dat gassen zoals methaan, propaan en ethaan de Wheatstone bridge bereiken. Koolwaterstoffen zoals benzine, diesel, oplosmiddelen, enz. diffunderen echter langzamer door de vlamdover zodat minder damp de Wheatstone-brug bereikt en de sensor minder output geeft.,
waarom geen Lel-Monitor gebruiken?
veel vluchtige organische stoffen (Vos) zijn ontvlambaar en kunnen worden gedetecteerd door de LEL-of brandbare gassensoren die in vrijwel elke multigas-monitor worden aangetroffen. LEL-sensoren zijn echter niet bijzonder nuttig bij het meten van toxiciteit omdat ze niet voldoende gevoeligheid hebben.
Wat zijn enkele veel voorkomende VOC ‘ s?,
Vos zijn de chemische verbindingen die de industrie draaiende houden en omvatten:
- brandstoffen
- oliën, reagentia, Warmteoverdrachtsvloeistoffen
- oplosmiddelen, verven
- kunststoffen, harsen en hun precursoren
- en vele andere
vos komen in de hele industrie voor, van de voor de hand liggende toepassingen in de petrochemie-industrie tot niet voor de hand liggende toepassingen zoals de productie van worst.

wat wordt bedoeld met PPM?
Parts per million (ppm) is een veelgebruikte concentratie-eenheid voor kleine waarden., Een deel per miljoen is een deel van opgeloste stof per een miljoen delen oplosmiddel of 10-6. Delen per miljoen en andere” delen per ” notaties (bijvoorbeeld delen per miljard of delen per biljoen) zijn dimensieloze hoeveelheden zonder eenheden. Aanbevolen methoden voor het uitdrukken van delen per miljoen omvatten µV/V (microvolume per volume), µL/L (microliter per liter), mg/kg (milligram per kilogram), µmol/mol (micromol per mol) en µm / m (micrometer per meter).,
De” parts per ” – notatie wordt gebruikt om verdunde oplossingen in de chemie en engineering te beschrijven, maar de betekenis ervan is dubbelzinnig en maakt geen deel uit van het SI-meetsysteem. De reden dat het systeem dubbelzinnig is, is omdat de concentratie afhangt van de oorspronkelijke eenheidsfractie die wordt gebruikt. Bijvoorbeeld, het vergelijken van een milliliter van een monster tot een miljoen milliliter is anders dan het vergelijken van een mol tot een miljoen mol of een gram tot een miljoen gram.
De Universiteit van Minnesota biedt een aantal andere analogieën die u kunnen helpen de schaal te visualiseren die betrokken is bij PPM.,
Een ppm is als:
- een duim 16 km
- een tweede in 11.5 dagen
- een minuut in twee jaar
- een auto in bumper aan bumper verkeer van Cleveland naar San Francisco
Andere visualisatie van schaal betrokken bij PPB
Een PPB is als:
- het toevoegen van een snufje zout tot een 10 ton zak chips
- Een ppb is als een blad in een rol wc-papier die zich uitstrekt van New York naar Londen.,
Lel-sensoren meten de explosiviteit, niet de toxiciteit
Lel-sensoren meten het percentage LEL. Benzine heeft bijvoorbeeld een LEL van 1,4%. Daarom is 100% van LEL 14.000 ppm benzine, 10% van LEL 1400 ppm benzine en 1% van LEL 140 ppm benzine.
140 ppm benzine is de laagste hoeveelheid damp die de LEL-monitor kan zien.”Benzine heeft een TWA van 300 ppm en een STEL van 500 ppm; dit maakt LEL-sensoren niet geschikt voor het meten van benzinedampen, omdat ze simpelweg geen adequate resolutie bieden.
Lel-sensoren meten explosiviteit, niet toxiciteit., Veel Vos zijn potentieel giftig Bij niveaus die ver onder hun explosieve niveaus en onder de gevoeligheid van de LEL-sensoren liggen.
zoals hierboven beschreven:
een van de vele eisen voor het betreden van besloten ruimten genoemd is de meting van besloten ruimten voor ontvlambare gassen.
voordat een besloten ruimte wordt betreden, moet het niveau van brandbare gassen lager zijn dan 10% van LEL.
De meest gebruikte sensor voor het meten van LEL is de Wheatstone bridge/catalytic bead/pellistor sensor (“Wheatstone bridge”).,
hoewel nuttig in een breed scala van toepassingen, in sommige instellingen Wheatstone bridge Lel sensoren hebben ofwel niet genoeg gevoeligheid voor een bepaalde chemische stof, of chemicaliën gebruikt in het milieu kan de Wheatstone bridge sensor onbruikbaar maken.
in dit soort omstandigheden kunnen PIDs (foto-ionisatiedetectoren) een alternatieve, zeer nauwkeurige en gifvrije methode bieden om 10% van LEL te meten voor het binnendringen van besloten ruimten.

Wat is een PID?,
een foto-Ionisatiedetector meet Vos en andere giftige gassen in lage concentraties van ppb (delen per miljard) tot 10.000 ppm (delen per miljoen of 1 volumeprocent).
een PID is een zeer gevoelige breedspectrummonitor, zoals een ” low-level Lel monitor. Een foto-Ionisatiedetector meet Vos en andere giftige gassen in lage concentraties van ppb (delen per miljard) tot 10.000 ppm (delen per miljoen of 1 volumeprocent). Een PID is een zeer gevoelige breedspectrummonitor, zoals een ” low-level Lel monitor.
Hoe werkt een PID?,
een foto-Ionisatiedetector (PID) gebruikt een Ultraviolet (UV) lichtbron (foto= licht) om chemische stoffen af te breken tot positieve en negatieve ionen (ionisatie) die gemakkelijk met een Detector kunnen worden geteld. Ionisatie komt voor wanneer een molecuul het hoge energie UV-licht absorbeert, dat de molecule opwekt en resulteert in het tijdelijke verlies van een negatief geladen elektron en de vorming van positief geladen ion.
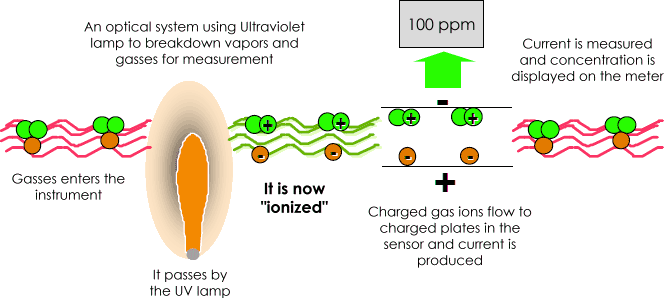
het gas wordt elektrisch geladen., In de Detector produceren deze geladen deeltjes een stroom die vervolgens wordt versterkt en op de meter wordt weergegeven als “ppm” (parts per million) of zelfs in “ppb” (parts per million).
de ionen recombineren snel na de elektroden in de detector om hun oorspronkelijke molecuul te “hervormen”.
PID ‘ s zijn niet destructief; ze “verbranden” of veranderen het monstergas niet permanent, waardoor ze kunnen worden gebruikt voor het verzamelen van monsters.
wat meet een PID?
De grootste groep verbindingen gemeten door een PID zijn de organische stoffen: verbindingen die koolstofatomen (C) bevatten.,s containing a benzene ring including benzene, toluene, ethyl benzene and xylene