Zwaar water
zwaar water is water dat zware waterstof bevat – ook bekend als deuterium-in plaats van gewone waterstof. Deuterium is anders dan de waterstof die gewoonlijk voorkomt in water—bekend als protium, omdat elk atoom van deuterium een proton en een neutron bevat, terwijl vaker voorkomende waterstof slechts een proton bevat.
zwaar water komt van nature voor, echter in veel kleinere hoeveelheden dan gewoon water., Ongeveer één watermolecuul per twintig miljoen watermoleculen is zwaar water. Omdat deuterium een stabiele isotoop is, is zwaar water niet radioactief.zwaar water is niet alleen nuttig voor kernreactoren, maar is ook gebruikt in Canada om neutrino ‘ s van de zon te detecteren in het Sudbury Neutrino Observatory, wat belangrijke inzichten verschaft voor de subatomaire fysica.
gebruik als Moderator
hoofdpagina
In kernsplijtingsreactoren moeten de neutronen worden vertraagd om een effectieve kernsplijtingsketenreactie te waarborgen., Dit proces van het vertragen van neutronen is bekend als matiging, en het materiaal dat deze neutronen vertraagt staat bekend als een neutron moderator. Zwaar water is een van de twee moderatoren die kunnen worden gebruikt om een kernreactor te laten werken met natuurlijk uranium. De andere moderator is grafiet.
een zwaarwaterreactor maakt gebruik van zwaar water als koelmiddel en moderator. Deuterium werkt als moderator omdat het minder neutronen absorbeert dan waterstof, wat uiterst belangrijk is omdat kernsplijtingsreacties neutronen nodig hebben om hun kettingreacties uit te voeren., Het zware water wordt onder druk gehouden waardoor het kookpunt toeneemt, zodat het bij hoge temperaturen kan werken zonder te koken. CANDU-reactoren gebruiken zwaar water als moderator en vereisen dus geen verrijkt uranium, maar uranium in zijn natuurlijke toestand kan worden gebruikt.
productie
de kosten van het zwaar water vormen een aanzienlijk deel van de bouwkosten van een zwaarwaterreactor, maar maken de reactoren goedkoper in gebruik (omdat uraniumverrijking overbodig is). Technisch gesproken wordt deuterium niet “gemaakt” in een specifiek proces, eerder worden moleculen van zwaar water gescheiden van grote hoeveelheden water die H2O bevatten of afzonderlijk deuteriumwater in het Girdler sulfide proces (dat in detail zal worden besproken in de volgende twee paragrafen). Het water dat niet zwaar is wordt weggegooid en staat bekend als”uitgeput water”., Een alternatieve methode bestaat wanneer water wordt elektrolyzed om zuurstof en waterstof te maken die normaal gas, samen met deuterium bevat. De waterstof wordt dan vloeibaar gemaakt en gedestilleerd om de twee componenten te scheiden, dan wordt deuterium met zuurstof gereageerd om zwaar water te vormen.
het produceren van zwaar water vereist geavanceerde infrastructuur, en zwaar water wordt actief geproduceerd in Argentinië, Canada, India en Noorwegen. De grootste fabriek was de Bruce fabriek in Canada, maar is gesloten., Technisch gezien is er een klein verschil in de kookpunten van zwaar water en water, dus dit verschil kan worden benut bij het extraheren van zwaar water. Aangezien deuterium echter in zulke kleine aantallen voorkomt, zou een enorme hoeveelheid water gekookt moeten worden om aanzienlijke hoeveelheden deuterium te verkrijgen. Dit zou veel brandstof of elektriciteit, dus in plaats daarvan faciliteiten benutten chemische verschillen tussen de twee. De belangrijkste chemische methode voor de productie van zwaar water is het Girdler sulfide proces.,
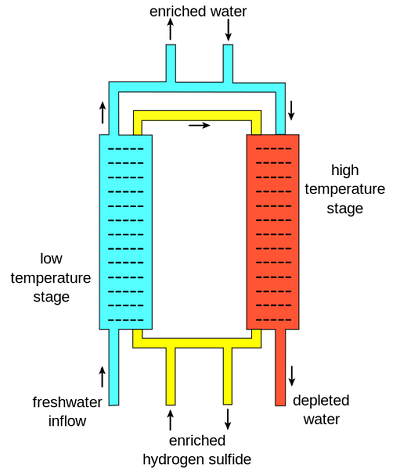
Het Girdler-sulfideproces is een methode die werkt op basis van een uitwisseling van deuterium tussen H2S en gewoon Licht water. In dit proces zijn er twee afzonderlijke kolommen. De ene kolom is bij 30°C en staat bekend als de “koude toren”, terwijl de andere bij 130 °C staat, bekend als de “hete toren”. De scheiding vindt plaats op basis van een evenwicht en de verschillen in evenwicht bij de twee verschillende temperaturen. De evenwichtsvergelijking is:
de belangrijkste reden dat dit proces werkt is het resultaat van waterstofsulfidegas dat tussen warme en koude torens circuleert., Eerst stroomt zoet water in de lage temperatuur, samen met deuterium verrijkt waterstofsulfide gas. Als gevolg van de evenwichtseigenschappen bij deze temperatuur migreert deuterium bij voorkeur van het verrijkte waterstofsulfide naar het water, waardoor zwaar water ontstaat. Dit verrijkte water wordt dan verwijderd, en meer zoet water komt in de hoge temperatuur fase samen met het waterstofsulfide gas (nu enigszins uitgeput in deuterium). Hier beweegt deuterium uit het zoet water bij voorkeur naar het waterstofsulfidegas, dat het verrijkt., Dit verrijkte gas gaat dan terug naar de lage temperatuur, en werkt om het zware water verder te verrijken. Normaal water uit de hoge temperatuur fase, nu uitgeput, wordt afgevoerd. Een cascade wordt dan opgezet zodat “verrijkt” water-water met meer deuterium-wordt gevoed in de koude toren en verrijkt opnieuw.