kyselina octová
definice
kyselina octová je mírně korozivní monokarboxylová kyselina. Jinak známá jako kyselina ethanová, kyselina methanekarboxylová, octan vodnatý nebo kyselina ethylová, tato organická sloučenina se používá v chemické výrobě, jako potravinářská přídatná látka a při výrobě ropy. Molekulární vzorec kyseliny octové je C2H4O2 nebo CH3COOH, kde-COOH definuje přítomnost jediné karboxylové skupiny.,

Kyselina Octová Strukturu
Octová kyselina, struktura je jednoduchý, karboxylové kyseliny a skládá se z methylové skupiny připojené k karboxylové skupině, jak je vidět na obrázku níže. Kyselina octová nebo kyselina ethanová je protické rozpouštědlo; je schopen darovat protony ve formě hydronů (kladně nabité atomy vodíku)., Tato charakteristika znamená, že je členem skupiny Brønsted acid, kde jsou protony darovány akceptorovým molekulám známým jako Brønsted báze. Darovaný vodík je oddělen od karboxylové skupiny. Ocet je roztok kyseliny octové a vody, kde přibližně 0,4% kyselina octová molekuly vzdát jejich H+ atomy, což vede k kyselém roztoku přibližně 2,4 pH. Ve srovnání se světem je nejsilnější kyselina – carborane kyseliny (H(CHB11Cl11)) – s pH hodnotu -18, kyselina octová je mírně kyselé srovnání.,
To by mělo být jasné, že to není přítomnost jednoho atomu vodíku, že mění pH roztoku. Neutrální roztoky (ani kyselina, ani alkalické) obsahují vyvážený počet hydroniových iontů (H30+) a hydroxylových iontů (OH–). Dvě molekuly vody (H20) se tvoří, když se hydronium a hydroxyl iont váží a pozitivní a negativní náboje jsou zrušeny., Když se do vody přidá kyselina octová, rozdělí se na záporně nabitý acetátový iont (CH3COO–) a H+. Je tedy možné pochopit Alternativní název kyseliny octové-octanu vodnatého. Malé procento kladně nabitých vodíkových iontů se váže na molekuly vody a přeměňuje je na H30+. To znamená, že existuje více iontů hydronia, a proto vytváří pozitivně nabitý (nebo kyselý) roztok. PH roztoku je proto závislé na rovnováze hydronia a hydroxylu a nikoli na počtu vodíkových iontů, i když to ovlivní tuto rovnováhu., Hodnota pH je také dána pouze roztoku. Roztok vždy obsahuje vodu; dokonce i moderní superkyseliny, jako je karboran, jsou rozpuštěny v koncentrovaných vodných roztocích jiných kyselin. Dokonce i ledová kyselina octová má malé množství vody.
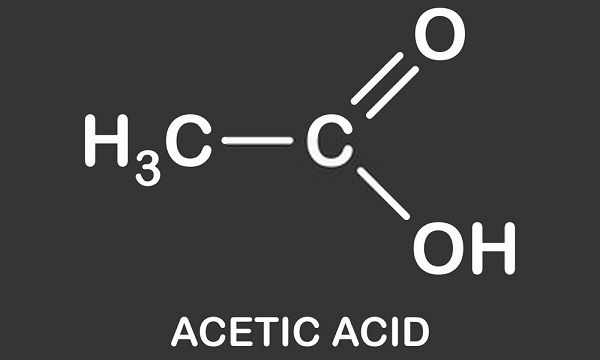
následující obrázek ukazuje disociaci kyseliny octové na acetát ve vodě. Vlevo je jedna molekula kyseliny octové a jedna molekula vody. Kyselina octová přechází na vodíkový iont do molekuly vody za vzniku hydroniového iontu. Říkáme, že molekula vody je protonována nebo jí byl darován proton (hydron).,
Jako rozpouštědlo, kapalné kyselina octová rozpouští polární (hydrofilní) sloučeniny, jako jsou soli a cukrů a nepolární sloučeniny, které obsahují tuky a oleje. To znamená, že má mnoho použití v průmyslové chemické výrobě, ale také získal pověst jako doplněk hubnutí, protože ovlivňuje metabolismus tuků a cukru. Další informace týkající se použití kyseliny octové budou popsány později v tomto článku., V krystalické formě se dvě molekuly kyseliny octové spojují s vodíkovými vazbami a vytvářejí dimer. Když se přidá voda, tyto vazby jsou přerušeny a krystalická forma se rozpustí.

Octová Kyselina Vzorec
Kyseliny octové, vzorec je jednoduchý a výsledek methylovou skupinu a karboxylovou skupinu., Methylové skupiny jsou jednou z nejběžnějších organických sloučenin na planetě, ale zřídka se vyskytují jako jednotlivé entity. Jsou složeny ze tří atomů vodíku a jednoho atomu uhlíku (CH3). Jako uhlík má čtyři elektrony, volný elektron obvykle vazby s jinými molekulami prostřednictvím kovalentní vazby. Nejjednodušší uhlíkovou molekulou je metan (CH4), známý svým příspěvkem ke globálnímu oteplování. S volným elektronem reaguje metan s ozonem (O3) za vzniku oxidu uhličitého a vody v následující reakci: (3)CH4 + (4)O3 = (3)CO2 + (6)H2O., Obrázek ukazuje molekulu metanu složenou z methylové skupiny a extra atomu vodíku.
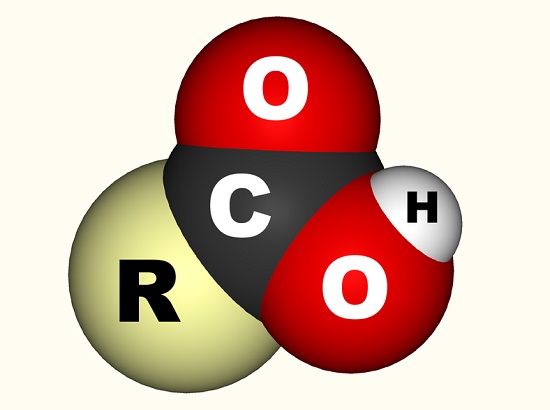
V případě kyseliny octové, volný elektron se váže s karboxylovou skupinou (co 2h, -COOH nebo -C(=O) – OH) což je jeden atom uhlíku vázán na hydroxylovou skupinu (-OH) a dvakrát vázaný na atom kyslíku., Níže uvedený obrázek ukazuje karboxylové skupiny, kde R představuje zbytek molekuly, na které karboxylová skupina je připojena; písmeno R je někdy nahrazen klikatá čára. V případě kyseliny octové představuje R methylovou skupinu. Někteří dávají přednost popisu karboxylové skupiny jako kombinace karbonylové skupiny (C=0, kde = označuje dvojnou vazbu) a hydroxylové skupiny (O-H). Karboxylové kyseliny se nacházejí v aminokyselinách a jsou nezbytné pro každý živý organismus.,
je obecně molekulární vzorec pro všechny karboxylové kyseliny, tedy CnH2n+1COOH. To znamená, že každý karboxylové kyseliny vlastnosti dvakrát tolik atomů vodíku jako atomy uhlíku jakmile karboxylová skupina je odstraněn, vzorec, který odpovídá dokonale s kyselinou octovou – C2H4O2. Když odstraníte karboxylovou skupinu z tohoto vzorce kyseliny octové, zůstane vám jeden uhlík a dva atomy vodíku.,
fakta o kyselině octové
fakta o kyselině octové pro ty, kteří se chtějí naučit trochu víc!
molární hmotnost kyseliny octové je 60, 052 gramů na mol (g/mol). Molární hmotnost je celková hmotnost prvku nebo sloučeniny (atomová hmotnost) měřená v jednotkách atomové hmotnosti nebo „amu“, dělená jeho množstvím v molech (mol). Jeden mol je založen na avogadrova konstanta 6.02214076×1023, jak toto číslo znamená, že srovnání mezi moly a Daltonů, další vědecké jednotka atomové hmotnosti, je jednodušší.,
Ledová kyselina octová je roztok kyseliny octové ve velmi malém množství vody – méně než 1%. Slovo glacial odkazuje na jeho krystalovou pevnou formu při pokojové teplotě. Dalším názvem pro ledovou kyselinu octovou je bezvodá kyselina octová. Tato forma je slabá kyselina, ale žíravý jed, který způsobuje puchýře a popáleniny. Protože tam je velmi málo vody, která se odloučí, ledová kyselina octová přejde na jeho protonů vody v kůži nebo sliznice.,
nalezení správného pufrového činidla pro kyselinu, jako je kyselina octová, vyžaduje znalost pH, ka nebo pKa kyseliny. PH, ka a pKa jsou navzájem propojeny. Kyselina octová má Ka 1,8 x 10-5 nebo snadnější výpočet hodnoty pKa 4,756. PH měří počet vodíkových iontů (H+) v jakémkoli roztoku, který obsahuje vodu a pohybuje se od 0 (kyselých) do 14 (bází). Čím nižší je pH, tím vyšší je koncentrace vodíkových iontů. Ka a pKa se vztahují k kyselinám a týkají se konstanty disociace kyseliny, která ukazuje, jak je pravděpodobné, že se kyselina vzdá svých protonů., Vysoká Ka nám říká, že kyselina je silná a bude reagovat na jakoukoli přidanou chemickou látku. PKa je opak-čím menší je číslo, tím silnější je kyselina. Je to proto, že pKa je negativní logaritmus Ka.
koncentrovaná kyselina octová však může mít nižší pH než silná kyselina. Díky pKa, která je konstantní hodnotou, můžeme provádět výpočty, aniž bychom museli přemýšlet o koncentracích. PKa kyseliny octové je 4,756 a to nám říká, jak je pravděpodobné, že se vzdá svých protonů v roztoku., Báze se měří podle toho, jak je pravděpodobné, že odstraní protony z roztoku.
bod varu kyseliny octové je mezi 244 a 246°F (118 a 119°C) a jeho bod tavení se pohybuje mezi 61 a 62°F (16 a 17°C) nebo jen za pokojové teploty. Hustota kyseliny octové je 1,049 g cm-3 v kapalném stavu a 1,27 g cm−3 v pevném stavu.
nejčastěji uznávanou formou kyseliny octové je ocet, který obsahuje 5-20% kyseliny octové. Jak velké je ředění (a tedy síla kyseliny), se označuje jako jeho síla zrna., Můžete to snadno vypočítat vynásobením koncentrace 10. Ocet obsahující 5% kyseliny octové bude mít zrnitost 50.
použití kyseliny octové
použití kyseliny octové je mnoho a rozmanité. Tato kyselina se používá při výrobě zboží, při zpracování potravin, v čistícím průmyslu, v medicíně a jako doplněk zdraví. Kyselina octová je také biochemická esenciální ve formě acetylové skupiny, kde je zásadní pro konstrukci aminokyselin, a proto není možné bez ní existovat. Podívejme se na některé z těchto použití kyseliny octové podrobněji.,
kyselina octová při výrobě zboží
kyselina octová je důležité chemické činidlo používané k výrobě acetátu, lepidel, lepidel a syntetických tkanin. Kyselina octová se také používá při galvanizaci, kde se na předmět nanáší kovový povlak umístěním do roztoku, který obsahuje specifickou kovovou sůl. Řešení musí být vodivé a kyseliny, které darují vodíkové ionty, vytvářejí ideální podmínky. Kromě toho se galvanické pokovování může vyskytovat pouze v roztoku a kovové soli se rozpouštějí pouze v roztocích s nízkou (kyselou) hodnotou pH.,
kyselina Octová je surovinou pro výrobu celulózy-acetát, kyselina octová, anhydrid (plasty) a kyselina chloroctová používá se při výrobě barviv a pesticidů, jakož i některých léků.
kyselina octová při zpracování potravin
kyselina octová používaná při zpracování potravin k regulaci hladiny kyselosti nebo zásaditosti potravin. Kodex federálních předpisů (CFR) kategorizuje kyselinu octovou jako univerzální potravinářskou přídatnou látku, která je bezpečná při použití v souladu s dobrými výrobními postupy. V Evropě platí nařízení o elektronických číslech pro všechny potravinářské přídatné látky., Kyselina octová dostala kód E260 a je považována za bezpečnou složku, která řídí kolonizaci bakterií a může být použita bez omezení. Toto není nové zjištění. Říká se, že starověcí Babylóňané používali ocet jako konzervační látku.
ocet se používá k výrobě salátových dresinků, koření, které zahrnují hořčici, kečup a majonézu, a v omáčkách a okurkách.,
Octové Kyseliny pro Čištění
kyselina Octová se používá jako čisticí prostředek a deodorant na staletí ne-li tisíciletí; houby z octem byly umístěny v drahých filigránové kroužky nosí bohaté, když oni prošli špinavé a páchnoucí osmnáctého století ulicích. Deodorizační vlastnosti octa byly také využity po generace. Námořníci používali ocet k čištění paluby lodí, na kterých pracovali a žili., Principy mikrobiální kontroly možná nebyly v té době pochopeny, ale čerstvě vonící, čisté a nemocně zabraňující vlastnosti tohoto organického roztoku byly rozhodně dobře známy.
přidání alkalického produktu do kyseliny způsobuje bublající, šumivou reakci. Některé tradiční čističe se domnívají, že tento efekt vytváří hlubší čisté až stabilní povrchy., Například, drhnutí dvorku alkalického hydroxidu sodného (hydroxid sodný) a pak pomocí ocet směs na vrcholu tohoto spustí reakci, která vypadá, jako kdyby to má hluboké čištění akce; to však dělá velmi málo pro zvýšení hygienický efekt, ale spíše nárazníky nebo působí proti alkalické čistící sílu hydroxidu sodného s kyselé vlastnosti octa.,
Dnes, mnoho oddaných fanoušků bílého octa propagovat ekologické výhody použití zředěné kyseliny octové do čisté koupelny, praní prádla, odstranit nepříjemné pachy, a dělat přípravy potravin povrchy čisté a bezpečné. Kyselina octová také odstraňuje usazeniny rzi a vápna.
kyselina octová v medicíně
kyselina octová nebo ocet se pravděpodobně používají v medicíně již před psaným slovem. Pokud jste trpěli otevřenou ranou na ostrově Kos ve čtvrtém století před Kristem, možná vám Hippocrates předepsal denní mytí octa., Pokud jste měl bolesti v krku, mohl by mít také požádal, abyste smíchejte med a ocet, aby se Oxymel, starověké řecké lék proti kašli; pokud jste sloužil v Evropě během První Světové Války, může mít pouze přístup na ocet udržet čisté a zůstane bez infekce.
dnes se roztoky kyseliny octové používají v laboratorních procesech testování krve jako slide wash. Odstraňují bakteriální biofilmy v ranách a zažívacím systému a často se používají pro infekce vnějšího ucha, a proto se vyhýbají používání antibiotik., Požití octa zvyšuje hladiny acetátu v tlustém střevě a podporuje příjem vápníku s nižším krevním tlakem a vyšší hustotou kostí. Studie zkoumají použití acetátu jako protinádorového léku.
kyselina octová jako doplněk zdraví
kyselina octová je oblíbeným doplňkem zdraví a konzumuje se ve formě octa, nejčastěji jablečného octa. Při navázání na koenzym A je acetylová skupina kyseliny octové ústředním bodem metabolismu uhlohydrátů a tuků.,
byla provedena velká studie týkající se souvislosti mezi spotřebou octa a nižší hladinou glukózy v krvi. Tam, kde jsou potraviny s vysokým glykemickým indexem konzumovány po požití dvou až tří polévkových lžic jablečného octa, bylo prokázáno, že jejich glykemické hodnoty jsou až o 35% nižší. U diabetiků by to mohlo znamenat nižší postprandiální hladiny glukózy v krvi a lepší kontrolu glykémie a u nediabetiků nižší riziko vzniku inzulínové rezistence. Nahrazení pravidelné okurky nakládanou okurkou ukázalo 30% snížení celkové hodnoty glykemického indexu jídla.,
následující obrázek ukazuje účinek potravin s nízkým a vysokým glykemickým indexem (GI) na hladinu glukózy v krvi. Potraviny s vysokým GI způsobují rychlý vrchol hladin glukózy v krvi, které zvyšují produkci inzulínu, což umožňuje buňkám metabolizovat glukózu. To znamená, že hladina glukózy v krvi rychle klesá a způsobuje hlad. Potraviny s nízkým GI způsobují jemnější zvýšení hladiny cukru v krvi a nenutí pankreas produkovat tak velké množství inzulínu. Výsledkem je jemná křivka, která zůstává stabilní a neklesá, což zvyšuje hladinu sytosti po jídle., Když se jedí potraviny s vysokým GI a potraviny s nízkým GI současně, částečně se navzájem zruší, což vytváří plošinový efekt. Je známo, že ocet má stejný účinek jako velmi nízké jídlo GI.

Jak již bylo zmíněno, kyselina octová je také považován za doplněk ztráta hmotnosti vzhledem k jeho schopnosti na úrovni vrcholu glukózy po jídle a tak přispívá ke zvýšení sytosti., To je také navrhl, že přítomnost kyseliny octové ve stravě zpomaluje vyprazdňování žaludku, což také pomáhá kontrolovat některé formy přejídání. Kromě toho se zdá, že ocet odrazuje od tvorby tuku v dávkách až patnácti mililitrů denně.