azijnzuur
definitie
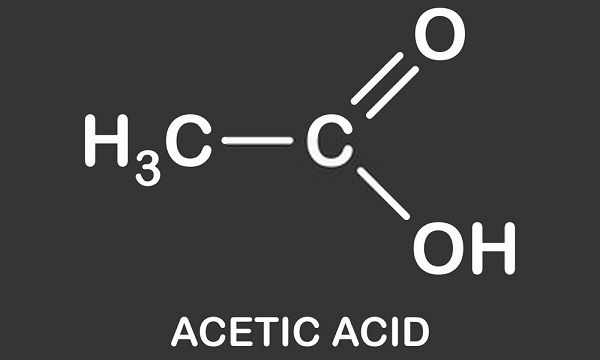
azijnzuur is een licht corrosief monocarbonzuur. Ook bekend als ethaanzuur, methaancarbonzuur, waterstofacetaat of ethylzuur, wordt deze organische verbinding gebruikt in de chemische productie, als additief voor levensmiddelen, en in de productie van aardolie. De moleculaire formule van azijnzuur is C2H4O2 of CH3COOH, waarbij-COOH de aanwezigheid van de enkele carboxylgroep definieert.,

Azijnzuurstructuur
Azijnzuurstructuur is die van een enkel carbonzuur en bestaat uit een methylgroep bevestigd aan een carboxylgroep zoals te zien in de afbeelding hieronder. Azijnzuur of ethaanzuur is een protisch oplosmiddel; het kan protonen afstaan in de vorm van hydronen (positief geladen waterstofatomen)., Dit kenmerk betekent dat het een lid is van de Brønsted zuurgroep waar protonen worden gedoneerd aan acceptormoleculen bekend als Brønsted basen. De gedoneerde waterstof wordt losgemaakt van de carboxylgroep. Azijn is een oplossing van azijnzuur en water waarbij ongeveer 0,4% van de azijnzuurmoleculen hun H+ – atomen opgeven, wat leidt tot een zure oplossing van ongeveer 2,4 pH. in vergelijking met het sterkste zuur ter wereld – carboraanzuur (H(CHB11Cl11)) – met een pH-waarde van -18, is azijnzuur in vergelijking licht zuur.,
duidelijk moet worden gemaakt dat het niet de van een enkel waterstofatoom dat de pH van een oplossing verandert. Neutrale oplossingen (noch zuur, noch alkalisch) bevatten een uitgebalanceerd aantal hydroniumionen (H30+) en hydroxylionen (OH–). Twee molecules van water (H20) worden gevormd wanneer een hydronium en hydroxylion binden en de positieve en negatieve ladingen worden opgeheven., Wanneer azijnzuur aan water wordt toegevoegd, splitst het zich in een negatief geladen acetaation (CH3COO -) en H+. Het is daarom mogelijk om de alternatieve naam azijnzuur – waterstofacetaat te begrijpen. Een klein percentage positief geladen waterstofionen bindt zich aan de watermoleculen en verandert ze in H30+. Dit betekent dat er meer hydroniumionen zijn en daarom een positief geladen (of zure) oplossing creëren. De pH van een oplossing is dus afhankelijk van de balans van hydronium en hydroxyl en niet van het aantal waterstofionen, hoewel deze invloed hebben op deze balans., Een pH-waarde wordt ook alleen aan een oplossing gegeven. Een oplossing bevat altijd water; zelfs moderne superzuren zoals carboraan worden opgelost in geconcentreerde waterige oplossingen van andere zuren. Zelfs ijsazijn heeft een kleine hoeveelheid water.
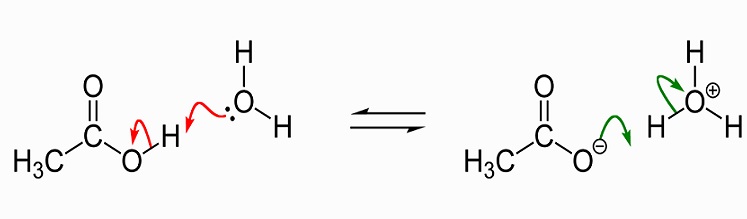
de volgende afbeelding toont de dissociatie van azijnzuur en acetaat in water. Links bevinden zich een enkel azijnzuurmolecuul en een enkel watermolecuul. Azijnzuur geeft een waterstofion door aan het watermolecuul om een hydroniumion te produceren. We zeggen dat het watermolecuul geprotoneerd is of dat er een proton (hydron) aan geschonken is.,
als oplosmiddel Lost vloeibaar azijnzuur polaire (hydrofiele) verbindingen op, zoals zouten en suikers en niet-polaire verbindingen, waaronder vetten en oliën. Dit betekent dat het heeft vele toepassingen in industriële chemische productie, maar heeft ook een reputatie als een gewichtsverlies supplement als het vet en suiker metabolisme beïnvloedt opgedaan. Meer informatie over het gebruik van azijnzuur zal later in dit artikel worden besproken., In kristallijne vorm voegen twee azijnzuurmoleculen zich samen met waterstofbindingen om een dimeer te vormen. Wanneer water wordt toegevoegd, worden deze bindingen verbroken en lost de kristallijne vorm op.

Azijnzuur Formule
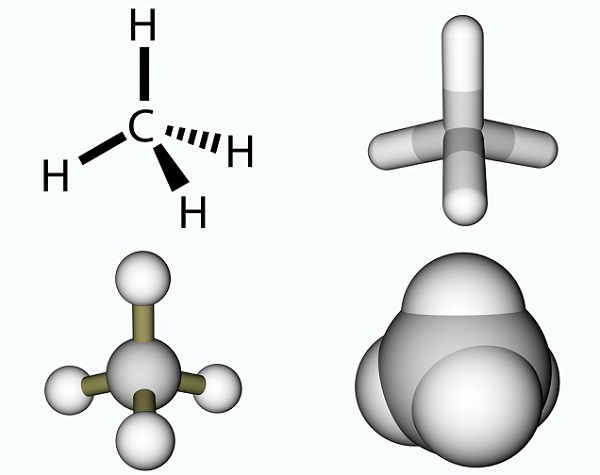
Het azijnzuur formule is simpel en het resultaat van een methyl-groep en een carboxylgroep., Methylgroepen zijn een van de meest voorkomende organische verbindingen op de planeet, maar worden zelden gevonden Als afzonderlijke entiteiten. Ze bestaan uit drie waterstofatomen en één koolstofatoom (CH3). Aangezien koolstof vier elektronen heeft, bindt het vrije elektron gewoonlijk met andere moleculen door middel van een covalente binding. De eenvoudigste koolstofmolecule is methaan (CH4), bekend om zijn bijdrage aan de opwarming van de aarde. Met een vrij elektron reageert methaan met ozon (O3) om kooldioxide en water te produceren in de volgende reactie: (3)CH4 + (4)O3 = (3)CO2 + (6)H2O., De foto toont een methaanmolecuul dat bestaat uit een methylgroep en een extra waterstofatoom.
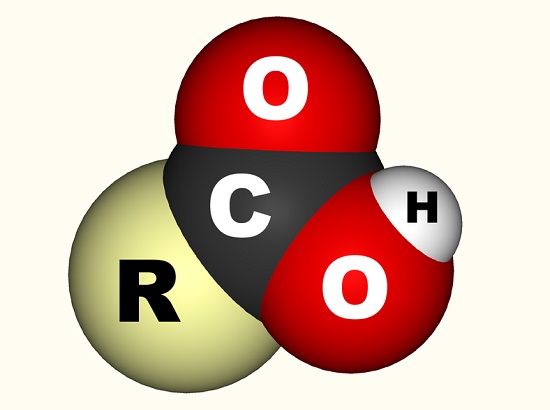
in het geval van azijnzuur bindt het vrije elektron zich aan een carboxylgroep (CO2H,- COOH of-C(=O)OH) die een enkelvoudige koolstofatoom gebonden aan een hydroxylgroep (-oh) en dubbel gebonden aan een zuurstofatoom., De onderstaande afbeelding toont een carboxylgroep waar R de rest van het molecuul voorstelt waaraan de carboxylgroep is bevestigd; de letter R wordt soms vervangen door een wiebelige lijn. In het geval van azijnzuur staat de R voor de methylgroep. Sommigen beschrijven de carboxylgroep liever als een combinatie van een carbonylgroep (C=0, waarbij = de dubbele binding aangeeft) en een hydroxylgroep (O-H). Carbonzuren komen voor in aminozuren en zijn essentieel voor elk levend organisme.,
Er is een algemene moleculaire formule voor alle carbonzuren, namelijk CnH2n+1COOH. Dit betekent dat elk carboxylzuur twee keer zoveel waterstofatomen bevat als koolstofatomen zodra de carboxylgroep is verwijderd; een formule die perfect past bij die van azijnzuur-C2H4O2. Als je de carboxylgroep uit deze azijnzuurformule verwijdert, heb je één koolstof en twee waterstofatomen over.,
azijnzuur feiten
azijnzuur feiten voor degenen die iets meer willen leren!
de molaire massa van azijnzuur is 60,052 gram per mol (g / mol). Molaire massa is de totale massa van een element of verbinding (atoommassa), gemeten in atomaire massa-eenheden of “amu”, gedeeld door de hoeveelheid ervan in mol (mol). Een enkele mol is gebaseerd op het Avogadro-getal 6.02214076×1023 omdat dit getal betekent dat vergelijking tussen mollen en Dalton, een andere wetenschappelijke eenheid van atoommassa, eenvoudiger is.,
ijsazijn is een oplossing van azijnzuur in een zeer kleine hoeveelheid water – minder dan 1%. Het woord glaciaal verwijst naar zijn kristalachtige vaste vorm bij kamertemperatuur. Een andere naam voor ijsazijn is watervrij azijnzuur. Deze vorm is een zwak zuur, maar een bijtend gif, dat blaarvorming en brandwonden veroorzaakt. Aangezien er zeer weinig water is om mee te scheiden, zal ijsazijn zijn protonen doorgeven aan het water in de huid of slijmvliezen.,
het vinden van het juiste buffermiddel voor een zuur zoals azijnzuur vereist kennis van de pH, Ka of pKa van het zuur. De pH, Ka en pKa zijn allemaal gerelateerd aan elkaar. Azijnzuur heeft een Ka van 1,8 x 10-5 of een gemakkelijker te berekenen pKa-waarde van 4,756. De pH meet het aantal waterstofionen (H+) in een oplossing die water bevat en varieert van 0 (zuur) tot 14 (base). Hoe lager de pH, hoe hoger de concentratie waterstofionen. De Ka en pKa hebben betrekking op zuren en hebben betrekking op de zuurdissociatieconstante die laat zien hoe waarschijnlijk het zuur is om zijn protonen op te geven., Een hoge Ka vertelt ons dat een zuur sterk is en zal reageren op elke chemische stof die eraan wordt toegevoegd. De pKa is het tegenovergestelde-hoe kleiner het getal, hoe sterker het zuur. Dit komt omdat de pKa een negatieve logaritme van de Ka is.
geconcentreerd azijnzuur kan echter een lagere pH hebben dan een sterk zuur. Dankzij de pKa, die een constante waarde is, kunnen we berekeningen maken zonder na te denken over concentraties. De pKa van azijnzuur is 4.756 en dit vertelt ons hoe waarschijnlijk het is om zijn protonen in een oplossing op te geven., Basen worden gemeten op basis van hoe waarschijnlijk ze zijn om protonen uit een oplossing te verwijderen.het kookpunt van azijnzuur ligt tussen de 244 en 246°F (118 en 119°C) en het smeltpunt ligt tussen de 61 en 62°F (16 en 17°C) of net onder kamertemperatuur. De dichtheid van azijnzuur is 1,049 g cm-3 in vloeibare toestand en 1,27 g cm-3 in vaste toestand.
de meest bekende vorm van azijnzuur is azijn dat 5-20% azijnzuur bevat. Hoe groot de verdunning is (en daarom de sterkte van het zuur) wordt aangeduid als de korrelsterkte., Je kunt dit eenvoudig berekenen door de concentratie met 10 te vermenigvuldigen. Azijn met 5% azijnzuur heeft een korrelsterkte van 50.
gebruik van azijnzuur
gebruik van azijnzuur is talrijk en gevarieerd. Dit zuur wordt gebruikt in de productie van goederen, in de voedselverwerking, in de reinigingsindustrie, in de geneeskunde, en als aanvulling op de gezondheid. Azijnzuur is ook een biochemisch essentieel in de vorm van acetylgroepen, waar het fundamenteel is voor de bouw van aminozuren en daarom onmogelijk kan bestaan zonder. Laten we eens kijken naar een paar van deze azijnzuur toepassingen in meer detail.,
azijnzuur bij de vervaardiging van goederen
azijnzuur is een belangrijk chemisch reagens dat wordt gebruikt voor de productie van acetaat, kleefstoffen, lijm en synthetische weefsels. Azijnzuur wordt ook gebruikt in galvaniseren waar een metalen coating wordt afgezet op een object door het te plaatsen in een oplossing die een specifiek metaalzout bevat. De oplossing moet geleidend zijn en zuren die waterstofionen afstaan creëren ideale omstandigheden. Bovendien kan galvaniseren alleen plaatsvinden in een oplossing en metaalzouten lossen alleen op in oplossingen met een lage (zure) pH-waarde.,
azijnzuur is een grondstof die wordt gebruikt voor de productie van celluloseacetaat, azijnzuuranhydride (kunststoffen) en chloorazijnzuur die worden gebruikt bij de productie van kleurstoffen, bestrijdingsmiddelen en bepaalde geneesmiddelen.
azijnzuur bij de verwerking van levensmiddelen
azijnzuur bij de verwerking van levensmiddelen om de zuurgraad of alkaliniteit van levensmiddelen te regelen. De Code of Federal Regulations (CFR) categoriseert azijnzuur als een additief voor algemeen gebruik dat veilig is wanneer het wordt gebruikt in overeenstemming met goede productiepraktijken. In Europa gelden de e-nummerregels voor alle levensmiddelenadditieven., Azijnzuur is gegeven code E260 en wordt beschouwd als een veilig ingrediënt dat bacteriële kolonisatie controleert en kan zonder beperking worden gebruikt. Dit is geen nieuwe bevinding. Er wordt gezegd dat de oude Babyloniërs azijn gebruikten als conserveermiddel voor voedsel.
azijn wordt gebruikt voor saladedressings, specerijen met mosterd, ketchup en mayonaise, en in sauzen en augurken.,azijnzuur wordt al eeuwen, zo niet millennia gebruikt als reinigingsproduct en ontgeurder; sponzen van azijn werden in dure filigraan ringen geplaatst die door de rijken gedragen werden wanneer ze door Smerige en stinkende achttiende-eeuwse straten trapten. Ook de ontgeurende eigenschappen van azijn worden al generaties lang benut. Matrozen gebruikten azijn om de dekken te schrobben van de schepen waarop ze werkten en leefden., De principes van microbiële controle zijn toen misschien nog niet begrepen, maar de fris ruikende, schone en ziekte-preventie kenmerken van deze organische oplossing waren zeker bekend.
Het toevoegen van een alkalisch product aan zuur veroorzaakt een borrelende, bruisende reactie. Sommige traditionele reinigers geloven dat dit effect een diepere reiniging tot stabiele oppervlakken produceert., Bijvoorbeeld, schrobben de achtertuin met alkalische bijtende soda (natriumhydroxide) en vervolgens met behulp van een azijn mix op de top van dit zal leiden tot een reactie die zeker lijkt alsof het heeft een diepe reiniging actie; echter, dit doet zeer weinig om het hygiënische effect te verhogen, maar eerder buffers of werkt tegen de alkalische reinigingskracht van de bijtende soda met de zure eigenschappen van azijn.,tegenwoordig maken veel toegewijde fans van witte azijn reclame voor de ecologische voordelen van verdund azijnzuur om badkamers te reinigen, kleding te wassen, geuren te verwijderen en oppervlakken voor voedselbereiding schoon en veilig te maken. Azijnzuur verwijdert ook roest-en kalkafzettingen.
azijnzuur in de geneeskunde
azijnzuur of azijn is waarschijnlijk al voor het geschreven woord in de geneeskunde gebruikt. Mocht U in de vierde eeuw voor Christus een open wond op het eiland Kos hebben gehad, dan kan het zijn dat u een dagelijkse azijn was voorgeschreven door Hippocrates., Als u een zere keel had, had hij u misschien ook gevraagd om honing en azijn te mengen om Oxymel te maken, een oud Grieks hoestmiddel; als u tijdens de Eerste Wereldoorlog in Europa had gediend, had u misschien alleen maar toegang tot azijn schoon te houden en vrij van infectie te blijven.
tegenwoordig worden azijnzuuroplossingen gebruikt in laboratoriumbloedtesten als een glaasje. Ze verwijderen bacteriële biofilms in wonden en het spijsverteringsstelsel, en zijn vaak gebruikt voor buitenoor infecties en zo het gebruik van antibiotica te voorkomen., Inname van azijn verhoogt de acetaatspiegels in de dikke darm en bevordert de opname van calcium met een lagere bloeddruk en een hogere botdichtheid als gevolg. De Studies onderzoeken het gebruik van acetaat als antitumormedicijn.
azijnzuur als gezondheidssupplement
azijnzuur is een populair gezondheidssupplement en wordt geconsumeerd in de vorm van azijn, meestal appelciderazijn. Wanneer gebonden aan co-enzym A, is de acetylgroep van azijnzuur centraal in koolhydraatmetabolisme en vetmetabolisme.,
Er is veel onderzoek gedaan naar het verband tussen de consumptie van azijn en lagere bloedglucosespiegels. Waar hoge glycemische index voedingsmiddelen worden geconsumeerd na de inname van twee tot drie eetlepels appelciderazijn, is aangetoond dat hun glycemische waarden tot 35% lager zijn. Voor diabetici, kan dit betekenen lagere post-prandiale bloedglucose pieken en betere glycemische controle en voor niet-diabetici een lager risico op het ontwikkelen van insulineresistentie. Vervanging van gewone komkommer door een ingelegde komkommer toonde een 30% vermindering van de totale glycemische indexwaarde van de maaltijd.,
de volgende afbeelding toont het effect van lage en hoge glycemische index (GI) voedingsmiddelen op de bloedglucosespiegels. Het hoge GI voedsel veroorzaakt een snelle piek in bloedglucoseniveaus die insulineproductie verhogen die de cellen toelaat om glucose te metaboliseren. Dit betekent dat de bloedsuikerspiegel snel daalt, waardoor honger ontstaat. Lage GI voedingsmiddelen veroorzaken een zachtere stijging van de bloedsuikerspiegel en dwingen de alvleesklier niet om zulke grote hoeveelheden insuline te produceren. Het resultaat is een zachte curve die stabiel blijft en niet dipt, waardoor het verzadigingsniveau na een maaltijd toeneemt., Wanneer een hoog GI-en laag GI-voedsel tegelijkertijd worden gegeten, heffen ze elkaar gedeeltelijk op, waardoor een plateau-effect ontstaat. Azijn staat bekend om hetzelfde effect te hebben als een zeer laag GI voedsel.

zoals reeds vermeld, wordt azijnzuur ook beschouwd als een gewichtsverlies supplement vanwege zijn vermogen om piekglucose na de maaltijd te stabiliseren en helpt het de verzadiging te verhogen., Er wordt ook gesuggereerd dat de aanwezigheid van azijnzuur in het dieet de maaglediging vertraagt, wat ook helpt om bepaalde vormen van overeten onder controle te houden. Bovendien lijkt azijn de vetvorming te ontmoedigen in doses van slechts vijftien milliliter per dag.