Etikkahappoa
Määrittely
Etikkahappo on lievästi syövyttäviä monokarboksyylihapot. Muuten tunnetaan ethanoic happo, methanecarboxylic happo -, vety asetaatti tai ethylic happo, tämä orgaaninen yhdiste käytetään kemianteollisuudessa, elintarvikkeiden lisäaineena, ja öljyn tuotanto. Etikkahapon molekyylikaava on C2H4O2 tai CH3COOH, jossa-COOH määrittelee yksittäisen karboksyyliryhmän läsnäolon.,

Etikkahappoa Rakenne
Etikkahappoa rakenne on yksinkertainen karboksyylihappo ja koostuu metyyli-ryhmä kiinnitetty karboksyyliryhmän kuten nähdään kuvan alla. Etikkahappoa tai ethanoic happo on protic liuotin; se pystyy luovuttamaan protoneja muodossa hydrons (positiivisesti varautuneita vety-atomeja)., Tämä ominaisuus tarkoittaa, että se on jäsenenä Brønsted happo ryhmä, jossa protonit ovat lahjoitti tunnustaja molekyylejä tunnetaan Brønsted-emäksiä. Lahjoitettu vety erotetaan karboksyyliryhmästä. Etikka on ratkaisu etikkahappoa ja vettä, jossa on noin 0,4% etikkahappoa molekyylejä luopua H+ atomien mikä hapanta liuosta noin 2,4 pH. Verrattuna maailman vahvin happo – carborane happo (H(CHB11Cl11)) – pH-arvo -18, etikkahappo on lievästi hapan verrattuna.,
olisi tehtävä selväksi, että se ei ole läsnäolo yksittäinen vetyatomi, joka muuttaa pH-liuosta. Neutraalit liuokset (ei happo eikä emäksinen) sisältävät tasapainoisen määrän hydroniumioneja (H30+) ja hydroksyyli–ioneja (OH -). Kaksi vesimolekyyliä (H20) muodostuu, kun hydronium-ja hydroksyyli-ioni sitoutuvat ja positiiviset ja negatiiviset varaukset kumotaan., Kun etikkahappoa lisätään veteen, se jakautuu negatiivisesti varautuneeseen asetaatti– ioniin (CH3COO -) ja H+. Sen vuoksi on mahdollista ymmärtää etikkahapon ja vetyasetaatin vaihtoehtoinen nimi. Pieni osa positiivisesti varautuneita vetyioneja sitoa vesimolekyylejä ja ottaa ne osaksi H30+. Tämä tarkoittaa, että hydroniumioneja on enemmän ja näin syntyy positiivisesti varautunut (tai hapan) liuos. PH ratkaisu on siis riippuvainen tasapaino hydronium-ja hydroksyyli-ja ei määrä vety-ioneja, vaikka nämä vaikuttavat tähän tasapainoon., PH-arvo annetaan myös vain liuokselle. Liuos sisältää aina vettä; jopa nykyaikaiset superasidit, kuten karboraani, liuotetaan muiden happojen väkeviin vesiliuoksiin. Jääetikkahapossakin on pieni määrä vettä.
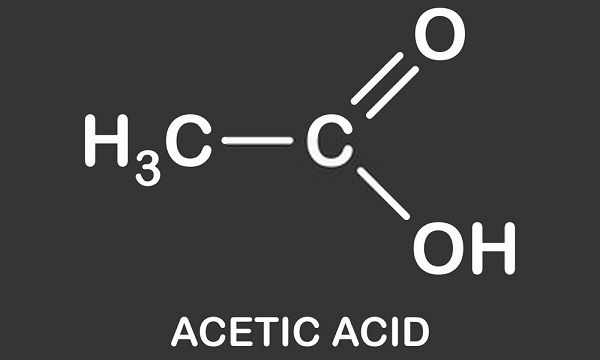
seuraavassa kuvassa näkyy etikkahapon dissosiaatio asetaatiksi vedessä. Vasemmalla on yksi etikkahappomolekyyli ja yksi vesimolekyyli. Etikkahappo siirtyy vetyionilla vesimolekyyliin tuottamaan hydroniumionia. Sanomme, että vesimolekyyli on protonoitu tai sille on lahjoitettu protoni (hydron).,
liuottimena, neste etikka-happo liukenee polar (hydrofiilinen) yhdisteet, kuten suolat ja sokerit ja ei-polaarisia yhdisteitä, jotka sisältävät rasvoja ja öljyjä. Tämä tarkoittaa, että se on monia käyttötarkoituksia teollisuuden kemialliset tuotantoa, mutta on myös saavuttanut mainetta laihtuminen täydentää, koska se vaikuttaa rasvan ja sokerin aineenvaihduntaan. Etikkahapon käyttöön liittyviä lisätietoja käsitellään myöhemmin tässä artikkelissa., Kiteessä kaksi etikkahappomolekyyliä yhtyvät vetysidosten kanssa muodostaen dimeerin. Kun vettä lisätään, nämä sidokset rikkoutuvat ja kiteinen muoto liukenee.

Etikkahappoa Kaava
Etikkahappoa kaava on yksinkertainen ja tulos metyyli ryhmä ja karboksyyliryhmän., Metyyliryhmät ovat yksi planeetan yleisimmistä orgaanisista yhdisteistä, mutta niitä esiintyy harvoin yksittäisinä kokonaisuuksina. Ne koostuvat kolmesta vetyatomista ja yhdestä hiiliatomista (CH3). Koska hiilellä on neljä elektronia, vapaa elektroni sitoutuu yleensä muihin molekyyleihin kovalenttisen sidoksen kautta. Yksinkertaisin hiilimolekyyli on metaani (CH4), joka tunnetaan osaltaan ilmaston lämpenemisestä. Kanssa vapaa elektroni, metaani reagoi otsonin (O3) tuottaa hiilidioksidia ja vettä seuraavan reaktion: (3)CH4 + (4)O3 = (3)CO2 + (6)H2O., Kuvassa metaanimolekyyli koostuu metyyliryhmästä ja ylimääräisestä vetyatomista.
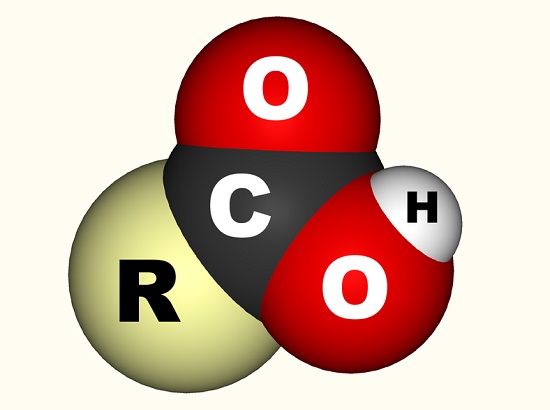
tapauksessa etikkahappoa, vapaa elektroni sitoutuu karboksyyliryhmän (CO2H, -COOH tai -C(=O)OH) joka on yksi hiilen atomi on sitoutunut hydroksyyliryhmä (-OH) ja double-sidottu happiatomiin., Alla kuva osoittaa, karboksyyli-ryhmä, jossa R edustaa muun molekyyli, jossa karboksyyliryhmä on kiinnitetty; R-kirjain on joskus korvattu mutkitteleva viiva. Etikkahapon tapauksessa R edustaa metyyliryhmää. Jotkut kuvaavat karboksyyliryhmää mieluummin karbonyyliryhmän (C=0, missä = ilmaisee kaksoissidoksen) ja hydroksyyliryhmän (O-H) yhdistelmänä. Karboksyylihapot ovat aminohappoja ja välttämättömiä jokaiselle elävälle organismille.,
on yleinen molekyylikaava kaikki karboksyylihapot, eli CnH2n+1COOH. Tämä tarkoittaa, että jokainen carboxylic acid-ominaisuuksia kaksi kertaa niin paljon vedyn atomeja kuin hiiliatomeja, kun karboksyyliryhmä on poistettu; kaava, joka sopii täydellisesti, että etikkahapon – C2H4O2. Kun karboksyyliryhmä poistetaan tästä etikkahapon kaavasta, jäljelle jää yksi hiili ja kaksi vetyatomia.,
etikkahapon faktat
etikkahapon faktat niille, jotka haluavat oppia vähän lisää!
etikkahapon moolimassa on 60,052 grammaa moolia kohti (g / mol). Moolimassa on alkuaineen tai yhdisteen (atomimassa) kokonaismassa mitattuna atomimassayksiköinä tai ”amu”, jaettuna sen määrällä mooleina (mol). Yksi mooli perustuu Avogadron numeroon 6.02214076×1023, koska tämä luku tarkoittaa, että moolien ja Daltonien, toisen atomimassan tieteellisen yksikön, vertailu on yksinkertaisempaa.,
Väkevä etikkahappo on ratkaisu etikkahappoa hyvin pieni määrä vettä – alle 1%. Sana glacial viittaa sen kidemäiseen kiinteään muotoon huoneenlämmössä. Toinen nimitys jääetikkahapolle on vedetön etikkahappo. Tämä muoto on heikko happo, mutta syövyttävä myrkky, joka aiheuttaa rakkuloita ja palovammoja. Koska on hyvin vähän vettä, jolla dissosioida, jääetikkahappo siirtyy sen protonit veteen ihon tai limakalvojen.,
Löytää oikea puskuri agentti happoa, kuten etikka-happo vaatii tietoa pH, Ka-tai pKa happoa. PH, Ka ja pKa ovat kaikki sukua toisilleen. Etikkahappo on Ka 1,8 x 10-5 tai helpompi laskea pKa-arvo 4.756. PH mittaa määrä vety-ioneja (H+) jokin ratkaisu, joka sisältää vettä ja vaihtelee 0 (hapan) 14 (base). Mitä pienempi pH on, sitä suurempi on vetyionien konsentraatio. Ka-ja pKa-liittyvät happoja ja liittyvät happo hajoamisvakio, joka osoittaa, kuinka todennäköisesti happo on luopua sen protonit., Korkea Ka kertoo, että happo on vahva ja reagoivat mitään kemiallisia lisätä sitä. PKa on päinvastainen – mitä pienempi luku, sitä voimakkaampi happo. Tämä johtuu siitä, että pKa on Ka: n negatiivinen logaritmi.
väkevällä etikkahapolla voi kuitenkin olla matalampi pH kuin vahvalla hapolla. PKA: n ansiosta, joka on vakioarvo, voimme tehdä laskelmia ilman, että meidän tarvitsee miettiä pitoisuuksia. Etikkahapon pKa on 4,756 ja tämä kertoo, kuinka todennäköistä on luopua protoneistaan liuoksessa., Emäkset mitataan sen mukaan, kuinka todennäköisesti ne poistavat protonit liuoksesta.
etikkahapon kiehumispiste on välillä 244-246°F (118-119°C) ja sen sulamispiste on välillä 61-62°F (16-17°C) tai aivan huoneenlämmössä. Etikkahapon tiheys on nestemäisessä olomuodossa 1,049 g cm−3 ja kiinteässä tilassa 1,27 g cm−3.
yleisin etikkahapon muoto on etikka, joka sisältää 5-20% etikkahappoa. Kuinka suuri laimennus on (ja siten hapon vahvuus) kutsutaan sen viljan voimaa., Voit helposti laskea tämän kertomalla pitoisuus 10. Etikka, joka sisältää 5% etikkahappoa, on viljavahvuudeltaan 50.
etikkahapon käyttö
etikkahapon käyttö on monipuolista ja monipuolista. Tätä happoa käytetään tavaroiden valmistuksessa, elintarviketeollisuudessa, puhdistusteollisuudessa, lääketieteessä ja terveyslisäaineena. Etikkahappo on myös biokemiallisia tärkeää asetyyli-ryhmän muodossa, jossa se on olennaista rakennettaessa amino hapot ja siksi mahdotonta olla ilman. Katsotaanpa muutamia näistä etikkahapon käyttötarkoituksista tarkemmin.,
Etikkahappoa Tavaroiden Valmistus
Etikka-happo on tärkeä kemiallisen reagenssin käytetään tuottamaan asetaattia, liimat, liimat, ja synteettiset kankaat. Etikkahappoa käytetään myös galvanoinnissa, jossa metallipinnoite talletetaan esineeseen asettamalla se liuokseen, joka sisältää tiettyä metallisuolaa. Liuoksen on oltava johtavaa ja vetyioneja luovuttavat hapot luovat ihanteelliset olosuhteet. Lisäksi galvanointia voi esiintyä vain liuoksessa ja metallisuolat liukenevat vain liuoksissa, joiden pH-arvo on alhainen (hapan).,
Etikkahappo on raaka-aineena käytetään tuotannossa selluloosa-asetaatti, etikkahappoanhydridi (muovit) ja chloroacetic happoa käytetään valmistuksessa väriaineiden ja torjunta-aineet sekä tietyt lääkkeet.
etikkahappo elintarviketeollisuudessa
etikkahappo, jota käytetään elintarvikkeiden happamuuden tai emäksisyyden säätelyssä. Code of Federal Regulations (CFR) luokittelee etikkahappo yleiskäyttöinen elintarvikelisäaine, joka on turvallinen, kun sitä käytetään mukaisesti hyvä valmistus käytäntöjä. Euroopassa e-numeromääräyksiä sovelletaan kaikkiin elintarvikelisäaineisiin., Etikkahappo on annettu koodi E260 ja pidetään turvallinen aine, joka ohjaa bakteerien kolonisaatiota ja sitä voidaan käyttää ilman rajoituksia. Tämä ei ole uusi havainto. Sanotaan, että muinaiset babylonialaiset käyttivät etikkaa elintarvikkeiden säilöntäaineena.
etikkaa käytetään salaattikastikkeiden, mausteiden, kuten sinapin, ketsupin ja majoneesin valmistukseen sekä kastikkeisiin ja suolakurkkuihin.,
Etikkahappo Puhdistus
Etikkahappo on käytetty puhdistusaine ja hajunpoistaja vuosisatoja ellei-tuhansia; sienet etikkaa sijoitettiin kallis filigraani renkaat kuluneet rikas kun he astuivat läpi likainen ja haiseva kahdeksastoista-luvulla kaduilla. Myös etikan deodoroivia ominaisuuksia on hyödynnetty sukupolvien ajan. Merimiehet pesivät töissä olleiden ja asuttujen laivojen kansia etikan avulla., Periaatteet mikrobien ohjaus ei ehkä ollut ymmärtänyt tuolloin, mutta raikkaan tuoksuinen, puhdas ja sairaus-estävät ominaisuudet tämä orgaaninen ratkaisu oli varmasti hyvin tiedossa.
emäksisen tuotteen lisääminen happoon aiheuttaa kuplivan, poreilevan reaktion. Jotkut perinteiset puhdistusaineet uskovat tämän vaikutuksen tuottavan syvemmän puhtaan ja vakaan pinnan., Esimerkiksi, pesee takaisin pihalle, jossa on emäksinen sooda (natriumhydroksidi) ja sitten käyttämällä etikka sekoita päälle tämä lähti reaktio, joka varmasti näyttää ikään kuin se on syvä-puhdistus toimintaa; kuitenkin, tämä ei juurikaan lisätä hygieeninen vaikutus vaan puskureita tai toimii vastoin emäksinen puhdistus teho kaustinen sooda hapan ominaisuuksia etikkaa.,
Tänään, monet omistettu fanit valkoinen etikka mainostaa ekologiset hyödyt käyttää laimennettua etikkahappoa puhdas kylpyhuone, pestä vaatteita, poistaa hajut, ja tehdä elintarvikkeiden valmistuksessa pinnat sekä puhdas ja turvallinen. Etikkahappo poistaa myös ruoste – ja kalkkiasteikkoesiintymiä.
Etikkahappoa Lääketieteessä
Etikkahappoa tai viinietikkaa on luultavasti käytetty lääketieteessä jo ennen kirjoitettu sana. Jos sinulla on kärsi avoin haava saarella Kos neljännellä vuosisadalla ennen Kristusta, saatat on määrätty päivittäinen etikkaa pestä Hippokrates., Jos sinulla on ollut kurkkukipua, hän saattaa myös kysyä voit sekoittaa hunajaa ja etikkaa tehdä Oxymel, antiikin kreikan yskänlääke;, jos sinulla on ollut tarjolla Euroopassa Ensimmäisen maailmansodan aikana, et voi vain päästä etikkaa pitää puhtaana ja pysyy vapaa-infektio.
nykyään etikkahappoliuoksia käytetään laboratorioveritestausprosesseissa liukupesuna. Ne poistaa bakteeri-biokalvot haavat ja ruoansulatuskanavan, ja on käytetty usein ulkokorvan infektiot ja niin välttää antibioottien käyttöä., Nieleminen etikkaa lisää asetaatti tasoilla paksusuolen ja edistää kalsiumin kertymä matalampi verenpaine ja korkeampi luun tiheys seurauksena. Tutkimuksissa tutkitaan asetaatin käyttöä antitumorilääkkeenä.
Etikkahappoa kuin Terveyden Täydentää
Etikkahappoa ja on suosittu terveys täydentää ja kulutetaan muodossa etikka, yleisimmin apple siideri etikka. Koentsyymi A: han sitoutuessaan etikkahapon asetyyliryhmä on keskeinen hiilihydraatti-ja rasva-aineenvaihdunnassa.,
on tehty paljon tutkimuksia etikan kulutuksen ja alhaisempien verensokeritasojen välisestä yhteydestä. Jossa korkea glykeeminen indeksi elintarvikkeita kulutetaan sen jälkeen, kun nieleminen kaksi-kolme ruokalusikallista omenaviinietikkaa, niiden glykeeminen arvot on osoitettu olevan jopa 35 prosenttia alhaisempi. Diabeetikoille tämä voisi tarkoittaa alhaisempia aterianjälkeisiä verensokerihuippuja ja parempaa glykeemistä säätelyä sekä ei-diabeetikoille pienempää riskiä sairastua insuliiniresistenssiin. Tavallisen kurkun korvaaminen pikkelöidyllä kurkulla vähensi aterian glykeemisen kokonaisindeksin arvoa 30 prosenttia.,
seuraavassa kuvassa näkyy matalan ja korkean glykeemisen indeksin (GI) ruokien vaikutus veren glukoosipitoisuuksiin. High GI foods aiheuttaa veren glukoosipitoisuuden nopean huipun, joka lisää insuliinin tuotantoa ja mahdollistaa solujen glukoosin metaboloitumisen. Tämä tarkoittaa, että verensokeri laskee nopeasti aiheuttaen nälkää. Pienet GI-ruoat aiheuttavat verensokerin lievemmän nousun eivätkä pakota haimaa tuottamaan näin suuria määriä insuliinia. Tuloksena on lempeä käyrä, joka pysyy vakaana ja ei dip, lisäämällä kylläisyyden tasoilla aterian jälkeen., Kun korkea GI ruokaa ja vähän GI ruokaa syödään samaan aikaan ne osittain peruuttaa toisiaan, mikä tasannevaikutus. Etikalla tiedetään olevan sama vaikutus kuin hyvin vähäisellä GI-ruoalla.

Kuten jo mainittiin, etikkahappo pidetään myös laihtuminen täydentää, koska sen kyky tason huippu glukoosi aterian jälkeen ja niin auttaa lisätä kylläisyyden tunnetta., On myös esitetty, että etikkahapon läsnäolo ruokavaliossa hidastaa mahalaukun tyhjenemistä, mikä auttaa myös hillitsemään joitakin ylensyönnin muotoja. Lisäksi etikka näyttää hillitsevän rasvan muodostumista jopa viidentoista millilitran vuorokausiannoksilla.