Acido acetico (Italiano)
Definizione
L’acido acetico è un acido monocarbossilico leggermente corrosivo. Altrimenti noto come acido etanoico, acido metanecarbossilico, acetato di idrogeno o acido etilico, questo composto organico viene utilizzato nella produzione chimica, come additivo alimentare e nella produzione di petrolio. La formula molecolare dell’acido acetico è C2H4O2 o CH3COOH, dove-COOH definisce la presenza del singolo gruppo carbossilico.,

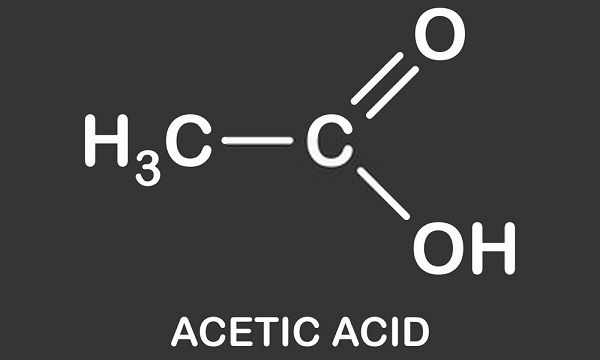
Acido Acetico Struttura
l’acido Acetico struttura è quella di un semplice acido carbossilico e si compone di un gruppo metilico collegato a un gruppo carbossilico come si vede nell’immagine qui sotto. L’acido acetico o acido etanoico è un solvente protico; è in grado di donare protoni sotto forma di idroni (atomi di idrogeno caricati positivamente)., Questa caratteristica significa che è un membro del gruppo acido di Brønsted in cui i protoni vengono donati a molecole accettore note come basi di Brønsted. L’idrogeno donato è dissociato dal gruppo carbossilico. L’aceto è una soluzione di acido acetico e acqua in cui circa lo 0,4% delle molecole di acido acetico rinuncia ai loro atomi H+ portando a una soluzione acida di circa 2,4 pH. Rispetto all’acido più forte del mondo – acido carborano (H(CHB11Cl11)) – con un valore di pH di -18, l’acido acetico è leggermente acido in confronto.,
dovrebbe essere chiaro che non è la presenza di un singolo atomo di idrogeno che modifica il pH di una soluzione. Le soluzioni neutre (né acide né alcaline) contengono un numero bilanciato di ioni idronio (H30+) e ioni idrossile (OH–). Due molecole di acqua (H20) si formano quando un idronio e uno bind idrossile si legano e le cariche positive e negative vengono annullate., Quando l’acido acetico viene aggiunto all’acqua, si divide in uno acetate acetato caricato negativamente (CH3COO–) e H+. È quindi possibile comprendere il nome alternativo di acido acetico – idrogeno acetato. Una piccola percentuale di ioni idrogeno caricati positivamente si lega alle molecole d’acqua e li trasforma in H30+. Ciò significa che ci sono più ioni idronio e, quindi, creare una soluzione carica positivamente (o acida). Il pH di una soluzione dipende quindi dall’equilibrio di idronio e idrossile e non dal numero di ioni idrogeno, sebbene questi influenzino questo equilibrio., Un valore di pH è anche dato solo a una soluzione. Una soluzione contiene sempre acqua; anche i moderni superacidi come il carborano vengono sciolti in soluzioni acquose concentrate di altri acidi. Anche l’acido acetico glaciale ha una piccola quantità di acqua.
L’immagine seguente mostra la dissociazione dell’acido acetico in acetato in acqua. A sinistra ci sono una singola molecola di acido acetico e una singola molecola d’acqua. L’acido acetico passa uno hydrogen idrogeno alla molecola d’acqua per produrre uno ion idronio. Diciamo che la molecola d’acqua è protonata o ha avuto un protone (hydron) donato ad essa.,
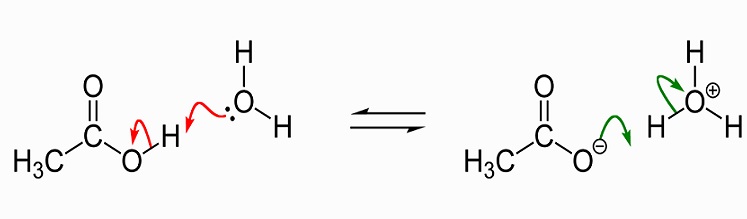
Come solvente, l’acido acetico liquido scioglie composti polari (idrofili) come sali e zuccheri e composti che includono grassi e oli. Ciò significa che ha molti usi nella produzione chimica industriale, ma ha anche guadagnato una reputazione come integratore di perdita di peso in quanto influisce sul metabolismo dei grassi e degli zuccheri. Ulteriori informazioni relative agli usi dell’acido acetico saranno discusse più avanti in questo articolo., In forma cristallina, due molecole di acido acetico si uniscono con legami idrogeno per formare un dimero. Quando viene aggiunta acqua, questi legami si rompono e la forma cristallina si dissolve.

Acido Acetico Formula
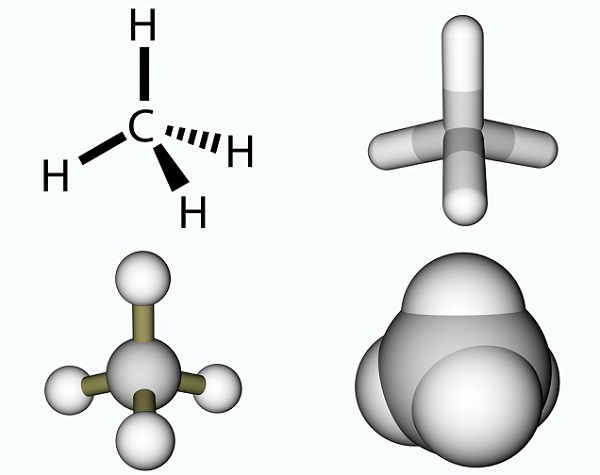
L’acido acetico formula è semplice e il risultato di un gruppo metilico e un gruppo carbossilico., I gruppi metilici sono uno dei composti organici più comuni sul pianeta, ma raramente si trovano come singole entità. Sono composti da tre atomi di idrogeno e un atomo di carbonio (CH3). Poiché il carbonio ha quattro elettroni, l’elettrone libero di solito si lega con altre molecole tramite un legame covalente. La molecola di carbonio più semplice è il metano (CH4), ben noto per il suo contributo al riscaldamento globale. Con un elettrone libero, il metano reagisce con l’ozono (O3) per produrre anidride carbonica e acqua nella seguente reazione: (3)CH4 + (4)O3 = (3)CO2 + (6)H2O., L’immagine mostra una molecola di metano composta da un gruppo metilico e un atomo di idrogeno in più.
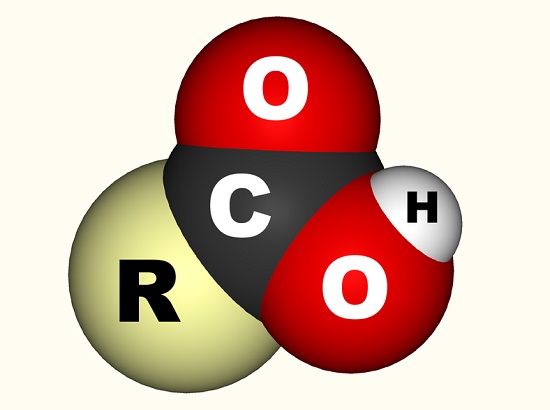
Nel caso dell’acido acetico, l’elettrone libero si lega con un gruppo carbossilico (CO2H, -COOH o -C(=O)OH) che è un singolo atomo di carbonio legato a un gruppo ossidrile (-OH) e la doppia-legato a un atomo di ossigeno., L’immagine sotto mostra un gruppo carbossilico in cui R rappresenta il resto della molecola a cui è collegato il gruppo carbossilico; la lettera R è talvolta sostituita da una linea sinuosa. Nel caso dell’acido acetico, la R rappresenta il gruppo metilico. Alcuni preferiscono descrivere il gruppo carbossilico come una combinazione di un gruppo carbonilico (C=0, dove = indica il doppio legame) e un gruppo idrossilico (O-H). Gli acidi carbossilici si trovano negli amminoacidi ed essenziali per ogni organismo vivente.,
Esiste una formula molecolare generale per tutti gli acidi carbossilici, vale a dire CnH2n+1COOH. Ciò significa che ogni acido carbossilico presenta il doppio degli atomi di idrogeno rispetto agli atomi di carbonio una volta rimosso il gruppo carbossilico; una formula che si adatta perfettamente a quella dell’acido acetico – C2H4O2. Quando si rimuove il gruppo carbossilico da questa formula di acido acetico, si rimane con un carbonio e due atomi di idrogeno.,
Acido acetico Fatti
Acido acetico fatti per coloro che vogliono imparare un po ‘ di più!
La massa molare dell’acido acetico è di 60,052 grammi per mole (g/mol). La massa molare è la massa totale di un elemento o composto (massa atomica) misurata in unità di massa atomica o ‘amu’, divisa per la sua quantità in moli (mol). Una singola mole si basa sul numero di Avogadro 6.02214076×1023 poiché questo numero significa che il confronto tra talpe e Dalton, un’altra unità scientifica di massa atomica, è più semplice.,
L’acido acetico glaciale è una soluzione di acido acetico in una quantità molto piccola di acqua – meno dell ‘ 1%. La parola glaciale si riferisce alla sua forma solida cristallina a temperatura ambiente. Un altro nome per l’acido acetico glaciale è l’acido acetico anidro. Questa forma è un acido debole ma un veleno corrosivo, causando vesciche e ustioni. Poiché c’è pochissima acqua con cui dissociarsi, l’acido acetico glaciale passerà i suoi protoni all’acqua nella pelle o nelle mucose.,
Trovare il giusto agente tampone per un acido come l’acido acetico richiede la conoscenza del pH, Ka o pKa dell’acido. Il pH, Ka e pKa sono tutti collegati tra loro. L’acido acetico ha un Ka di 1,8 x 10-5 o un valore pKa più facile da calcolare di 4,756. Il pH misura il numero di ioni idrogeno (H+) in qualsiasi soluzione che contiene acqua e varia da 0 (acido) a 14 (base). Più basso è il pH, maggiore è la concentrazione di ioni idrogeno. Il Ka e il pKa si riferiscono agli acidi e si riferiscono alla costante di dissociazione acida che mostra quanto è probabile che l’acido rinunci ai suoi protoni., Un alto Ka ci dice che un acido è forte e reagirà a qualsiasi sostanza chimica aggiunta ad esso. Il pKa è l’opposto: più piccolo è il numero, più forte è l’acido. Questo perché il pKa è un logaritmo negativo del Ka.
Tuttavia, l’acido acetico concentrato può avere un pH inferiore rispetto a un acido forte. Grazie al pKa che è un valore costante, possiamo fare calcoli senza dover pensare alle concentrazioni. Il pKa dell’acido acetico è 4.756 e questo ci dice quanto è probabile che rinunci ai suoi protoni in una soluzione., Le basi sono misurate in base alla probabilità di rimuovere i protoni da una soluzione.
Il punto di ebollizione dell’acido acetico è compreso tra 244 e 246°F (118 e 119°C) e il suo punto di fusione si trova tra 61 e 62°F (16 e 17°C) o appena sotto la temperatura ambiente. La densità dell’acido acetico è 1,049 g cm−3 allo stato liquido e 1,27 g cm−3 allo stato solido.
La forma più comunemente riconosciuta di acido acetico è l’aceto che contiene acido acetico al 5-20%. Quanto è grande la diluizione (e quindi la forza dell’acido) è indicata come la sua forza del grano., Puoi facilmente calcolare questo moltiplicando la concentrazione per 10. L’aceto contenente il 5% di acido acetico avrà una forza di grano di 50.
Usi dell’acido acetico
Gli usi dell’acido acetico sono molti e vari. Questo acido è utilizzato nella produzione di beni, nella trasformazione alimentare, nell’industria della pulizia, in medicina e come integratore sanitario. L’acido acetico è anche un essenziale biochimico in forma di gruppo acetilico dove è fondamentale per la costruzione di aminoacidi e quindi impossibile esistere senza. Diamo un’occhiata ad alcuni di questi usi di acido acetico in modo più dettagliato.,
Acido acetico nella produzione di beni
L’acido acetico è un importante reagente chimico utilizzato per produrre acetato, adesivi, colle e tessuti sintetici. L’acido acetico è utilizzato anche in galvanotecnica dove un rivestimento metallico viene depositato su un oggetto ponendolo in una soluzione che contiene un sale metallico specifico. La soluzione deve essere conduttiva e gli acidi che donano ioni idrogeno creano le condizioni ideali. Inoltre, l’elettrodeposizione può avvenire solo all’interno di una soluzione e i sali metallici si dissolvono solo in soluzioni con un basso valore di pH (acido).,
L’acido acetico è una materia prima utilizzata per la produzione di acetato di cellulosa, anidride acetica (plastica) e acido cloroacetico utilizzato nella produzione di coloranti e pesticidi, nonché alcuni farmaci.
Acido acetico nella lavorazione degli alimenti
Acido acetico utilizzato nella lavorazione degli alimenti per regolare i livelli di acidità o alcalinità degli alimenti. Il Codice dei regolamenti federali (CFR) categorizza l’acido acetico come additivo alimentare per tutti gli usi che è sicuro se usato in conformità con le buone pratiche di fabbricazione. In Europa, i regolamenti E-number si applicano a tutti gli additivi alimentari., L’acido acetico è stato dato il codice E260 ed è considerato un ingrediente sicuro che controlla la colonizzazione batterica e può essere utilizzato senza limitazioni. Questa non è una nuova scoperta. Si dice che gli antichi babilonesi usassero l’aceto come conservante alimentare.
L’aceto viene utilizzato per produrre condimenti per insalata, condimenti che includono senape, ketchup e maionese e in salse e sottaceti.,
Acido acetico per la pulizia
L’acido acetico è stato usato come prodotto per la pulizia e deodorante per secoli se non millenni; spugne di aceto sono stati collocati in costosi anelli di filigrana indossati dai ricchi ogni volta che hanno fatto un passo attraverso le strade sporche e puzzolenti del XVIII secolo. Anche le proprietà deodoranti dell’aceto sono state sfruttate per generazioni. I marinai usavano l’aceto per pulire i ponti delle navi su cui lavoravano e vivevano., I principi del controllo microbico potrebbero non essere stati compresi all’epoca, ma le caratteristiche di odore fresco, pulizia e prevenzione delle malattie di questa soluzione organica erano sicuramente ben note.
L’aggiunta di un prodotto alcalino all’acido provoca una reazione gorgogliante e frizzante. Alcuni detergenti tradizionali ritengono che questo effetto produca una pulizia più profonda su superfici stabili., Ad esempio, strofinando il cortile con soda caustica alcalina (idrossido di sodio) e quindi utilizzando un mix di aceto in cima a questo scatenerà una reazione che certamente sembra come se avesse un’azione di pulizia profonda; tuttavia, questo fa molto poco per aumentare l’effetto igienico, ma piuttosto buffer o funziona contro il potere di pulizia alcalina della soda caustica con le proprietà acide dell’aceto.,
Oggi, molti appassionati di aceto bianco pubblicizzano i benefici ecologici dell’uso di acido acetico diluito per pulire i bagni, lavare i vestiti, rimuovere gli odori e rendere le superfici di preparazione del cibo pulite e sicure. L’acido acetico rimuove anche i depositi di ruggine e calcare.
Acido acetico in medicina
L’acido acetico o l’aceto sono probabilmente stati usati in medicina da prima della parola scritta. Se avete sofferto di una ferita aperta sull’isola di Kos nel quarto secolo avanti Cristo, potrebbe essere stato prescritto un lavaggio quotidiano di aceto da Ippocrate., Se hai avuto un mal di gola, potrebbe anche aver chiesto di mescolare il miele e l’aceto per fare Oxymel, un antico greco medicina per la tosse; se tu avessi servito in Europa durante la prima guerra mondiale, si può solo avere avuto accesso a aceto mantenere pulito e rimanere privo di infezione.
Oggi le soluzioni di acido acetico vengono utilizzate nei processi di analisi del sangue di laboratorio come lavaggio a vetrino. Rimuovono i biofilm batterici nelle ferite e nel sistema digestivo e sono stati spesso utilizzati per le infezioni dell’orecchio esterno e quindi evitano l’uso di antibiotici., L’ingestione di aceto aumenta i livelli di acetato nel colon e promuove l’assorbimento di calcio con pressione sanguigna più bassa e una maggiore densità ossea di conseguenza. Gli studi stanno esaminando l’uso di acetato come farmaco antitumorale.
Acido acetico come supplemento di salute
L’acido acetico è un integratore di salute popolare e consumato sotto forma di aceto, più comunemente aceto di sidro di mele. Quando legato al coenzima A, il gruppo acetilico dell’acido acetico è centrale per il metabolismo dei carboidrati e dei grassi.,
Molto studio è stato fatto per quanto riguarda il legame tra consumo di aceto e bassi livelli di glucosio nel sangue. Dove gli alimenti ad alto indice glicemico vengono consumati dopo l’ingestione di due o tre cucchiai di aceto di sidro di mele, i loro valori glicemici hanno dimostrato di essere inferiori fino al 35%. Per i diabetici, questo potrebbe significare picchi di glucosio nel sangue post-prandiale più bassi e un migliore controllo glicemico e per i non diabetici un minor rischio di sviluppare insulino-resistenza. La sostituzione del cetriolo regolare con un cetriolo sottaceto ha mostrato una riduzione del 30% del valore totale dell’indice glicemico del pasto.,
L’immagine seguente mostra l’effetto degli alimenti a basso e alto indice glicemico (GI) sui livelli di glucosio nel sangue. Gli alimenti ad alto indice glicemico causano un rapido picco dei livelli di glucosio nel sangue che aumentano la produzione di insulina che consente alle cellule di metabolizzare il glucosio. Ciò significa che il livello di glucosio nel sangue si abbassa rapidamente, causando la fame. Gli alimenti a basso indice glicemico causano un aumento più delicato della glicemia e non costringono il pancreas a produrre grandi quantità di insulina. Il risultato è una curva delicata che rimane stabile e non si abbassa, aumentando i livelli di sazietà dopo un pasto., Quando un cibo ad alto indice glicemico e un cibo a basso indice glicemico vengono mangiati allo stesso tempo, si annullano parzialmente a vicenda, creando un effetto plateau. L’aceto è noto per avere lo stesso effetto di un alimento IG molto basso.

Come già accennato, l’acido acetico è anche considerato un integratore per la perdita di peso grazie alla sua capacità di livellare il glucosio di picco dopo i pasti e così via. aiuta ad aumentare la sazietà., Si suggerisce inoltre che la presenza di acido acetico nella dieta rallenta lo svuotamento gastrico che aiuta anche a controllare alcune forme di eccesso di cibo. Inoltre, l’aceto sembra scoraggiare la formazione di grasso in dosi di appena quindici millilitri al giorno.