kwas octowy
definicja
kwas octowy jest lekko korozyjnym kwasem monokarboksylowym. Inaczej znany jako kwas etanowy, kwas metanokarboksylowy, octan wodoru lub kwas etylowy, ten związek organiczny jest stosowany w produkcji chemicznej, jako dodatek do żywności oraz w produkcji ropy naftowej. Wzór cząsteczkowy kwasu octowego to C2H4O2 lub CH3COOH, gdzie-COOH określa obecność pojedynczej grupy karboksylowej.,

struktura kwasu octowego
struktura kwasu octowego jest strukturą prostego kwasu karboksylowego kwas i składa się z grupy metylowej przyłączonej do grupy karboksylowej, jak widać na poniższym obrazku. Kwas octowy lub kwas etanowy jest rozpuszczalnikiem protowym; jest w stanie przekazać protony w postaci hydronów (dodatnio naładowanych atomów wodoru)., Cecha ta oznacza, że należy do grupy kwasów Brønsteda, w której protony są oddawane cząsteczkom akceptora znanym jako zasady Brønsteda. Wodór wydzielany jest z grupy karboksylowej. Ocet jest roztworem kwasu octowego i wody, w którym około 0,4% cząsteczek kwasu octowego rezygnuje z atomów H+, co prowadzi do uzyskania kwaśnego roztworu o pH około 2,4. w porównaniu z najsilniejszym na świecie kwasem – kwasem karboranowym (H(CHB11Cl11)) – o pH -18, kwas octowy jest w porównaniu lekko kwaśny.,
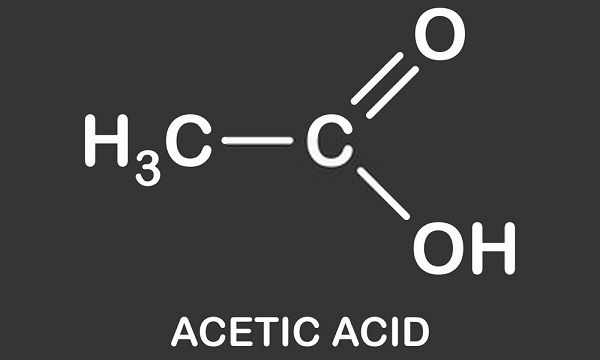
It należy wyjaśnić, że to nie obecność pojedynczego atomu wodoru zmienia pH roztworu. Roztwory obojętne (ani kwasowe, ani zasadowe) zawierają zrównoważoną liczbę jonów hydroniowych (H30+) i hydroksylowych (OH -). Dwie cząsteczki wody (H20) powstają, gdy wiązają się jon hydroniowy i hydroksylowy, a ładunki dodatnie i ujemne są anulowane., Gdy kwas octowy jest dodawany do wody, dzieli się na Ujemnie naładowany jon octanowy (CH3COO -) i H+. Można zatem zrozumieć alternatywną nazwę kwasu octowego-octan wodoru. Niewielki procent dodatnio naładowanych jonów wodorowych wiąże się z cząsteczkami wody i zamienia je w H30+. Oznacza to, że jest więcej jonów hydroniowych, a zatem tworzą dodatnio naładowany (lub kwaśny) roztwór. PH roztworu zależy zatem od równowagi hydronium i hydroksylu, a nie od liczby jonów wodorowych, chociaż będą one miały wpływ na tę równowagę., Wartość pH jest również podawana tylko do roztworu. Roztwór zawsze zawiera wodę; nawet nowoczesne superacydy, takie jak karboran, rozpuszczają się w stężonych wodnych roztworach innych kwasów. Nawet lodowaty kwas octowy ma niewielką ilość wody.
poniższy obraz pokazuje dysocjację kwasu octowego do octanu w wodzie. Po lewej stronie znajduje się pojedyncza cząsteczka kwasu octowego i pojedyncza cząsteczka wody. Kwas octowy przekazuje jon wodorowy do cząsteczki wody w celu wytworzenia jonu hydroniowego. Mówimy, że cząsteczka wody jest protonowana lub miała do niej Proton (hydron).,
jako rozpuszczalnik ciekły kwas octowy rozpuszcza polarne (hydrofilowe) związki, takie jak sole i cukry oraz związki niepolarne które obejmują tłuszcze i oleje. Oznacza to, że ma wiele zastosowań w przemysłowej produkcji chemicznej, ale zyskał również reputację jako suplement odchudzający, ponieważ wpływa na metabolizm tłuszczu i cukru. Więcej informacji dotyczących zastosowań kwasu octowego zostanie omówionych w dalszej części tego artykułu., W postaci krystalicznej dwie cząsteczki kwasu octowego łączą się ze sobą wiązaniami wodorowymi, tworząc dimer. Po dodaniu wody wiązania te są łamane i forma krystaliczna rozpuszcza się.

formuła kwasu octowego
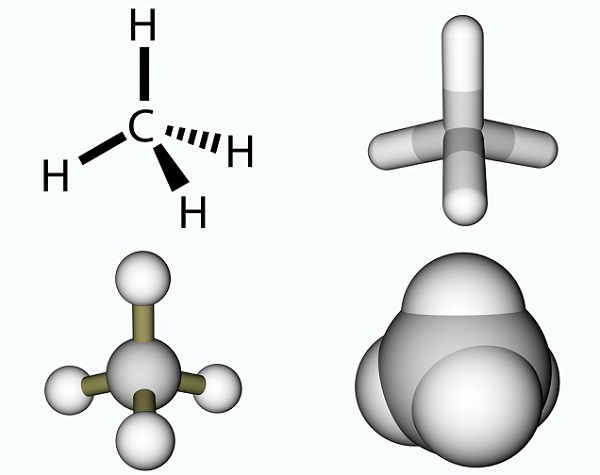
wzór kwasu octowego jest prosty i jest wynikiem grupy metylowej i grupy karboksylowej., Grupy metylowe są jednym z najczęstszych związków organicznych na planecie, ale rzadko występują jako pojedyncze jednostki. Składają się z trzech atomów wodoru i jednego atomu węgla (CH3). Ponieważ węgiel ma cztery elektrony, wolny elektron zwykle wiąże się z innymi cząsteczkami za pomocą wiązania kowalencyjnego. Najprostszą cząsteczką węgla jest metan (CH4), znany ze swojego wkładu w globalne ocieplenie. Z wolnym elektronem Metan reaguje z ozonem (O3), wytwarzając dwutlenek węgla i wodę w następującej reakcji: (3)CH4 + (4)O3 = (3)CO2 + (6) H2O., Zdjęcie przedstawia cząsteczkę metanu składającą się z grupy metylowej i dodatkowego atomu wodoru.
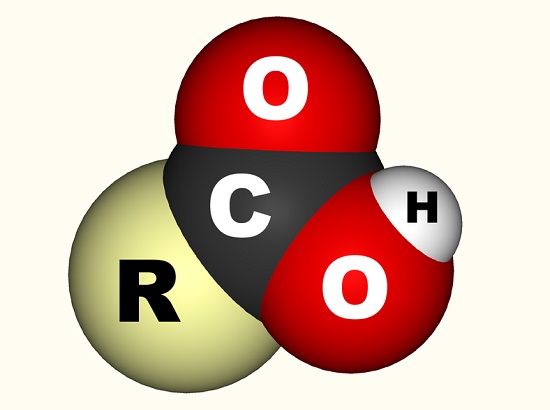
w przypadku kwasu octowego wolny elektron wiąże się z grupą karboksylową (CO2H,- COOH lub-C(=O)oh), który jest pojedynczym atomem węgla przyłączonym do grupy hydroksylowej (-OH) i Podwójnie przyłączonym do atomu tlenu., Poniższy obraz pokazuje grupę karboksylową, gdzie R reprezentuje resztę cząsteczki, do której przyłączona jest grupa karboksylowa; litera R jest czasami zastępowana przez linię wiggly. W przypadku kwasu octowego r reprezentuje grupę metylową. Niektórzy wolą opisać grupę karboksylową jako połączenie grupy karbonylowej (C=0, gdzie = oznacza wiązanie podwójne) i grupy hydroksylowej (O-H). Kwasy karboksylowe znajdują się w aminokwasach i są niezbędne dla każdego żywego organizmu.,
istnieje ogólny wzór cząsteczkowy dla wszystkich kwasów karboksylowych, a mianowicie CnH2n+1cooh. Oznacza to, że każdy kwas karboksylowy zawiera dwa razy więcej atomów wodoru niż atomy węgla po usunięciu grupy karboksylowej; wzór, który idealnie pasuje do wzoru kwasu octowego-C2H4O2. Po usunięciu grupy karboksylowej z tego wzoru kwasu octowego zostaje jeden węgiel i dwa atomy wodoru.,
fakty kwasu octowego
fakty kwasu octowego dla tych, którzy chcą dowiedzieć się trochę więcej!
Masa molowa kwasu octowego wynosi 60,052 gramów na mol (g / mol). Masa molowa to całkowita masa pierwiastka lub związku (masa atomowa) mierzona w jednostkach masy atomowej lub „UAM”, podzielona przez jego ilość w Mol (mol). Pojedynczy mol jest oparty na liczbie Avogadro 6.02214076×1023, ponieważ liczba ta oznacza, że porównanie moli i Daltonów, innej naukowej jednostki masy atomowej, jest prostsze.,
lodowaty kwas octowy jest roztworem kwasu octowego w bardzo małej ilości wody – mniej niż 1%. Słowo lodowiec odnosi się do jego krystalicznej postaci stałej w temperaturze pokojowej. Inna nazwa lodowatego kwasu octowego to bezwodny kwas octowy. Postać ta jest słabym kwasem, ale żrącą trucizną, powodującą powstawanie pęcherzy i oparzeń. Ponieważ jest bardzo mało wody, z którą można dysocjować, lodowaty kwas octowy przechodzi na protony do wody w skórze lub błonach śluzowych.,
znalezienie odpowiedniego środka buforującego dla kwasu, takiego jak kwas octowy, wymaga znajomości pH, Ka lub pKa kwasu. PH, Ka i pKa są ze sobą powiązane. Kwas octowy ma Ka 1,8 x 10-5 lub łatwiejszą do obliczenia wartość pKa 4,756. PH mierzy liczbę jonów wodorowych (H+) w dowolnym roztworze zawierającym wodę i waha się od 0 (kwaśny) do 14 (zasadowy). Im niższe pH, tym wyższe stężenie jonów wodorowych. Ka i pKa odnoszą się do kwasów i odnoszą się do stałej dysocjacji kwasu, która pokazuje, jak prawdopodobne jest, że kwas zrezygnuje ze swoich protonów., Wysoki Ka mówi nam, że kwas jest silny i reaguje z każdą dodaną do niego substancją chemiczną. PKa jest odwrotnie – im mniejsza liczba, tym silniejszy kwas. Wynika to z faktu, że PKA jest logarytmem ujemnym Ka.
jednak stężony kwas octowy może mieć niższe pH niż silny kwas. Dzięki pKa, która jest wartością stałą, możemy wykonywać obliczenia bez konieczności myślenia o stężeniach. PKA kwasu octowego wynosi 4,756, a to mówi nam, jak prawdopodobne jest, że zrezygnuje on ze swoich protonów w roztworze., Zasady są mierzone według prawdopodobieństwa usunięcia protonów z roztworu.
temperatura wrzenia kwasu octowego wynosi między 244 i 246°F (118 i 119°C), a jego temperatura topnienia mieści się między 61 i 62°F (16 i 17°C) lub tylko w temperaturze pokojowej. Gęstość kwasu octowego wynosi 1,049 g cm-3 w stanie ciekłym, a 1,27 g cm-3 w stanie stałym.
najczęściej rozpoznawaną formą kwasu octowego jest ocet, który zawiera 5-20% kwasu octowego. Jak wielkie jest rozcieńczenie (a tym samym wytrzymałość kwasu) określa się jego wytrzymałość na ziarno., Można to łatwo obliczyć mnożąc stężenie przez 10. Ocet zawierający 5% kwasu octowego będzie miał wytrzymałość ziarna 50.
zastosowania kwasu octowego
zastosowania kwasu octowego są liczne i zróżnicowane. Kwas ten jest stosowany w produkcji towarów, w przetwórstwie żywności, w przemyśle czyszczącym, w medycynie i jako suplement zdrowotny. Kwas octowy jest również niezbędny biochemicznie w postaci grupy acetylowej, gdzie ma zasadnicze znaczenie dla budowy aminokwasów i dlatego nie może istnieć bez nich. Spójrzmy bardziej szczegółowo na kilka z tych zastosowań kwasu octowego.,
kwas octowy w produkcji towarów
kwas octowy jest ważnym odczynnikiem chemicznym stosowanym do produkcji octanów, klejów, klejów i tkanin syntetycznych. Kwas octowy jest również stosowany w galwanizacji, gdzie powłoka metalowa jest osadzana na obiekcie, umieszczając go w roztworze zawierającym określoną sól metalu. Roztwór musi być przewodzący, a kwasy oddające jony wodorowe tworzą idealne warunki. Ponadto galwanizacja może wystąpić tylko w roztworze, a sole metali rozpuszczają się tylko w roztworach o niskiej (kwaśnej) wartości pH.,
kwas octowy jest surowcem używanym do produkcji octanu celulozy, bezwodnika octowego (tworzyw sztucznych) i kwasu chlorooctowego stosowanego do produkcji barwników i pestycydów, a także niektórych leków.
kwas octowy w przetwórstwie spożywczym
kwas octowy stosowany w przetwórstwie spożywczym do regulacji poziomu kwasowości lub zasadowości żywności. Kodeks Przepisów Federalnych (CFR) klasyfikuje kwas octowy jako dodatek do żywności ogólnego przeznaczenia, który jest bezpieczny, gdy jest stosowany zgodnie z dobrymi praktykami produkcyjnymi. W Europie przepisy dotyczące numeru E mają zastosowanie do wszystkich dodatków do żywności., Kwas octowy otrzymał kod E260 i jest uważany za bezpieczny składnik, który kontroluje kolonizację bakteryjną i może być stosowany bez ograniczeń. To nie jest nowe odkrycie. Mówi się, że starożytni Babilończycy używali octu jako środka konserwującego żywność.
ocet jest używany do produkcji sosów sałatkowych, przypraw, w tym musztardy, ketchupu i majonezu, a także w sosach i ogórkach.,
kwas octowy do czyszczenia
kwas octowy był używany jako środek czyszczący i dezodorant od wieków, jeśli nie tysiącleci; gąbki octu były umieszczane w drogich filigranowych pierścieniach noszonych przez bogatych, gdy przechodzili przez brudne i śmierdzące osiemnastowieczne ulice. Właściwości dezodoryzujące octu zostały również wykorzystane przez pokolenia. Marynarze używali octu do szorowania pokładów statków, na których pracowali i mieszkali., Zasady kontroli mikrobiologicznej nie mogły być rozumiane w tym czasie, ale świeżo pachnące, czyste i zapobiegające chorobom cechy tego organicznego roztworu były zdecydowanie dobrze znane.
dodanie produktu alkalicznego do kwasu powoduje reakcję bulgotania, gazowania. Niektóre tradycyjne środki czyszczące uważają, że efekt ten powoduje głębsze czyszczenie stabilnych powierzchni., Na przykład szorowanie podwórka za pomocą alkalicznej sody kaustycznej (wodorotlenku sodu), a następnie użycie mieszanki octu na wierzchu spowoduje reakcję, która z pewnością wygląda tak, jakby miała działanie głęboko czyszczące; jednak robi to bardzo mało, aby zwiększyć higieniczny efekt, ale raczej buforuje lub działa przeciwko zasadowej mocy czyszczenia sody kaustycznej o kwaśnych właściwościach octu.,
dziś wielu oddanych fanów białego octu reklamuje ekologiczne korzyści płynące z używania rozcieńczonego kwasu octowego do czyszczenia łazienek, prania ubrań, usuwania zapachów i sprawiania, że powierzchnie do przygotowywania żywności są czyste i bezpieczne. Kwas octowy usuwa również osady rdzy i kamienia wapiennego.
kwas octowy w medycynie
kwas octowy lub ocet prawdopodobnie był używany w medycynie od czasów przed słowem pisanym. Gdybyś cierpiał na otwartą ranę na wyspie Kos w IV wieku przed Chrystusem, być może Hipokrates przepisał ci codzienne mycie octem., Jeśli miał ból gardła, mógł również poprosić o mieszanie miodu i octu, aby Oxymel, starożytny grecki lek na kaszel; jeśli służył w Europie podczas Pierwszej Wojny Światowej, być może miał tylko dostęp do octu zachować czyste i pozostają wolne od infekcji.
obecnie roztwory kwasu octowego są stosowane w procesach laboratoryjnych badań krwi jako płuczka ślizgowa. Usuwają biofilmy bakteryjne w ranach i układzie trawiennym, i często były używane do infekcji ucha zewnętrznego, a więc unikają stosowania antybiotyków., Spożycie octu zwiększa poziom octanu w okrężnicy i promuje wychwyt wapnia z niższym ciśnieniem krwi i większą gęstość kości w wyniku. Badania dotyczą stosowania octanu jako leku przeciwnowotworowego.
kwas octowy jako suplement zdrowia
kwas octowy jest popularnym suplementem zdrowotnym i spożywanym w postaci octu, najczęściej octu jabłkowego. Po związaniu z koenzymem A, grupa acetylowa kwasu octowego odgrywa kluczową rolę w metabolizmie węglowodanów i tłuszczów.,
przeprowadzono wiele badań dotyczących związku między spożyciem octu a niższym poziomem glukozy we krwi. Gdy żywność o wysokim indeksie glikemicznym jest spożywana po spożyciu dwóch do trzech łyżek octu jabłkowego, ich wartości glikemiczne okazały się być nawet o 35% niższe. Dla diabetyków może to oznaczać niższe poziomy stężenia glukozy we krwi po posiłku i lepszą kontrolę glikemii, a dla osób niebędących diabetykami mniejsze ryzyko rozwoju insulinooporności. Zastąpienie zwykłego ogórka ogórkiem kiszonym wykazało 30% zmniejszenie całkowitej wartości indeksu glikemicznego posiłku.,
poniższy obrazek przedstawia wpływ pokarmów o niskim i wysokim indeksie glikemicznym (IG) na poziom glukozy we krwi. Pokarmy o wysokim IG powodują szybki szczyt poziomu glukozy we krwi, który zwiększa produkcję insuliny, co umożliwia komórkom metabolizowanie glukozy. Oznacza to, że poziom glukozy we krwi szybko spada, powodując głód. Pokarmy o niskim IG powodują łagodniejszy wzrost poziomu cukru we krwi i nie zmuszają trzustki do produkcji tak dużych ilości insuliny. Rezultatem jest delikatna krzywa, która pozostaje stabilna i nie zanurza się, zwiększając poziom sytości po posiłku., Gdy żywność o wysokim i niskim IG jest spożywana w tym samym czasie, częściowo się anulują, tworząc efekt plateau. Ocet jest znany z tego samego efektu, co żywność o bardzo niskim IG.

jak już wspomniano, kwas octowy jest również uważany za suplement odchudzania ze względu na jego zdolność do poziomowania szczytowej glukozy po posiłkach, a więc pomaga zwiększyć sytość., Sugeruje się również, że obecność kwasu octowego w diecie spowalnia opróżnianie żołądka, co pomaga również kontrolować niektóre formy przejadania się. Ponadto ocet wydaje się zniechęcać do tworzenia tłuszczu w dawkach zaledwie piętnastu mililitrów dziennie.