Essigsäure
Definition
Essigsäure ist eine leicht ätzende Monocarbonsäure. Diese organische Verbindung wird auch als Ethansäure, Methancarboxylsäure, Wasserstoffacetat oder Ethylsäure bezeichnet und wird in der chemischen Herstellung, als Lebensmittelzusatzstoff und in der Erdölproduktion verwendet. Die molekulare Formel von Essigsäure ist C2H4O2 oder CH3COOH, wobei-COOH das Vorhandensein der einzelnen Carboxylgruppe definiert.,

Essigsäurestruktur
Essigsäurestruktur ist die einer einfachen Carbonsäure und besteht aus einer Methylgruppe, die an eine Carboxylgruppe gebunden ist, wie in der Abbildung unten zu sehen ist. Essigsäure oder Ethansäure ist ein protisches Lösungsmittel; Es ist in der Lage, Protonen in Form von Hydronen (positiv geladene Wasserstoffatome) zu spenden., Diese Eigenschaft bedeutet, dass es ein Mitglied der Brønsted-Säuregruppe ist, in der Protonen an Akzeptormoleküle gespendet werden, die als Brønsted-Basen bekannt sind. Der gespendete Wasserstoff wird von der Carboxylgruppe dissoziiert. Essig ist eine Lösung aus Essigsäure und Wasser, bei der etwa 0,4% der Essigsäuremoleküle ihre H+ – Atome aufgeben, was zu einer sauren Lösung von etwa 2,4 pH führt. Im Vergleich zur weltweit stärksten Säure – Carboransäure (H(CHB11Cl11)) – mit einem pH-Wert von -18 ist Essigsäure im Vergleich leicht sauer.,
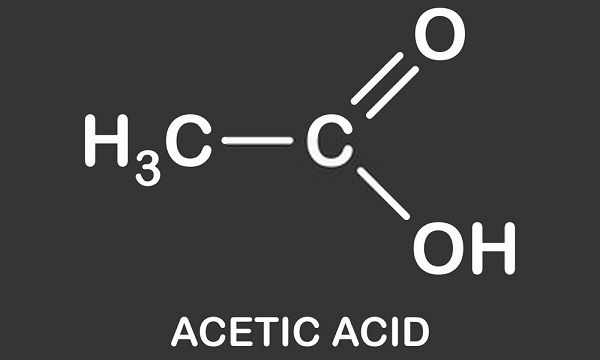
Es sollte klargestellt werden, dass nicht das Vorhandensein eines einzelnen Wasserstoffatoms den pH-Wert einer Lösung verändert. Neutrale Lösungen (weder sauer noch alkalisch) enthalten eine ausgewogene Anzahl von Hydroniumionen (H30+) und Hydroxylionen (OH–). Zwei Moleküle Wasser (H20) werden gebildet, wenn sich ein Hydronium-und ein Hydroxyl-Ion binden und die positiven und negativen Ladungen abgebrochen werden., Wenn Essigsäure zu Wasser gegeben wird, spaltet es sich in ein negativ geladenes Acetation (CH3COO–) und H+auf. Es ist daher möglich, den alternativen Namen von Essigsäure – Wasserstoffacetat-zu verstehen. Ein kleiner Prozentsatz positiv geladener Wasserstoffionen bindet an die Wassermoleküle und verwandelt sie in H30+. Dies bedeutet, dass es mehr Hydroniumionen gibt und daher eine positiv geladene (oder saure) Lösung entsteht. Der pH-Wert einer Lösung hängt daher vom Gleichgewicht von Hydronium und Hydroxyl und nicht von der Anzahl der Wasserstoffionen ab, obwohl diese dieses Gleichgewicht beeinflussen., Ein pH-Wert wird auch nur einer Lösung gegeben. Eine Lösung enthält immer Wasser; Selbst moderne Superazide wie Carboran werden in konzentrierten wässrigen Lösungen anderer Säuren gelöst. Sogar Gletscheressigsäure hat eine geringe Menge Wasser.
Das folgende Bild zeigt die Dissoziation von Essigsäure zu Acetat in Wasser. Auf der linken Seite befinden sich ein einzelnes Essigsäuremolekül und ein einzelnes Wassermolekül. Essigsäure gibt ein Wasserstoffion an das Wassermolekül weiter, um ein Hydroniumion zu erzeugen. Wir sagen, dass das Wassermolekül protoniert ist oder ein Proton (Hydron) gespendet hat.,
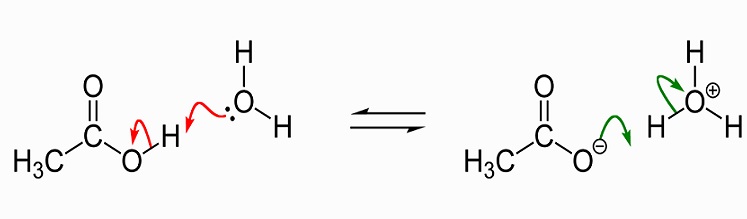
Als Lösungsmittel löst flüssige Essigsäure polare (hydrophile) Verbindungen wie Salze und Zucker und unpolare Verbindungen auf, zu denen Fette und Öle gehören. Dies bedeutet, dass es viele Anwendungen in der industriellen chemischen Produktion hat, aber auch einen Ruf als Gewichtsverlust Ergänzung gewonnen hat, da es den Fett-und Zuckerstoffwechsel beeinflusst. Weitere Informationen zur Verwendung von Essigsäure werden später in diesem Artikel erörtert., In kristalliner Form verbinden sich zwei Essigsäuremoleküle mit Wasserstoffbrücken zu einem Dimer. Wenn Wasser hinzugefügt wird, werden diese Bindungen gebrochen und die kristalline Form löst sich auf.

Essigsäureformel
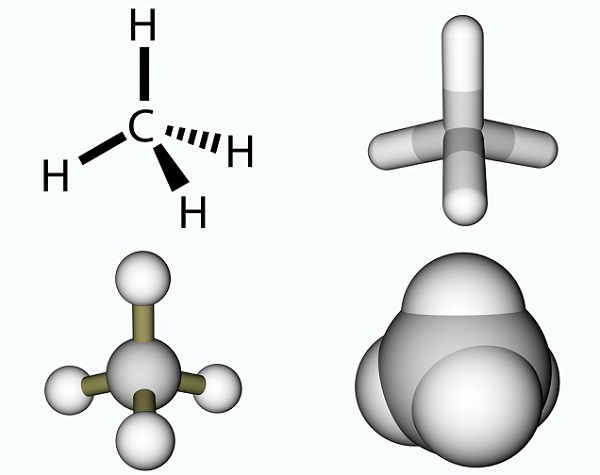
Die Essigsäureformel ist einfach und das Ergebnis einer Methylgruppe und einer Carboxylgruppe., Methylgruppen sind eine der häufigsten organischen Verbindungen auf dem Planeten, werden jedoch selten als einzelne Einheiten gefunden. Sie bestehen aus drei Wasserstoffatomen und einem Kohlenstoffatom (CH3). Da Kohlenstoff vier Elektronen hat, verbindet sich das freie Elektron normalerweise über eine kovalente Bindung mit anderen Molekülen. Das einfachste Kohlenstoffmolekül ist Methan (CH4), das für seinen Beitrag zur globalen Erwärmung bekannt ist. Mit einem freien Elektron reagiert Methan mit Ozon (O3), um Kohlendioxid und Wasser in der folgenden Reaktion zu erzeugen: (3)CH4 + (4)O3 = (3)CO2 + (6)H2O., Das Bild zeigt ein Methanmolekül aus einer Methylgruppe und einem zusätzlichen Wasserstoffatom.
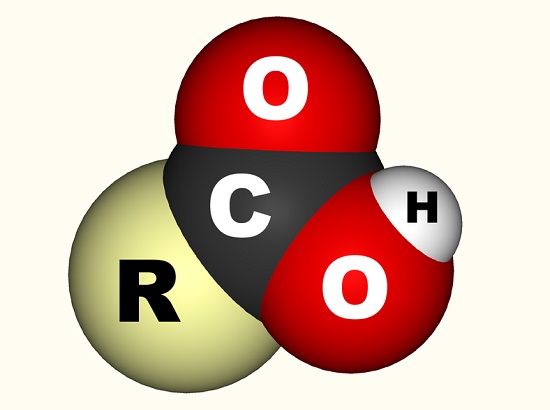
Im Falle von Essigsäure bindet das freie Elektron mit einer Carboxylgruppe (CO2H,- COOH oder-C(=O)OH), die ein einzelnes Kohlenstoffatom ist, das an eine Hydroxylgruppe gebunden ist (-OH) und doppelt an ein Sauerstoffatom gebunden., Das folgende Bild zeigt eine Carboxylgruppe, wobei R den Rest des Moleküls darstellt, an das die Carboxylgruppe angehängt ist; Der Buchstabe R wird manchmal durch eine wackelige Linie ersetzt. Bei Essigsäure repräsentiert das R die Methylgruppe. Einige bevorzugen es, die Carboxylgruppe als eine Kombination aus einer Carbonylgruppe (C=0, wobei = die Doppelbindung angibt) und einer Hydroxylgruppe (O-H) zu beschreiben. Carbonsäuren sind in Aminosäuren enthalten und für jeden lebenden Organismus essentiell.,
Es gibt eine allgemeine Molekularformel für alle Carbonsäuren, nämlich CnH2n+1COOH. Dies bedeutet, dass jede Carbonsäure doppelt so viele Wasserstoffatome aufweist wie Kohlenstoffatome, sobald die Carboxylgruppe entfernt wurde.eine Formel, die perfekt zu der von Essigsäure passt – C2H4O2. Wenn Sie die Carboxylgruppe aus dieser Essigsäureformel entfernen, verbleiben ein Kohlenstoff-und zwei Wasserstoffatome.,
Essigsäure Fakten
Essigsäure Fakten für diejenigen, die ein wenig mehr lernen wollen!
Die Molmasse der Essigsäure beträgt 60,052 Gramm pro Mol (g/mol). Molmasse ist die Gesamtmasse eines Elements oder einer Verbindung (Atommasse), gemessen in Atommasseneinheiten oder „amu“, dividiert durch seine Menge in Mol (mol). Ein einzelner Mol basiert auf der Avogadro-Zahl 6.02214076×1023, da diese Zahl bedeutet, dass der Vergleich zwischen Molen und Daltonen, einer anderen wissenschaftlichen Einheit der Atommasse, einfacher ist.,
Glaziale Essigsäure ist eine Lösung von Essigsäure in einer sehr kleinen Menge Wasser – weniger als 1%. Das Wort Gletscher bezieht sich auf seine kristallartige feste Form bei Raumtemperatur. Ein anderer Name für Eisessigsäure ist wasserfreie Essigsäure. Diese Form ist eine schwache Säure, aber ein ätzendes Gift, das Blasenbildung und Verbrennungen verursacht. Da es sehr wenig Wasser gibt, mit dem sich dissoziieren lässt, wird Gletscheressigsäure ihre Protonen an das Wasser in der Haut oder den Schleimhäuten weitergeben.,
Das Finden des richtigen Puffermittels für eine Säure wie Essigsäure erfordert Kenntnisse über den pH-Wert, Ka oder pKa der Säure. Die pH, Ka und pKa sind alle miteinander verwandt. Essigsäure hat einen Ka von 1,8 x 10-5 oder einen leichter zu berechnenden pKa-Wert von 4,756. Der pH-Wert misst die Anzahl der Wasserstoffionen (H+) in jeder Lösung, die Wasser enthält und von 0 (sauer) bis 14 (Base) reicht. Je niedriger der pH-Wert, desto höher die Konzentration von Wasserstoffionen. Die Ka und pKa beziehen sich auf Säuren und beziehen sich auf die Säuredissoziationskonstante, die zeigt, wie wahrscheinlich es ist, dass die Säure ihre Protonen aufgibt., Ein hoher Ka sagt uns, dass eine Säure stark ist und auf jede hinzugefügte Chemikalie reagiert. Die pKa ist das Gegenteil – je kleiner die Zahl, desto stärker die Säure. Dies liegt daran, dass die pKa ein negativer Logarithmus der Ka ist.
Konzentrierte Essigsäure kann jedoch einen niedrigeren pH-Wert als eine starke Säure haben. Dank der pKa, die ein konstanter Wert ist, können wir Berechnungen durchführen, ohne über Konzentrationen nachdenken zu müssen. Die pKa von Essigsäure ist 4.756 und das sagt uns, wie wahrscheinlich es ist, seine Protonen in einer Lösung aufzugeben., Basen werden gemessen, je nachdem, wie wahrscheinlich es ist, dass sie Protonen aus einer Lösung entfernen.
Der Siedepunkt von Essigsäure liegt zwischen 244 und 246°F (118 und 119°C) und sein Schmelzpunkt liegt zwischen 61 und 62°F (16 und 17°C) oder knapp unter Raumtemperatur. Die Dichte der Essigsäure beträgt 1,049 g cm-3 in flüssigem Zustand und 1,27 g cm−3 in festem Zustand.
Die am häufigsten anerkannte Form von Essigsäure ist Essig, der 5-20% Essigsäure enthält. Wie groß die Verdünnung ist (und damit die Stärke der Säure), wird als Kornstärke bezeichnet., Sie können dies leicht berechnen, indem Sie die Konzentration mit 10 multiplizieren. Essig mit 5% Essigsäure hat eine Kornstärke von 50.
Die Verwendung von Essigsäure
Die Verwendung von Essigsäure ist vielfältig. Diese Säure wird in der Warenherstellung, in der Lebensmittelverarbeitung, in der Reinigungsindustrie, in der Medizin und als Nahrungsergänzungsmittel verwendet. Essigsäure ist auch ein biochemisches essentielles in Acetylgruppenform, wo sie für den Aufbau von Aminosäuren von grundlegender Bedeutung ist und daher ohne sie nicht existieren kann. Schauen wir uns einige dieser Essigsäure-Anwendungen genauer an.,
Essigsäure in der Warenherstellung
Essigsäure ist ein wichtiges chemisches Reagenz zur Herstellung von Acetat, Klebstoffen, Klebstoffen und synthetischen Geweben. Essigsäure wird auch beim Galvanisieren verwendet, wo eine Metallbeschichtung auf ein Objekt aufgebracht wird, indem es in eine Lösung gegeben wird, die ein bestimmtes Metallsalz enthält. Die Lösung muss leitfähig sein und Säuren, die Wasserstoffionen spenden, schaffen ideale Bedingungen. Weiterhin kann Galvanik nur innerhalb einer Lösung erfolgen und Metallsalze lösen sich nur in Lösungen mit einem niedrigen (sauren) pH-Wert auf.,
Essigsäure ist ein Rohstoff zur Herstellung von Celluloseacetat, Essigsäureanhydrid (Kunststoffen) und Chloressigsäure zur Herstellung von Farbstoffen und Pestiziden sowie bestimmten Arzneimitteln.
Essigsäure in der Lebensmittelverarbeitung
Essigsäure, die in der Lebensmittelverarbeitung zur Regulierung des Säuregehalts oder der Alkalität von Lebensmitteln verwendet wird. Der Code of Federal Regulations (CFR) kategorisiert Essigsäure als Allzweck-Lebensmittelzusatzstoff, der sicher ist, wenn er in Übereinstimmung mit guten Herstellungspraktiken verwendet wird. In Europa gelten die E-Number-Vorschriften für alle Lebensmittelzusatzstoffe., Essigsäure hat den Code E260 erhalten und gilt als sicherer Inhaltsstoff, der die Besiedlung von Bakterien kontrolliert und uneingeschränkt verwendet werden kann. Dies ist kein neuer Befund. Es wird gesagt, dass die alten Babylonier Essig als Lebensmittelkonservierungsmittel verwendeten.
Essig wird zur Herstellung von Salatdressings, Gewürzen wie Senf, Ketchup und Mayonnaise sowie in Saucen und Gurken verwendet.,
Essigsäure zur Reinigung
Essigsäure wird seit Jahrhunderten, wenn nicht Jahrtausenden, als Reinigungsmittel und Desodorierer verwendet; Essigschwämme wurden in teure filigrane Ringe gesteckt, die von den Reichen getragen wurden, wenn sie durch schmutzige und stinkende Straßen des 18. Die desodorierenden Eigenschaften von Essig werden ebenfalls seit Generationen ausgenutzt. Seeleute benutzten Essig, um die Decks der Schiffe zu schrubben, auf denen sie arbeiteten und lebten., Die Prinzipien der mikrobiellen Kontrolle wurden zu dieser Zeit vielleicht nicht verstanden, aber die frisch riechenden, sauberen und krankheitsverhindernden Eigenschaften dieser organischen Lösung waren definitiv bekannt.
Die Zugabe eines alkalischen Produkts zu Säure verursacht eine sprudelnde, brutzelnde Reaktion. Einige traditionelle Reiniger glauben, dass dieser Effekt eine tiefere saubere bis stabile Oberflächen erzeugt., Wenn Sie beispielsweise den Hinterhof mit alkalischer Natronlauge (Natriumhydroxid) schrubben und dann eine Essigmischung darüber verwenden, wird eine Reaktion ausgelöst, die sicherlich so aussieht, als hätte sie eine Tiefenreinigungswirkung; Dies erhöht jedoch nur sehr wenig die hygienische Wirkung, sondern puffert oder wirkt gegen die alkalische Reinigungskraft der Natronlauge mit den sauren Eigenschaften von Essig.,
Heute werben viele engagierte Fans von weißem Essig für die ökologischen Vorteile der Verwendung von verdünnter Essigsäure, um Badezimmer zu reinigen, Kleidung zu waschen, Gerüche zu entfernen und Oberflächen für die Zubereitung von Lebensmitteln sauber und sicher zu machen. Essigsäure entfernt auch Rost – und Kalkablagerungen.
Essigsäure in der Medizin
Essigsäure oder Essig wird wahrscheinlich seit vor dem geschriebenen Wort in der Medizin verwendet. Sollten Sie im vierten Jahrhundert vor Christus auf der Insel Kos an einer offenen Wunde gelitten haben, wurde Ihnen möglicherweise eine tägliche Essigwäsche von Hippokrates verschrieben., Wenn Sie Halsschmerzen hatten, hätte er Sie vielleicht auch gebeten, Honig und Essig zu mischen, um Oxymel herzustellen, ein altgriechisches Hustenmittel; Wenn Sie während des Ersten Weltkriegs in Europa gedient hätten, hätten Sie möglicherweise nur Zugang zu Essig gehabt, um sauber zu bleiben und frei von Infektionen zu bleiben.
Heute werden Essigsäurelösungen in Labor-Bluttestverfahren als Gleitwäsche eingesetzt. Sie entfernen bakterielle Biofilme in Wunden und im Verdauungssystem und wurden häufig bei Außenohrentzündungen eingesetzt und vermeiden so den Einsatz von Antibiotika., Die Einnahme von Essig erhöht den Acetatspiegel im Dickdarm und fördert die Kalziumaufnahme mit niedrigerem Blutdruck und höherer Knochendichte. Studien untersuchen die Verwendung von Acetat als Antitumormittel.
Essigsäure als Nahrungsergänzungsmittel
Essigsäure ist ein beliebtes Nahrungsergänzungsmittel und wird in Form von Essig, am häufigsten Apfelessig, konsumiert. Bei der Bindung an Coenzym A ist die Acetylgruppe der Essigsäure von zentraler Bedeutung für den Kohlenhydrat-und Fettstoffwechsel.,
Es wurde viel über den Zusammenhang zwischen Essigkonsum und niedrigeren Blutzuckerspiegeln untersucht. Wenn Lebensmittel mit hohem glykämischen Index nach der Einnahme von zwei bis drei Esslöffeln Apfelessig konsumiert werden, sind ihre glykämischen Werte nachweislich um bis zu 35% niedriger. Für Diabetiker könnte dies niedrigere postprandiale Blutzuckerspitzen und eine bessere Blutzuckerkontrolle sowie für Nicht-Diabetiker ein geringeres Risiko für die Entwicklung einer Insulinresistenz bedeuten. Die Substitution einer normalen Gurke durch eine eingelegte Gurke zeigte eine 30% ige Verringerung des gesamtglykämischen Indexwerts der Mahlzeit.,
Das folgende Bild zeigt die Wirkung von Lebensmitteln mit niedrigem und hohem glykämischen Index (GI) auf den Blutzuckerspiegel. Lebensmittel mit hohem GI verursachen einen schnellen Höhepunkt des Blutzuckerspiegels, der die Insulinproduktion erhöht, wodurch die Zellen Glukose metabolisieren können. Dies bedeutet, dass der Blutzuckerspiegel schnell sinkt und Hunger verursacht. Lebensmittel mit niedrigem GI verursachen einen sanfteren Anstieg des Blutzuckers und zwingen die Bauchspeicheldrüse nicht, so große Mengen Insulin zu produzieren. Das Ergebnis ist eine sanfte Kurve, die stabil bleibt und nicht abfällt und das Sättigungsgefühl nach einer Mahlzeit erhöht., Wenn gleichzeitig ein Lebensmittel mit hohem GI und ein Lebensmittel mit niedrigem GI gegessen werden, heben sie sich teilweise auf und erzeugen einen Plateaueffekt. Essig hat bekanntermaßen die gleiche Wirkung wie ein Lebensmittel mit sehr niedrigem GI.

Wie bereits erwähnt, wird Essigsäure aufgrund ihrer Fähigkeit, die Spitzenglukose nach den Mahlzeiten zu nivellieren, auch als Nahrungsergänzungsmittel zur Gewichtsreduktion angesehen., Es wird auch vorgeschlagen, dass das Vorhandensein von Essigsäure in der Nahrung die Magenentleerung verlangsamt, was auch dazu beiträgt, einige Formen des Überessens zu kontrollieren. Darüber hinaus scheint Essig die Fettbildung in Dosen von nur fünfzehn Millilitern pro Tag zu verhindern.