acide acétique
définition
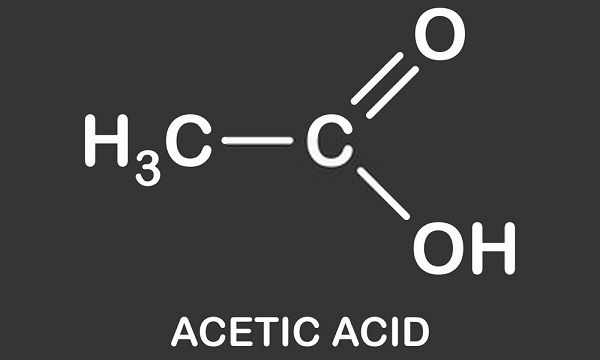
l’acide acétique est un acide monocarboxylique légèrement corrosif. Autrement connu sous le nom d’acide éthanoïque, d’acide méthanécarboxylique, d’acétate d’hydrogène ou d’acide éthylique, ce composé organique est utilisé dans la fabrication chimique, comme additif alimentaire et dans la production de pétrole. La Formule moléculaire de l’acide acétique est C2H4O2 ou CH3COOH, où-COOH définit la présence du seul groupe carboxyle.,

l’Acide Acétique Structure
l’acide Acétique structure est celle d’un simple acide carboxylique et se compose d’un groupe méthyle à un groupe carboxyle comme on le voit dans l’image ci-dessous. L’acide acétique ou l’acide éthanoïque est un solvant protique; il est capable de donner des protons sous forme d’hydrons (atomes d’hydrogène chargés positivement)., Cette caractéristique signifie qu’il fait partie du groupe acide de Brønsted où les protons sont donnés à des molécules acceptrices connues sous le nom de bases de Brønsted. L’hydrogène donné est dissocié du groupe carboxyle. Le vinaigre est une solution d’acide acétique et d’eau où environ 0,4% des molécules d’acide acétique abandonnent leurs atomes H+ conduisant à une solution acide d’environ 2,4 pH. en comparaison avec l’acide le plus fort du monde – l’acide carborane (h(CHB11Cl11)) – avec une valeur de pH de -18, l’acide acétique,
Il doit être clair que ce n’est pas la présence d’un seul atome d’hydrogène qui modifie le pH d’une solution. Les solutions neutres (ni acides ni alcalines) contiennent un nombre équilibré d’ions hydronium (H30+) et d’ions hydroxyle (OH–). Deux molécules d’eau (H20) se forment lorsqu’un ion hydronium et hydroxyle se lient et que les charges positives et négatives sont annulées., Lorsque l’acide acétique est ajouté à l’eau, il se divise en un ion acétate chargé négativement (CH3COO–) et H+. Il est donc possible de comprendre le nom alternatif de l’acide acétique – Acétate d’hydrogène. Un petit pourcentage d’ions hydrogène chargés positivement se lient aux molécules d’eau et les transforment en H30+. Cela signifie qu’il y a plus d’ions hydronium et, par conséquent, créer une solution chargée positivement (ou acide). Le pH d’une solution dépend donc de l’équilibre de l’hydronium et de l’hydroxyle et non du nombre d’ions hydrogène, bien que ceux-ci affectent cet équilibre., Une valeur de pH n’est également donnée qu’à une solution. Une solution contient toujours de l’eau; même les superacides modernes tels que le carborane sont dissous dans des solutions aqueuses concentrées d’autres acides. Même l’acide acétique glacial a une petite quantité d’eau.
L’image suivante montre la dissociation de l’acide acétique à l’acétate d’eau. À gauche se trouvent une seule molécule d’acide acétique et une seule molécule d’eau. L’acide acétique transmet un ion hydrogène à la molécule d’eau pour produire un ion hydronium. Nous disons que la molécule d’eau est protonée ou qu’un proton (hydron) lui a été donné.,
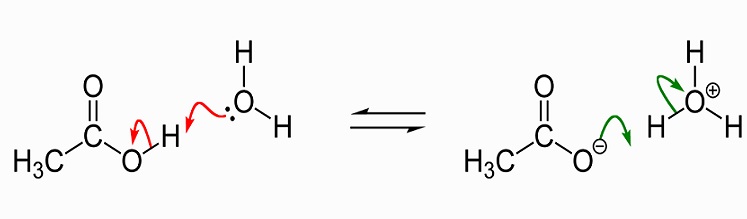
en tant que solvant, l’acide acétique liquide dissout les composés polaires (hydrophiles) tels que les sels et les sucres et composés polaires qui comprennent les graisses et les huiles. Cela signifie qu’il a de nombreuses utilisations dans la production chimique industrielle, mais a également acquis une réputation de supplément de perte de poids car il affecte le métabolisme des graisses et du sucre. Plus d’informations concernant les utilisations de l’acide acétique seront discutées plus loin dans cet article., Sous forme cristalline, deux molécules d’acide acétique se rejoignent avec des liaisons hydrogène pour former un dimère. Lorsque de l’eau est ajoutée, ces liaisons sont rompues et la forme cristalline se dissout.

l’Acide Acétique de Formule
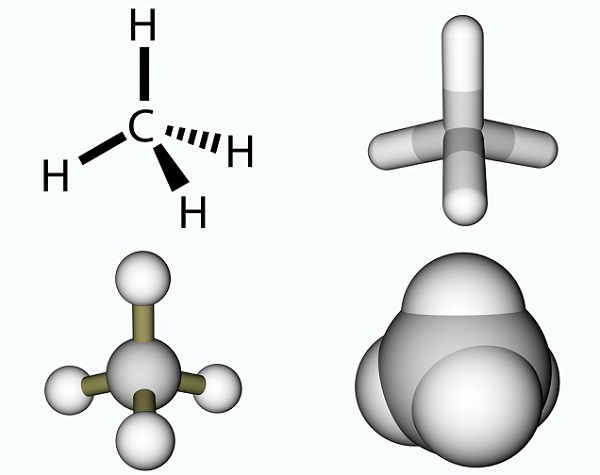
L’acide acétique formule est simple et le résultat d’un groupe méthyle et un groupe carboxyle., Les groupes méthyle sont l’un des composés organiques les plus courants sur la planète, mais sont rarement trouvés en tant qu’entités uniques. Ils sont composés de trois atomes d’hydrogène et d’un atome de carbone (CH3). Comme le carbone a quatre électrons, l’électron libre se lie généralement à d’autres molécules par le biais d’une liaison covalente. La molécule de carbone la plus simple est le méthane (CH4), bien connu pour sa contribution au réchauffement climatique. Avec un électron libre, le méthane réagit avec l’ozone (O3)pour produire du dioxyde de carbone et de l’eau dans la réaction suivante: (3)CH4 + (4)O3 = (3)CO2 + (6) H2O., La photo montre une molécule de méthane composé d’un groupe méthyle ou un atome d’hydrogène.
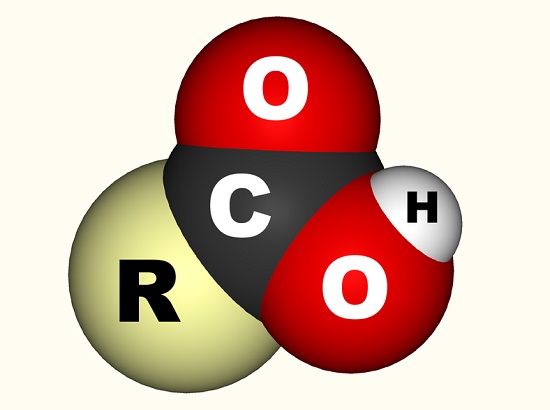
dans le cas de l’acide acétique, l’électron libre se lie avec un groupe carboxyle (CO2H, -COOH ou-C(=O)OH) qui est un atome de carbone simple lié à un groupe hydroxyle (-OH) et double lié à un atome d’oxygène., L’image ci-dessous montre un groupe carboxyle où R représente le reste de la molécule à laquelle le groupe carboxyle est attaché; la lettre R est parfois remplacée par une ligne ondulée. Dans le cas de l’acide acétique, R représente le groupe méthyle. Certains préfèrent décrire le groupe carboxyle comme une combinaison d’un groupe carbonyle (C=0, où = indique la double liaison) et un groupe hydroxyle (O-H). Les acides carboxyliques se trouvent dans les acides aminés et sont essentiels à tout organisme vivant.,
Il existe une formule moléculaire pour tous les acides carboxyliques, à savoir CnH2n+1COOH. Cela signifie que chaque acide carboxylique comporte deux fois plus d’atomes d’hydrogène que d’atomes de carbone une fois que le groupe carboxyle est éliminé; une formule qui correspond parfaitement à celle de l’acide acétique – C2H4O2. Lorsque vous retirez le groupe carboxyle de cette formule d’acide acétique, il vous reste un carbone et deux atomes d’hydrogène.,
l’Acide Acétique Faits
l’acide Acétique faits pour ceux qui veulent en savoir un peu plus!
La masse molaire de l’acide acétique est 60.052 grammes par mole (g/mol). La masse molaire est la masse totale d’un élément ou d’un composé (masse atomique) mesurée en unités de masse atomique ou « amu », divisée par sa quantité en moles (mol). Une seule mole est basée sur le nombre D’Avogadro 6.02214076×1023 car ce nombre signifie que la comparaison entre les taupes et les Daltons, une autre unité scientifique de masse atomique, est plus simple.,
l’acide acétique Glacial est une solution d’acide acétique dans une très petite quantité d’eau – moins de 1%. Le mot glacial fait référence à sa forme solide cristalline à température ambiante. Un autre nom pour l’acide acétique glacial est l’acide acétique anhydre. Cette forme est un acide faible mais un poison corrosif, provoquant des cloques et des brûlures. Comme il y a très peu d’eau avec laquelle se dissocier, l’acide acétique glacial transmettra ses protons à l’eau de la peau ou des muqueuses.,
Trouver le bon agent tampon pour un acide tel que l’acide acétique nécessite la connaissance du pH, Ka ou pKa de l’acide. Le pH, le Ka et le pKa sont tous liés les uns aux autres. L’acide acétique a un Ka de 1,8 x 10-5 ou une valeur PKA plus facile à calculer de 4,756. Le pH mesure le nombre d’ions hydrogène (H+) dans toute solution contenant de l’eau et varie de 0 (acide) à 14 (base). Plus le pH est bas, Plus la concentration en ions hydrogène est élevée. Le Ka et le pKa se rapportent aux acides et se rapportent à la constante de dissociation acide qui montre la probabilité que l’acide abandonne ses protons., Un Ka élevé nous indique qu’un acide est fort et réagira à tout produit chimique ajouté. Le pKa est le contraire – plus le nombre est petit, plus l’acide. En effet, le pKa est un logarithme négatif du Ka.
cependant, l’acide acétique concentré peut avoir un pH inférieur à celui d’un acide fort. Grâce au pKa qui est une valeur constante, nous pouvons faire des calculs sans avoir à penser aux concentrations. Le pKa de l’acide acétique est de 4,756 et cela nous indique à quel point il est probable qu’il abandonne ses protons dans une solution., Les Bases sont mesurées en fonction de leur probabilité d’éliminer les protons d’une solution.
le point d’ébullition de l’acide acétique se situe entre 244 et 246°F (118 et 119°C) et son point de fusion se situe entre 61 et 62°F (16 et 17°C) ou juste sous la température ambiante. L’acide acétique est la densité est 1.049 g cm−3 à l’état liquide, et 1,27 g cm−3 à l’état solide.
la forme d’acide acétique la plus communément reconnue est le vinaigre qui contient 5 à 20% d’acide acétique. L’importance de la dilution (et donc de la force de l’acide) est appelée sa force de grain., Vous pouvez facilement calculer cela en multipliant la concentration par 10. Le vinaigre contenant 5% d’acide acétique aura une force de grain de 50.
Utilise de l’Acide Acétique
l’acide Acétique les utilisations sont nombreuses et variées. Cet acide est utilisé dans la fabrication de biens, dans la transformation des aliments, dans l’industrie du nettoyage, en médecine et comme complément de santé. L’acide acétique est également un essentiel biochimique sous forme de groupe acétyle où il est fondamental pour la construction des acides aminés et donc impossible d’exister sans. Jetons un oeil à quelques-unes de ces acide acétique utilise plus en détail.,
acide acétique dans la fabrication de biens
l’acide acétique est un réactif chimique important utilisé pour produire de l’acétate, des adhésifs, des colles et des tissus synthétiques. L’acide acétique est également utilisé en galvanoplastie où un revêtement métallique est déposé sur un objet en le plaçant dans une solution contenant un sel métallique spécifique. La solution doit être conductrice et les acides qui donnent des ions hydrogène créent des conditions idéales. De plus, la galvanoplastie ne peut se produire que dans une solution et les sels métalliques ne se dissolvent que dans des solutions à pH faible (acide).,
l’acide acétique est une matière première utilisée pour la production d’acétate de cellulose, d’anhydride acétique (plastiques) et d’acide chloroacétique utilisé dans la production de colorants et de pesticides ainsi que de certains médicaments.
l’Acide Acétique dans la Transformation des Aliments
l’acide Acétique utilisé dans la transformation des aliments pour réguler l’acidité ou de l’alcalinité des niveaux des aliments. Le Code of Federal Regulations (CFR) classe l’acide acétique comme un additif alimentaire à usage général qui est sans danger lorsqu’il est utilisé conformément aux bonnes pratiques de fabrication. En Europe, la réglementation du numéro électronique s’applique à tous les additifs alimentaires., L’acide acétique a reçu le code E260 et est considéré comme un ingrédient sûr qui contrôle la colonisation bactérienne et peut être utilisé sans limitation. Ce n’est pas une découverte. On dit que les anciens Babyloniens utilisaient le vinaigre comme conservateur alimentaire.
Le vinaigre est utilisé pour produire des vinaigrettes, des condiments qui comprennent la moutarde, le ketchup et la mayonnaise, ainsi que dans les sauces et les cornichons.,
acide acétique pour le nettoyage
l’acide acétique a été utilisé comme produit de nettoyage et désodorisant pendant des siècles, voire des millénaires; des éponges de vinaigre ont été placées dans des anneaux en filigrane coûteux portés par les riches chaque fois qu’ils traversaient les rues sales et puantes du XVIIIe siècle. Les propriétés désodorisantes du vinaigre sont également exploitées depuis des générations. Les marins utilisaient du vinaigre pour frotter les ponts des navires sur lesquels ils travaillaient et vivaient., Les principes du contrôle microbien n’ont peut-être pas été compris à l’époque, mais les caractéristiques odorantes, propres et prévenant les maladies de cette solution organique étaient certainement bien connues.
L’ajout d’un produit alcalin à l’acide provoque une réaction bouillonnante et pétillante. Certains nettoyants traditionnels croient que cet effet produit un nettoyage plus profond pour les surfaces stables., Par exemple, frotter la cour arrière avec de la soude caustique alcaline (hydroxyde de sodium), puis utiliser un mélange de vinaigre sur le dessus de cela déclenchera une réaction qui semble certainement avoir une action de nettoyage en profondeur; cependant, cela ne fait que très peu pour augmenter l’effet hygiénique, mais plutôt tamponne ou agit contre le pouvoir nettoyant alcalin de la soude caustique avec les propriétés acides du vinaigre.,
Aujourd’hui, de nombreux fans dévoués du vinaigre blanc annoncent les avantages écologiques de l’utilisation d’acide acétique dilué pour nettoyer les salles de bains, laver les vêtements, éliminer les odeurs et rendre les surfaces de préparation des aliments propres et sûres. L’acide acétique élimine également les dépôts de rouille et de calcaire.
l’Acide Acétique en Médecine
l’acide Acétique ou le vinaigre a probablement été utilisé en médecine depuis l’avant de la parole écrite. Si vous aviez souffert d’une blessure ouverte sur L’Île de Kos au quatrième siècle avant Jésus-Christ, Hippocrate vous a peut-être prescrit un lavage quotidien au vinaigre., Si vous aviez mal à la gorge, il vous aurait peut-être aussi demandé de mélanger du miel et du vinaigre pour faire de L’Oxymel, un ancien médicament grec contre la toux; si vous aviez servi en Europe pendant la Première Guerre mondiale, vous n’auriez peut-être eu accès qu’au vinaigre.
Aujourd’hui, les solutions d’acide acétique sont utilisées dans les processus de tests sanguins en laboratoire comme lavage de lames. Ils éliminent les biofilms bactériens dans les plaies et le système digestif, et ont souvent été utilisés pour les infections de l’oreille externe et évitent ainsi l’utilisation d’antibiotiques., L’Ingestion de vinaigre augmente les niveaux d’acétate dans le côlon et favorise l’absorption du calcium avec une pression artérielle plus basse et une densité osseuse plus élevée. Des études examinent l’utilisation de l’acétate comme médicament antitumoral.
L’acide acétique comme supplément de santé
l’acide acétique est un supplément de santé Populaire et consommé sous forme de vinaigre, le plus souvent du vinaigre de cidre de pomme. Lorsqu’il est lié à la coenzyme A, le groupe acétyle de l’acide acétique est au cœur du métabolisme des glucides et des graisses.,
de nombreuses études ont été faites concernant le lien entre la consommation de vinaigre et la baisse de la glycémie. Lorsque des aliments à indice glycémique élevé sont consommés après l’ingestion de deux à trois cuillères à soupe de vinaigre de cidre de pomme, leurs valeurs glycémiques se sont avérées jusqu’à 35% inférieures. Pour les diabétiques, cela pourrait signifier des pics de glycémie post-prandial plus faibles et un meilleur contrôle glycémique et pour les non-diabétiques un risque plus faible de développer une résistance à l’insuline. La Substitution du concombre ordinaire par un concombre mariné a montré une réduction de 30% de la valeur de l’indice glycémique total du repas.,
l’image suivante montre l’effet des aliments à indice glycémique bas et élevé (IG) sur la glycémie. Les aliments à IG élevé provoquent un pic rapide de la glycémie qui augmente la production d’insuline, ce qui permet aux cellules de métaboliser le glucose. Cela signifie que le taux de glucose sanguin baisse rapidement, provoquant la faim. Les aliments à faible IG provoquent une augmentation plus douce de la glycémie et ne forcent pas le pancréas à produire de si grandes quantités d’insuline. Le résultat est une courbe douce qui reste stable et ne plonge pas, augmentant les niveaux de satiété après un repas., Lorsqu’un aliment à IG élevé et un aliment à IG faible sont consommés en même temps, ils s’annulent partiellement, créant un effet de plateau. Le vinaigre est connu pour avoir le même effet qu’un aliment à très faible IG.

Comme déjà mentionné, l’acide acétique est également considéré comme un supplément de perte de poids en raison de sa capacité à niveler le pic de glucose après les repas et donc, aide à augmenter la satiété., Il est également suggéré que la présence d’acide acétique dans l’alimentation ralentit la vidange gastrique, ce qui aide également à contrôler certaines formes de suralimentation. En outre, le vinaigre semble décourager la formation de graisse à des doses aussi faibles que quinze millilitres par jour.