ácido acético
definición
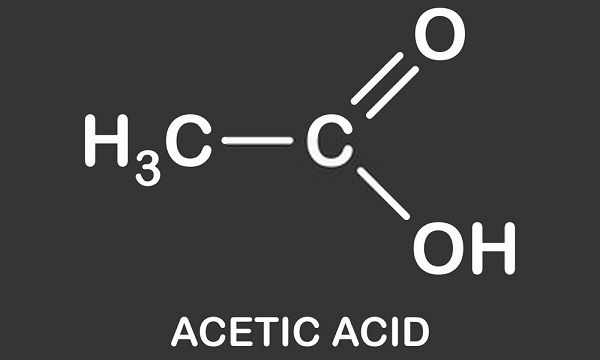
El ácido acético es un ácido monocarboxílico ligeramente corrosivo. También conocido como ácido etanoico, ácido metanocarboxílico, acetato de hidrógeno o ácido etílico, este compuesto orgánico se utiliza en la fabricación química, como aditivo alimentario y en la producción de petróleo. La Fórmula molecular del ácido acético es C2H4O2 o CH3COOH, donde-COOH define la presencia del único grupo carboxilo.,

estructura del ácido acético
un ácido carboxílico simple y consiste en un grupo metilo unido a un grupo carboxilo como se ve en la imagen de abajo. El ácido acético o ácido etanoico es un solvente protico; es capaz de donar protones en forma de hidrones (átomos de hidrógeno cargados positivamente)., Esta característica significa que es un miembro del grupo ácido de Brønsted donde los protones son donados a moléculas aceptoras conocidas como bases de Brønsted. El hidrógeno donado está disociado del grupo carboxilo. El vinagre es una solución de ácido acético y agua donde aproximadamente el 0.4% de las moléculas de ácido acético ceden sus átomos H+, lo que conduce a una solución ácida de aproximadamente 2.4 pH. en comparación con el ácido más fuerte del mundo, el ácido carborano (h(CHB11Cl11)), con un valor de pH de -18, el ácido acético es ligeramente ácido en comparación.,
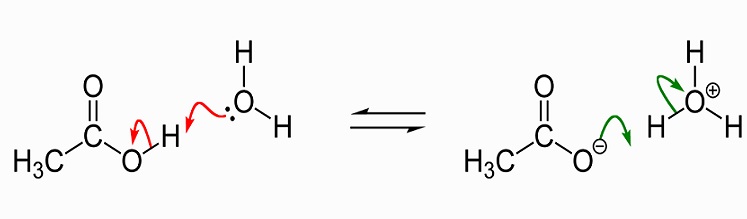
debe quedar claro que no es la presencia de un único átomo de hidrógeno que cambia el pH de una solución. Las soluciones neutras (ni ácidas ni alcalinas) contienen un número equilibrado de iones hidronio (H30+) e iones hidroxilo (OH–). Dos moléculas de agua (H20) se forman cuando un hidronio y un ion hidroxilo se unen y las cargas positivas y negativas se cancelan., Cuando el ácido acético se agrega al agua, se divide en un ion acetato cargado negativamente (CH3COO -) y H+. Por lo tanto, es posible entender el nombre alternativo de ácido acético – acetato de hidrógeno. Un pequeño porcentaje de iones de hidrógeno cargados positivamente se unen a las moléculas de agua y las convierten en H30+. Esto significa que hay más iones de hidronio y, por lo tanto, crean una solución cargada positivamente (o ácida). El pH de una solución es, por lo tanto, dependiente del equilibrio de hidronio e hidroxilo y no del número de iones de hidrógeno, aunque estos afectarán este equilibrio., Un valor de pH también se da solo a una solución. Una solución siempre contiene agua; incluso los superácidos modernos como el carborano se disuelven en soluciones acuosas concentradas de otros ácidos. Incluso el ácido acético glacial tiene una pequeña cantidad de agua.
la siguiente imagen muestra la disociación del ácido acético al acetato en agua. A la izquierda hay una sola molécula de ácido acético y una sola molécula de agua. El ácido acético pasa un ion hidrógeno a la molécula de agua para producir un ion hidronio. Decimos que la molécula de agua está protonada o ha tenido un protón (hidrón) donado a ella.,
Como disolvente, el ácido acético líquido disuelve compuestos polares (hidrofílicos) como sales y azúcares y-compuestos polares que incluyen grasas y aceites. Esto significa que tiene muchos usos en la producción química industrial, pero también ha ganado una reputación como un suplemento de pérdida de peso, ya que afecta el metabolismo de la grasa y el azúcar. Más información relacionada con los usos del ácido acético se discutirá más adelante en este artículo., En forma cristalina, dos moléculas de ácido acético se unen con enlaces de hidrógeno para formar un dímero. Cuando se agrega agua, estos enlaces se rompen y la forma cristalina se disuelve.

Ácido Acético Fórmula
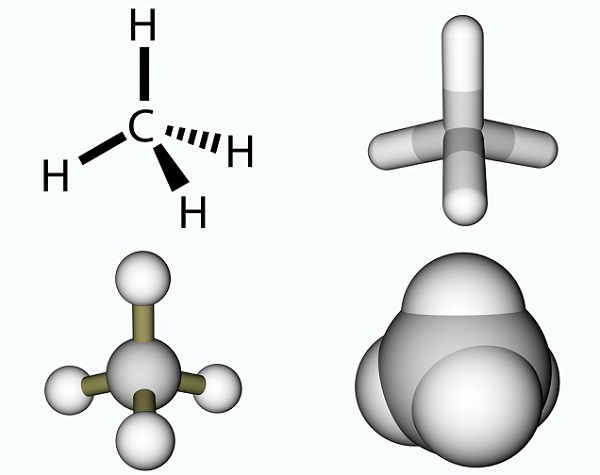
El ácido acético fórmula es sencilla y el resultado de un grupo metilo y un grupo carboxilo., Los grupos metilo son uno de los compuestos orgánicos más comunes en el planeta, pero rara vez se encuentran como entidades individuales. Están compuestos por tres átomos de hidrógeno y un átomo de carbono (CH3). Como el carbono tiene cuatro electrones, el electrón libre generalmente se une con otras moléculas por medio de un enlace covalente. La molécula de carbono más simple es el metano (CH4), bien conocido por su contribución al calentamiento global. Con un electrón libre, El metano reacciona con el ozono (O3)para producir dióxido de carbono y agua en la siguiente reacción: (3)CH4 + (4)O3 = (3)CO2 + (6) H2O., La imagen muestra una molécula de metano compuesta por un grupo metilo y un átomo de hidrógeno extra.
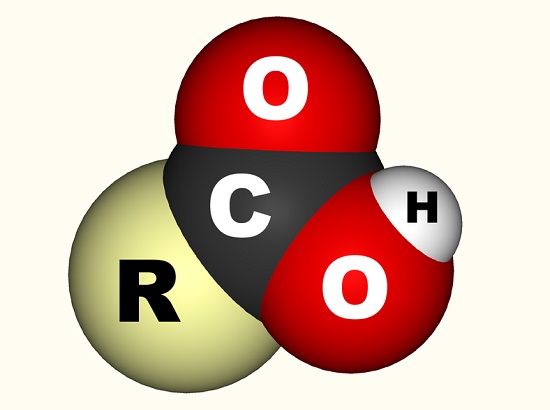
En el caso del ácido acético, el electrón libre se une con un grupo carboxilo (CO2H, -COOH o -C(=O)OH) que es un solo átomo de carbono unido a un grupo hidroxilo (-OH) y doble-unido a un átomo de oxígeno., La siguiente imagen muestra un grupo carboxilo donde R representa el resto de la molécula a la que está unido el grupo carboxilo; la letra R A veces es reemplazada por una línea ondulada. En el caso del ácido acético, la R representa el grupo metilo. Algunos prefieren describir el grupo carboxilo como una combinación de un grupo carbonilo (C=0, donde = indica el doble enlace) y un grupo hidroxilo (O-H). Los ácidos carboxílicos se encuentran en los aminoácidos y son esenciales para todos los organismos vivos.,
en general, Hay una fórmula molecular para todos los ácidos carboxílicos, a saber: CnH2n+1COOH. Esto significa que cada ácido carboxílico presenta dos veces más átomos de hidrógeno que átomos de carbono una vez que se elimina el grupo carboxilo; una fórmula que encaja perfectamente con la del ácido acético – C2H4O2. Cuando eliminas el grupo carboxilo de esta fórmula de ácido acético, te quedas con un carbono y dos átomos de hidrógeno.,
hechos de ácido acético
hechos de ácido acético para aquellos que quieren aprender un poco más!
la masa molar de ácido acético es de 60.052 gramos por mol (g/mol). La masa Molar es la masa total de un elemento o compuesto (masa atómica) medida en unidades de masa atómica o ‘uma’, dividida por su cantidad en moles (mol). Un solo lunar se basa en el número de Avogadro 6.02214076×1023, ya que este número significa que la comparación entre moles y Daltons, otra unidad científica de masa atómica, es más simple.,
El ácido acético Glacial es una solución de ácido acético en una cantidad muy pequeña de agua, menos del 1%. La palabra glacial se refiere a su forma sólida cristalina a temperatura ambiente. Otro nombre para el ácido acético glacial es ácido acético anhidro. Esta forma es un ácido débil pero un veneno corrosivo, causando ampollas y quemaduras. Como hay muy poca agua con la que disociarse, el ácido acético glacial pasará sus protones al agua de la piel o las membranas mucosas.,
Encontrar el agente tampón adecuado para un ácido como el ácido acético requiere el conocimiento del pH, Ka o pKa del ácido. El pH, Ka y pKa están todos relacionados entre sí. El ácido acético tiene un Ka de 1.8 x 10-5 o un valor PKA más fácil de calcular de 4.756. El pH mide el número de iones de hidrógeno (H+) en cualquier solución que contenga agua y oscila entre 0 (ácido) y 14 (base). Cuanto menor sea el pH, mayor será la concentración de iones de hidrógeno. El Ka y el pKa se relacionan con los ácidos y se relacionan con la constante de disociación del ácido que muestra la probabilidad de que el ácido renuncie a sus protones., Un Ka alto nos dice que un ácido es fuerte y reaccionará a cualquier producto químico que se le agregue. El pKa es lo contrario: cuanto más pequeño es el número, más fuerte es el ácido. Esto se debe a que el pKa es un logaritmo negativo del Ka.
sin embargo, el ácido acético concentrado puede tener un pH más bajo que un ácido fuerte. Gracias al pKa, que es un valor constante, podemos hacer cálculos sin tener que pensar en concentraciones. El pKa del ácido acético es de 4.756 y esto nos dice qué tan probable es que renuncie a sus protones en una solución., Las Bases se miden de acuerdo con la probabilidad de que eliminen protones de una solución.
el punto de ebullición del ácido acético está entre 244 y 246°F (118 y 119°C) y su punto de fusión se encuentra entre 61 y 62°F (16 y 17°C) o justo debajo de la temperatura ambiente. La densidad del ácido acético es de 1,049 g cm-3 en estado líquido, y 1,27 g cm−3 en estado sólido.
la forma más comúnmente reconocida de ácido acético es el vinagre que contiene 5-20% de ácido acético. Cuán grande es la dilución (y por lo tanto la fuerza del ácido) se conoce como su fuerza de grano., Puede calcular esto fácilmente multiplicando la concentración por 10. El vinagre que contiene 5% de ácido acético tendrá una fuerza de grano de 50.
usos del ácido acético
los usos del ácido acético son muchos y variados. Este ácido se utiliza en la fabricación de bienes, en el procesamiento de alimentos, en la industria de la limpieza, en la medicina y como suplemento para la salud. El ácido acético también es un esencial bioquímico en forma de grupo acetilo donde es fundamental para la construcción de aminoácidos y por lo tanto imposible de existir sin él. Echemos un vistazo a algunos de estos usos del ácido acético con más detalle.,
ácido acético en la fabricación de productos
El ácido acético es un reactivo químico importante utilizado para producir acetato, adhesivos, colas y telas sintéticas. El ácido acético también se usa en galvanoplastia donde un recubrimiento de metal se deposita sobre un objeto colocándolo en una solución que contiene una sal metálica específica. La solución debe ser conductiva y los ácidos que donan iones de hidrógeno crean las condiciones ideales. Además, la galvanoplastia solo puede ocurrir dentro de una solución y las sales metálicas solo se disuelven en soluciones con un valor de pH bajo (ácido).,
El ácido acético es una materia prima utilizada para la producción de acetato de celulosa, anhídrido acético (plásticos) y ácido cloroacético utilizado en la producción de colorantes y pesticidas, así como ciertos medicamentos.
ácido acético en el procesamiento de alimentos
ácido acético utilizado en el procesamiento de alimentos para regular los niveles de acidez o alcalinidad de los alimentos. El código de Regulaciones Federales (CFR) clasifica el ácido acético como un aditivo alimentario de uso general que es Seguro cuando se usa de acuerdo con las buenas prácticas de fabricación. En Europa, las regulaciones del número E se aplican a todos los aditivos alimentarios., El ácido acético se ha dado el código E260 y se considera un ingrediente seguro que controla la colonización bacteriana y se puede utilizar sin limitación. Este no es un hallazgo Nuevo. Se dice que los antiguos babilonios usaban vinagre como conservante de alimentos.
El vinagre se usa para producir aderezos para ensaladas, condimentos que incluyen mostaza, ketchup y mayonesa, y en salsas y encurtidos.,
ácido acético para la limpieza
El ácido acético se ha utilizado como producto de limpieza y desodorante durante siglos, si no milenios; esponjas de vinagre se colocaban en anillos de filigrana caros usados por los ricos cada vez que caminaban a través de calles sucias y apestosas del siglo XVIII. Las propiedades desodorizantes del vinagre también se han aprovechado durante generaciones. Los marineros usaban vinagre para fregar las cubiertas de los barcos en los que trabajaban y vivían., Los principios del control microbiano pueden no haberse entendido en ese momento, pero las características de olor fresco, limpio y de prevención de enfermedades de esta solución orgánica eran definitivamente bien conocidas.
agregar un producto alcalino al ácido causa una reacción burbujeante y burbujeante. Algunos limpiadores tradicionales creen que este efecto produce una limpieza más profunda en superficies estables., Por ejemplo, fregar el patio trasero con soda cáustica alcalina (hidróxido de sodio) y luego usar una mezcla de vinagre encima de esto desencadenará una reacción que ciertamente parece tener una acción de limpieza profunda; sin embargo, Esto hace muy poco para aumentar el efecto higiénico, sino que amortigua o funciona contra el poder de limpieza alcalina de la soda cáustica con las propiedades ácidas del vinagre.,
hoy en día, muchos fanáticos dedicados al vinagre blanco anuncian los beneficios ecológicos del uso de ácido acético diluido para limpiar baños, lavar ropa, eliminar olores y hacer que las superficies de preparación de alimentos sean limpias y seguras. El ácido acético también elimina los depósitos de óxido y cal.
ácido acético en Medicina
El ácido acético o vinagre probablemente se ha utilizado en medicina desde antes de la palabra escrita. Si usted ha sufrido de una herida abierta en la isla de Kos en el siglo IV antes de Cristo, puede haber sido prescrito un lavado de vinagre diario por Hipócrates., Si tenía dolor de garganta, también podría haberle pedido que mezclara miel y vinagre para hacer Oximel, un medicamento para la tos de la antigua Grecia; si había servido en Europa durante la Primera Guerra Mundial, solo podría haber tenido acceso al vinagre para mantenerse limpio y libre de infecciones.
hoy en día, las soluciones de ácido acético se utilizan en procesos de análisis de sangre de laboratorio como lavado de diapositivas. Eliminan las biopelículas bacterianas en las heridas y el sistema digestivo, y a menudo se han utilizado para infecciones del oído externo y así evitar el uso de antibióticos., La ingestión de vinagre aumenta los niveles de acetato en el colon y promueve la absorción de calcio con una presión arterial más baja y una mayor densidad ósea como resultado. Los estudios están investigando el uso del acetato como medicamento antitumoral.
ácido acético como suplemento de salud
El ácido acético es un suplemento de salud popular y se consume en forma de vinagre, más comúnmente vinagre de sidra de manzana. Cuando se une a la coenzima A, el grupo acetilo del ácido acético es central para el metabolismo de carbohidratos y grasas.,
se han realizado muchos estudios sobre la relación entre el consumo de vinagre y los niveles más bajos de glucosa en sangre. Cuando se consumen alimentos de alto índice glucémico después de la ingestión de dos a tres cucharadas de vinagre de sidra de manzana, se ha demostrado que sus valores glucémicos son hasta un 35% más bajos. Para los diabéticos, esto podría significar menores picos de glucosa en sangre postprandiales y un mejor control glucémico y para los no diabéticos un menor riesgo de desarrollar resistencia a la insulina. La sustitución del pepino regular por un pepino en escabeche mostró una reducción del 30% en el valor del índice glucémico total de la comida.,
la siguiente imagen muestra el efecto de los alimentos de bajo y alto índice glucémico (GI) sobre los niveles de glucosa en sangre. Los alimentos con IG alto causan un pico rápido en los niveles de glucosa en sangre que aumentan la producción de insulina, lo que permite a las células metabolizar la glucosa. Esto significa que el nivel de glucosa en sangre baja rápidamente, causando hambre. Los alimentos con IG bajo causan un aumento más suave del azúcar en la sangre y no fuerzan al páncreas a producir cantidades tan grandes de insulina. El resultado es una curva suave que se mantiene estable y no se sumerge, aumentando los niveles de saciedad después de una comida., Cuando un alimento de IG alto y un alimento de IG bajo se consumen al mismo tiempo, se anulan parcialmente entre sí, creando un efecto de meseta. Se sabe que el vinagre tiene el mismo efecto que un alimento de IG muy bajo.

como ya se mencionó, el ácido acético también se considera un suplemento para perder peso debido a su capacidad para ayuda a aumentar la saciedad., También se sugiere que la presencia de ácido acético en la dieta retrasa el vaciado gástrico, lo que también ayuda a controlar algunas formas de comer en exceso. Además, el vinagre parece desalentar la formación de grasa en dosis de tan solo quince mililitros por día.