酢酸
定義
酢酸は、軽度の腐食性のモノカルボン酸である。 そうでなければエタン酸、methanecarboxylic酸、水素のアセテートまたはethylic酸として知られていて、この有機化合物は化学製造業で、食品添加物として、そして石油の生産で使 酢酸の分子式はC2H4O2またはCH3COOHであり、–COOHは単一のカルボキシル基の存在を定義する。,

酢酸構造
酢酸構造は、単純なカルボン酸の構造であり、下の画像に見られるように、カルボキシル基に結合したメチル基—– 酢酸またはエタン酸はプロトン性溶媒であり、ヒドロン(正に荷電した水素原子)の形でプロトンを寄付することができる。, この特性は、プロトンがBrønsted塩基として知られている受容体分子に寄付されるBrønsted酸グループのメンバーであることを意味します。 この水素はカルボキシル基から解離している。 酢は酢酸と水の溶液で、酢酸分子の約0.4%がH+原子をあきらめ、約2.4phの酸性溶液に至ります。世界最強の酸であるカルボラン酸(H(CHB11Cl11))と比較して–18のpH値で、酢酸は比較して穏やかに酸性です。,
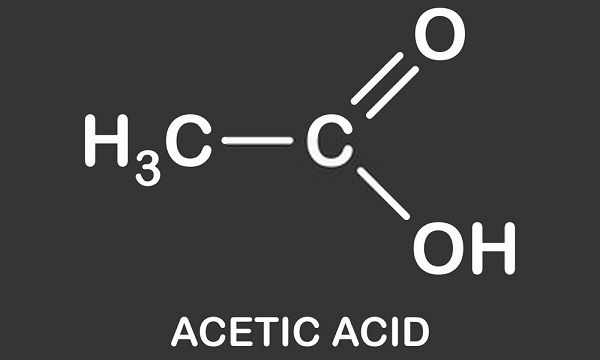
溶液のpHを変化させるのは単一の水素原子の存在ではないことを明確にする必要があります。 中性溶液(酸もアルカリも)は、ヒドロニウムイオン(H30+)とヒドロキシルイオン(OH–)のバランスの取れた数を含んでいます。 ヒドロニウムとヒドロキシルイオンが結合し、正と負の電荷がキャンセルされると、水の二つの分子(H20)が形成される。, 酢酸が水に加えられると、それは負に帯電した酢酸イオン(CH3COO–)およびH+に分割される。 したがって、酢酸の代替名–酢酸水素を理解することが可能である。 正に帯電した水素イオンのわずかな割合が水分子に結合し、それらをH30+に変える。 ることがありますhydroniumイオンのため、積極的に有料(酸性)。 したがって、溶液のpHはヒドロニウムとヒドロキシルのバランスに依存し、水素イオンの数には依存しませんが、これらはこのバランスに影響します。, 水素イオン濃度指数はまた解決にだけ与えられます。 溶液は常に水を含み、カルボランのような現代の超酸でさえ、他の酸の濃縮水溶液に溶解する。 氷酢酸でさえ少量の水を持っています。
以下の画像は、水中での酢酸と酢酸の解離を示しています。 左には単一の酢酸分子と単一の水分子があります。 酢酸は水素イオンを水分子に渡してヒドロニウムイオンを生成する。 私たちは、水分子がプロトン化されているか、またはそれにプロトン(ヒドロン)が寄付されていると言います。,
液体酢酸は、溶媒として、塩および糖などの極性(親水性)化合物および油脂を含む非極性化合物を溶解する。 これは産業化学生産で脂肪および砂糖の新陳代謝に影響を与えると同時にそれに多くの使用があるが、また減量の補足として評判を得たことを意 酢酸の使用に関するより多くの情報はこの記事で後で論議されます。, 結晶形では、二つの酢酸分子は、二量体を形成するために水素結合と一緒に結合します。 水が加えられると、これらの結合は壊れ、結晶形態は溶解する。

酢酸式
酢酸二量体
酢酸二量体
酢酸二量体
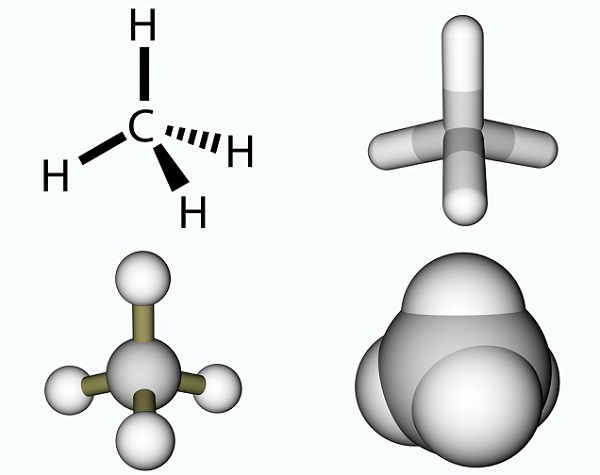
式は単純なものであり、メチル基とカルボキシル基の結果である。, メチル基は地球上で最も一般的な有機化合物の一つですが、単一のエンティティとしてはめったに見つかりません。 それらは三つの水素原子と一つの炭素原子(CH3)で構成されています。 炭素は四つの電子を持っているので、自由電子は通常、共有結合を介して他の分子と結合します。 最も単純な炭素分子は、地球温暖化への貢献でよく知られているメタン(CH4)です。 自由電子では、メタンはオゾン(O3)と反応して、(3)CH4+(4)O3=(3)CO2+(6)H2Oの反応で二酸化炭素と水を生成する。, 写真は、メチル基と余分な水素原子からなるメタン分子を示しています。
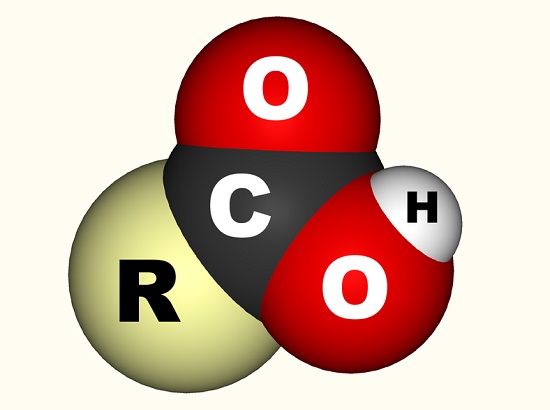
酢酸の場合、自由電子は、水酸基に結合した単一の炭素原子であるカルボキシル基(CO2H、-COOHまたは-C(=O)OH)oh)および酸素原子に二重結合している。, 下のイメージはcarboxylグループを示しますrはcarboxylグループが付す分子の残りを表します;手紙Rは時々wigglyラインによって取り替えられます。 酢酸の場合、Rはメチル基を表す。 カルボキシル基をカルボニル基(C=0、=は二重結合を示す)とヒドロキシル基(O-H)の組み合わせとして記述することを好む人もいる。 カルボン酸はアミノ酸に含まれており、すべての生物にとって不可欠です。,
すべてのカルボン酸、すなわちCnH2n+1COOHの一般的な分子式があります。 これはcarboxylグループが取除かれればあらゆるカルボン酸が炭素原子同様に多くの水素原子を二度特色にすることを意味します;酢酸C2H4O2のそれと完 この酢酸式からカルボキシル基を除去すると、一つの炭素原子と二つの水素原子が残っています。,
酢酸の事実
もう少し学びたい人のための酢酸の事実!
酢酸のモル質量は、モル当たり60.052グラム(g/mol)である。 モル質量は、原子質量単位または”amu”で測定された元素または化合物(原子質量)の総質量を、その量をモル(mol)で割ったものです。 単一のモルはアボガドロ数6.02214076×1023に基づいており、この数はモルと原子質量の別の科学的単位であるダルトンとの比較がより簡単であることを意味する。,
氷酢酸は、非常に少量の水で酢酸の溶液であり、1%以下である。 Glacialという言葉は、室温での結晶のような固体形態を指します。 氷酢酸のもう一つの名前は無水酢酸です。 この形態は弱酸であるが腐食性の毒であり、水ぶくれや火傷を引き起こす。 解離する水がほとんどないので、氷酢酸はそのプロトンを皮膚または粘膜中の水に渡すでしょう。,
酢酸のような酸のための適切な緩衝剤を見つけることは、酸のpH、KaまたはpKaの知識を必要とする。 Ph、Kaおよびpkaはすべて互いに関連している。 酢酸は、1.8×10-5のKaまたは4.756のpKa値を計算するのが簡単です。 PHは、水を含み、0(酸性)から14(塩基)の範囲を含む任意の溶液中の水素イオン(H+)の数を測定する。 PHが低いほど、水素イオンの濃度が高くなります。 Kaおよびpkaは酸に関連し、酸がそのプロトンを放棄する可能性を示す酸解離定数に関連する。, 高いKaは酸が強く、それに加えられるあらゆる化学薬品に反応することを私達に告げる。 PKaは反対です-数が小さいほど、酸は強くなります。 これは、pKaがKaの負の対数であるためです。しかしながら、濃酢酸は強酸よりも低いphを有することができる。 一定の値であるpKaのおかげで、濃度を考えることなく計算することができます。 酢酸のpKaは4.756であり、これは溶液中でその陽子を放棄する可能性がどれほど高いかを示しています。, 塩基は、それらが溶液から陽子を除去する可能性に応じて測定される。
酢酸の沸点は244と246°F(118と119°C)の間であり、その融点は61と62°F(16と17°C)の間または室温のすぐ下にあります。 酢酸の密度は、液体状態では1.049g cm-3、固体状態では1.27g cm−3である。
酢酸の最も一般的に認識されている形態は、5-20%酢酸を含む酢である。 希釈がどれほど大きいか(したがって酸の強さ)は、その粒の強さと呼ばれます。, これは、濃度に10を掛けることで簡単に計算できます。 5%酢酸を含む酢は、50の穀物強度を有することになります。
酢酸の用途
酢酸の用途は多岐にわたります。 この酸は、商品の製造、食品加工、洗浄産業、医薬品、および健康補助食品として使用されています。 酢酸はまたアミノ酸の構造に基本的、従ってなしで存在すること不可能のアセチルグループの形態で必要な生化学的です。 これらの酢酸の使用のいくつかをより詳細に見てみましょう。,
商品製造における酢酸
酢酸は、酢酸、接着剤、接着剤、および合成繊維を製造するために使用される重要な化学試薬である。 酢酸はまた金属のコーティングが目的に特定の金属の塩を含んでいる解決にそれを置くことによって沈殿する電気めっきで使用されます。 溶液は導電性である必要があり、水素イオンを供与する酸は理想的な条件を作り出す。 さらに、電気めっきは溶液内でのみ起こり、金属塩は低(酸性)pH値の溶液にのみ溶解する。,
酢酸は、酢酸セルロース、無水酢酸(プラスチック)および染料および農薬ならびに特定の薬物の製造に使用されるクロロ酢酸の製造に使用される原
食品加工における酢酸
食品の酸性度またはアルカリ度レベルを調節するために食品加工に使用される酢酸。 連邦規則(CFR)のコードはよい製造業練習に従って使用されたとき安全である一般目的の食品添加物として酢酸を分類する。 ヨーロッパでは、すべての食品添加物にEナンバー規制が適用されます。, 酢酸はコードE260を与えられ、細菌の植民地化を制御し、限定なしで使用することができる安全な原料として考慮される。 これは新しい発見ではありません。 古代バビロニア人は酢を食品防腐剤として使用したと言われています。
酢は、サラダドレッシング、マスタード、ケチャップ、マヨネーズを含む調味料、ソースやピクルスを製造するために使用されます。,
クリーニングのための酢酸
酢酸は何千年もの間、クリーニング製品および脱臭剤として使用されてきました。 酢の消臭特性も世代にわたって利用されてきました。 船員は酢を使って、彼らが働いて住んでいた船のデッキを洗い流しました。, 微生物制御の原則は当時は理解されていなかったかもしれませんが、このorganic液の新鮮な臭い、清潔で病気を防ぐ特性は間違いなくよく知られてい
酸にアルカリ生成物を添加すると、泡立ち、発泡反応を引き起こす。 ある従来の洗剤はこの効果が安定した表面により深くきれいの作り出すことを信, 例えば、アルカリ苛性ソーダ(水酸化ナトリウム)が付いている裏庭をごしごし洗い、これの上に酢の組合せを使用することは深洗浄の行為があるように確かに見る反作用を離れて置く;但し、これは衛生学の効果を高めるために少しだけではなく、酢の酸性特性が付いている苛性ソーダのアルカリ洗浄力に対して緩衝か仕事をする。,
今日、白酢の多くの熱心なファンは、希釈酢酸を使用してバスルームをきれいにし、衣服を洗い、臭いを取り除き、食品の調製面を清潔で安全にすること 酢酸はまた錆および石灰スケールの沈殿物を取除く。
医学における酢酸
酢酸または酢は、おそらく書かれた言葉の前から医学で使用されてきました。 あなたはキリストの前に四世紀にコス島で開いた傷に苦しんでいる必要があります,あなたはヒポクラテスによって毎日酢洗浄を処方されている, 喉の痛みがあったら、彼はまたOxymel、古代ギリシャの咳の薬を作るために蜂蜜および酢を混合するように頼んだかもしれない;第一次世界大戦中のヨーロッパで役立ったら、酢へのアクセスしかきれい保ち、伝染の自由に残ることができない。
今日、酢酸溶液は、スライド洗浄として実験室の血液検査プロセスで使用されています。 それらは傷および消化器系の細菌のbiofilmsを取除き、頻繁に外耳の伝染のために使用され、従って抗生物質の使用を避けます。, 酢の摂取はコロンのアセテートのレベルを増加し、低血圧およびより高い骨密度のカルシウム通風管をその結果促進します。 研究は、抗腫瘍薬としての酢酸の使用を検討しています。
健康補助食品としての酢酸
酢酸は人気のある健康補助食品であり、酢、最も一般的にはリンゴ酢の形で消費されます。 補酵素Aに結合すると、酢酸のアセチル基は炭水化物および脂肪代謝の中心である。,
酢の消費と血糖値の低下との関連について多くの研究が行われています。 高いglycemic索引の食糧がりんご酢の二から三つのテーブルスプーンの摂取後に消費されるところで、glycemic価値は35%までより低いことが示されていました。 糖尿病患者のために、これはより低いpost-prandial血ブドウ糖のピークおよびよりよいglycemic制御を意味し、非糖尿病患者のためにインシュリン抵抗性を開発する危険 漬けキュウリと通常のキュウリの置換は、総食事血糖指標値の30%の減少を示した。,
以下の画像は、血糖値に対する低および高グリセミック指数(GI)食品の効果を示しています。 高GI食品は、細胞がグルコースを代謝することを可能にするインスリン産生を増加させる血糖値の急速なピークを引き起こす。 これは、血糖値が急速に低下し、飢えを引き起こすことを意味します。 低GI食品は、血糖値の穏やかな上昇を引き起こし、膵臓にそのような大量のインスリンを産生させない。 結果は安定したままで、浸らない穏やかなカーブであり、食事の後でsatietyのレベルを高める。, 高GIの食糧および低GIの食糧が同時に食べられるとき部分的に互いを取り消し、プラトーの効果を作成する。 酢は非常に低いGIの食糧と同じ効果をもたらすために知られています。

既に述べたように、酢酸はまた、食後のピークグルコースをレベルアップする能力のために減量サプリメントであると考えられており、満腹感を高めるのに役立ちます。, また、食事中の酢酸の存在は胃排出を遅らせ、いくつかの形態の過食を制御するのにも役立つことが示唆されている。 さらに、酢は一日あたりわずか十五ミリリットルの用量で脂肪の形成を阻止するようです。